Starlix diabeedi raviks
Brändinimi: Starlix
Tavaline nimi: nategliniidi tabletid
Sisu:
Kirjeldus
Kliiniline farmakoloogia
Kliinilised uuringud
Näidustused ja kasutamine
Vastunäidustused
Ettevaatusabinõud
Kõrvaltoimed
Üleannustamine
Annustamine ja manustamine
Kuidas komplektis
Starlix, nategliniid, täielik teave patsiendi kohta (lihtsas inglise keeles)
Kirjeldus
Starlix® (nategliniid) on suukaudne diabeedivastane aine, mida kasutatakse II tüüpi suhkurtõve [tuntud ka kui insuliinisõltumatu suhkurtõve (NIDDM) või täiskasvanutel tekkiva diabeedi] raviks. Starlix, (-) - N - [(trans-4-isopropüültsükloheksaan) karbonüül] -D-fenüülalaniin, on struktuurilt sõltumatu suukaudsete sulfonüüluurea insuliini sekreteerivate ainetega.
Struktuurivalem on näidatud
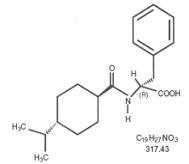
Nategliniid on valge pulber molekulmassiga 317,43. See on hästi lahustuv metanoolis, etanoolis ja kloroformis, lahustub eetris, lahustub halvasti atsetonitriilis ja oktanoolis ning praktiliselt vees. Starlixi kaksikkumerad tabletid sisaldavad suukaudseks manustamiseks 60 mg või 120 mg nategliniidi.
Mitteaktiivsed koostisosad: kolloidne ränidioksiid, kroskarmelloosnaatrium, hüdroksüpropüülmetüültselluloos, raudoksiidid (punane või kollane), laktoosmonohüdraat, magneesiumstearaat, mikrokristalne tselluloos, polüetüleenglükool, povidoon, talk ja titaan dioksiid.
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Nategliniid on aminohappe derivaat, mis alandab vere glükoositaset, stimuleerides kõhunäärmest insuliini eritumist. See toime sõltub kõhunäärme saarekestes toimivatest beetarakkudest. Nategliniid interakteerub pankrease beetarakkudes ATP-tundliku kaaliumi (K + ATP) kanaliga. Järgnev beetarakkude depolarisatsioon avab kaltsiumikanali, tekitades kaltsiumi sissevoolu ja insuliini sekretsiooni. Insuliini vabanemise ulatus sõltub glükoosist ja väheneb madala glükoositaseme korral. Nategliniid on väga kudede suhtes selektiivne ja madala afiinsusega südame- ja skeletilihaste suhtes.
Farmakokineetika
Imendumine
Pärast suukaudset manustamist vahetult enne sööki imendub nategliniid kiiresti ja ravimi keskmine plasmakontsentratsioon (Cmax) saabub tavaliselt 1 tunni jooksul (Tmax) pärast annustamist. Kui ravimit manustatakse II tüüpi diabeediga patsientidele annusevahemikus 60–240 mg kolm korda päevas ühe kohta Nädalal näitas nategliniid lineaarset farmakokineetikat nii AUC (aja / plasma kontsentratsioonikõvera alune pindala) kui ka Cmax. Tmax leiti ka selles patsiendipopulatsioonis annusest sõltumatu. Absoluutne biosaadavus on hinnanguliselt umbes 73%. Söögikordade ajal või pärast sööki ei muutu nategliniidi imendumise määr (AUC). Siiski on imendumise kiiruse hilinemine, mida iseloomustab Cmax langus ja plasma maksimaalse kontsentratsiooni (Tmax) saavutamise aeg. Plasmaprofiile iseloomustavad mitmed plasmakontsentratsiooni tipud, kui nategliniidi manustatakse tühja kõhu tingimustes. See toime väheneb, kui nategliniidi võetakse enne sööki.
Levitamine
Nategliniidi intravenoosse (IV) manustamise järgselt kogutud andmete põhjal on nategliniidi tasakaalukontsentratsiooni jaotusruumala tervetel isikutel hinnanguliselt umbes 10 liitrit. Nategliniid on ulatuslikult (98%) seotud seerumi valkudega, peamiselt seerumi albumiiniga ja vähemal määral Î ± 1 happelise glükoproteiiniga. Seerumi valkudega seondumise ulatus ei sõltu ravimi kontsentratsioonist testivahemikus 0,1-10 ug / ml.
Ainevahetus
Nategliniid metaboliseeritakse enne elimineerimist segatud funktsionaalsusega oksüdaasisüsteemi kaudu. Metabolismi peamised viisid on hüdroksüülimine, millele järgneb konjugatsioon glükuroniidiga. Peamised metaboliidid on vähem tõhusad diabeedivastased ained kui nategliniid. Isopreeni vähemtähtis metaboliit omab sama tugevust kui lähteühend nategliniid.
In vitro andmed näitavad, et nategliniid metaboliseeritakse peamiselt tsütokroom P450 isoensüümide CYP2C9 (70%) ja CYP3A4 (30%) kaudu.
Eritumine
Nategliniid ja selle metaboliidid elimineeritakse pärast suukaudset manustamist kiiresti ja täielikult. 6 tunni jooksul pärast manustamist eritus uriinist umbes 75% manustatud 14C-nategliniidist. 85 protsenti 14C-nategliniidist eritus uriiniga, täiendav 10% eritus roojaga. Ligikaudu 16% 14C-nategliniidist eritus lähteühendina uriiniga. Kõigis tervete vabatahtlike ja II tüüpi diabeediga patsientide uuringutes vähenes nategliniidi kontsentratsioon plasmas kiiresti keskmise eliminatsiooni poolväärtusajaga umbes 1,5 tundi. Kooskõlas selle lühikese eliminatsiooni poolväärtusajaga ei olnud nategliniidi kuhjumist korduval annustamisel kuni 240 mg kolm korda päevas 7 päeva jooksul.
Ravimite koostoimed
Ravimi metabolismi uuringud in vitro näitavad, et Starlix metaboliseerub peamiselt tsütokroom P450 isosüümi CYP2C9 (70%) ja vähemal määral CYP3A4 (30%) kaudu. Starlix on in vivo CYP2C9 isoensüümi potentsiaalne inhibiitor, mida näitab tema võime inhibeerida tolbutamiidi in vitro metabolismi. In vitro katsetes ei tuvastatud CYP3A4 metaboolsete reaktsioonide pärssimist.
Glüburiid: Randomiseeritud, mitmeannuselises ristumisuuringus osalesid II tüüpi diabeediga patsiendid manustatud 120 mg Starlixi kolm korda päevas enne sööki 1 päeva jooksul koos glüburiidiga 10 mg päevas. Kummagi toimeaine farmakokineetikas ei olnud kliiniliselt olulisi muutusi.
Metformiin: kui Starlix'i manustati 120 mg kolm korda päevas enne sööki koos metformiiniga 500 mg kolm II tüüpi suhkurtõvega patsientide puhul ei olnud kummagi farmakokineetikas kliiniliselt olulisi muutusi agent.
Digoksiin: kui Starlix'i 120 mg enne sööki manustati koos ühekordse 1 mg annusega Digoksiini manustamisel tervetele vabatahtlikele ei esinenud kummagi farmakokineetikas kliiniliselt olulisi muutusi agent.
Varfariin: kui tervetele katsealustele manustati Starlixit 120 mg kolm korda päevas enne sööki nelja päeva jooksul koos varfariini ühekordse annusega 30 mg teisel päeval, ei olnud kummagi farmakokineetikas mingeid muutusi agent. Protrombiini aeg ei muutunud.
Diklofenak: Starlixi 120 mg hommikuse ja lõunaeine annuse manustamine koos ühe 75 mg annusega diklofenaki annus tervetel vabatahtlikel ei põhjustanud kummagi farmakokineetikas olulisi muutusi agent.
Eripopulatsioonid
Geriaatrilised: vanus ei mõjutanud nategliniidi farmakokineetilisi omadusi. Seetõttu ei ole eakatel patsientidel vaja annust kohandada.
Sugu: Nategliniidi farmakokineetikas ei olnud meeste ja naiste seas kliiniliselt olulisi erinevusi. Seetõttu ei ole vaja soolist annust kohandada.
Rass: Kaukaasia, mustanahaliste ja muude etniliste päritolude populatsiooni farmakokineetilise analüüsi tulemused näitavad, et rassil on nategliniidi farmakokineetikale vähe mõju.
Neerukahjustus: Võrreldes tervete uuringus osalenud patsientidega, II tüüpi diabeediga ja mõõdukas kuni raske neerupuudulikkus (CrCl 15-50 ml / min), mida ei kasutata dialüüsil, ilmnes sarnaselt kliirens, AUC ja Cmax. Dialüüsi saavatel II tüüpi diabeediga ja neerupuudulikkusega patsientidel oli ravimi üldine kokkupuude vähenenud. Kuid hemodialüüsi saavatel patsientidel vähenes plasmavalkudega seondumine ka teiste tervete vabatahtlikega.
Maksakahjustus: kerge maksapuudulikkusega mittediabeetilistel isikutel suurenes nategliniidi maksimaalne ja üldine ekspositsioon 30% võrreldes teiste tervete katsealustega. Starlix® (nategliniid) tuleb kroonilise maksahaigusega patsientidel kasutada ettevaatusega. (Vt. ETTEVAATUSABINÕUD, Maksakahjustus.)
Farmakodünaamika
Starlix imendub kiiresti ja stimuleerib pankrease insuliini sekretsiooni 20 minuti jooksul pärast suu kaudu manustamist. Kui Starlix'i manustatakse kolm korda päevas enne sööki, tõuseb plasmainsuliin kiiresti, tipptase tõuseb umbes 1 tund pärast annustamist ja langeb algtasemele 4 tundi pärast manustamist.
Topeltpimedas kontrollitud kliinilises uuringus, milles Starlixi manustati enne iga kolme söögikordade ajal määrati plasma glükoositase 12-tunnise päevase perioodi jooksul pärast 7-nädalast manustamist ravi. Starlixi manustati 10 minutit enne sööki. Söögikorrad põhinesid diabeetilise kaalu säilitamise standardmenüüdel, mille üldine kalorisisaldus põhineb iga inimese pikkusel. Starlix põhjustas tühja kõhuga ja söögijärgse glükeemia statistiliselt olulist langust võrreldes platseeboga.
ülaosa
Kliinilised uuringud
Starlix® (nategliniid) ohutuse ja efektiivsuse hindamiseks randomiseeriti üheksas topeltpimedas, platseebo- või aktiivkontrolliga uuringus 8 kuni 24 nädalat kestnud uuringus 3566 patsienti. 3513 patsiendil olid efektiivsuse väärtused algväärtusest kõrgemad. Nendes uuringutes manustati Starlixit kuni 30 minutit enne iga kolme põhitoidukorda päevas.
Starlix® monoteraapia, võrreldes platseeboga
Randomiseeritud, topeltpimedas, platseebokontrollitud 24-nädalases uuringus osales II tüüpi diabeediga HbA1C-ga patsiente - 6,8% ainult dieedil randomiseeriti kas Starlixi (60 mg või 120 mg kolm korda päevas enne sööki) või platseebo saamiseks. HbA1C algväärtus oli vahemikus 7,9% kuni 8,1% ja 77,8% patsientidest ei olnud varem suukaudse diabeediraviga ravitud. Varem diabeediravimitega ravitud patsiendid pidid enne randomiseerimist katkestama selle ravi vähemalt kaheks kuuks. Starlixi lisamine enne sööki tõi kaasa platseeboga võrreldes statistiliselt olulise keskmise HbA1C ja tühja kõhu plasma glükoosisisalduse (FPG) vähenemise (vt tabel 1). HbA1C ja FPG langus oli sarnane diabeediravimiteta patsientide ja nende patsientide puhul, kes olid varem seda saanud.
Selles uuringus esines patsiendil, keda raviti Starlixiga 120 mg kolm korda päevas enne sööki, üks tõsise hüpoglükeemia episood (plasma glükoosisisaldus <36 mg / dL). Ühelgi patsiendil ei esinenud hüpoglükeemiat, mis nõuaks kolmanda osapoole abi. Starlixiga ravitud patsientidel oli statistiliselt oluline keskmine kehakaalu tõus platseeboga võrreldes (vt tabel 1).
Teises randomiseeritud, topeltpimedas, 24-nädalases, aktiivse ja platseebo-kontrollitud uuringus randomiseeriti II tüüpi diabeediga patsiendid Starlixi (120 mg kolm korda iga päev enne sööki), metformiin 500 mg (kolm korda päevas), Starlixi annus 120 mg (kolm korda päevas enne sööki) ja metformiin 500 mg (kolm korda päevas) või platseebo. HbA1C algväärtus oli vahemikus 8,3% kuni 8,4%. Viiskümmend seitse protsenti patsientidest ei olnud varem suukaudse diabeediraviga ravitud. Starlixi monoteraapia tulemusel vähenes HbA1C ja FPG keskmine väärtus platseeboga võrreldes märkimisväärselt, sarnaselt ülaltoodud uuringu tulemustele (vt tabel 2).
Tabel 1: Starlix® monoteraapia 24-nädalase fikseeritud annusega uuringu tulemusnäitajate tulemused
|
Platseebo |
Starlix® 60 mg kolm korda iga päev enne sööki |
Starlix® 120 mg kolm korda iga päev enne sööki |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Baasjoon (keskmine) | 8.0 | 7.9 | 8.1 |
| Muutus algtasemest (keskmine) | +0.2 | -0.3 | -0.5 |
| Erinevus platseebost (keskmine) | -0.5 a | -0.7 a | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Baasjoon (keskmine) | 167.9 | 161.0 | 166.5 |
| Muutus algtasemest (keskmine) | +9.1 | +0.4 | -4.5 |
| Erinevus platseebost (keskmine) | -8.7 a | -13.6 a | |
| Kaal (kg) | N = 170 | N = 169 | N = 166 |
| Baasjoon (keskmine) | 85.8 | 83.7 | 86.3 |
| Muutus algtasemest (keskmine) | -0.7 | +0.3 | +0.9 |
| Erinevus platseebost (keskmine) | +1.0 a | +1.6 a |
p-väärtus â ‰ ¤ 0,004
Starlix® monoteraapia, võrreldes teiste suukaudsete diabeediravimitega
Glüburiid
24-nädalases topeltpimedas, aktiivselt kontrollitud uuringus II tüüpi diabeediga patsiendid, kes olid olnud sulfonüüluureaga umbes 3 kuud ja kes kellel oli HbA1C algväärtus - 6,5% randomiseeriti saama Starlixi (60 mg või 120 mg kolm korda päevas enne sööki) või glüburiidi 10 mg üks kord iga päev. Starlixi järgi randomiseeritud patsientidel suurenes HbA1C ja FPG keskväärtus märkimisväärselt lõpp-punktis võrreldes glüburiidiga randomiseeritud patsientidega.
Metformiin
Teises randomiseeritud, topeltpimedas, 24-nädalases, aktiivse ja platseebo-kontrollitud uuringus randomiseeriti II tüüpi diabeediga patsiendid Starlixi (120 mg kolm korda iga päev enne sööki), metformiin 500 mg (kolm korda päevas), Starlixi annus 120 mg (kolm korda päevas enne sööki) ja metformiin 500 mg (kolm korda päevas) või platseebo. HbA1C algväärtus oli vahemikus 8,3% kuni 8,4%. Viiskümmend seitse protsenti patsientidest ei olnud varem suukaudse diabeediraviga ravitud. Keskmine HbA1C ja keskmise FPG langus metformiiniga monoteraapia tulemusnäitajas oli oluliselt suurem kui nende muutujate vähenemine Starlixi monoteraapia korral (vt tabel 2). Platseeboga võrreldes seostati Starlixi monoteraapiat keskmise kehakaalu olulise suurenemisega, metformiini monoteraapiaga aga keskmise kehakaalu olulise vähenemisega. Diabeedivastase ravita patsientide alagrupis olid Starlixi monoteraapia keskmise HbA1C ja keskmise FPG langused sarnased metformiini monoteraapiaga (vt tabel 2). Patsientide alarühmas, keda on varem ravitud teiste diabeediravimitega, peamiselt glüburiidiga, HbA1C Starlixis monoteraapia rühmas suurenes algtasemest pisut enam, samal ajal kui HbA1C vähenes metformiini monoteraapia rühmas (vt tabel 5) 2).
Starlix® kombineeritud teraapia
Metformiin
Teises randomiseeritud, topeltpimedas, 24-nädalases, aktiivse ja platseebo-kontrollitud uuringus randomiseeriti II tüüpi diabeediga patsiendid Starlixi (120 mg kolm korda iga päev enne sööki), metformiin 500 mg (kolm korda päevas), Starlixi annus 120 mg (kolm korda päevas enne sööki) ja metformiin 500 mg (kolm korda päevas) või platseebo. HbA1C algväärtus oli vahemikus 8,3% kuni 8,4%. Viiskümmend seitse protsenti patsientidest ei olnud varem suukaudse diabeediraviga ravitud. Varem diabeediravimitega ravitud patsiendid pidid enne randomiseerimist katkestama ravi vähemalt kaheks kuuks. Starlixi ja metformiini kombinatsioon põhjustas statistiliselt oluliselt suuremat HbA1C ja FPG langust võrreldes kas Starlixi või metformiiniga monoteraapiaga (vt tabel 2). Starlix üksi või kombinatsioonis metformiiniga vähendas praktiliselt glükoosisisalduse tõusu söögieelselt 2 tunnini pärast sööki, võrreldes ainult platseebo ja metformiiniga.
Selles uuringus registreeriti patsiendil, kes sai raskekujulise hüpoglükeemia episoodi (plasma glükoosisisaldus 36 mg / dl). Starlixi ja metformiini kombinatsioonist ja ühel metformiiniga patsiendil esines neli tõsise hüpoglükeemia episoodi ravivars. Ühelgi patsiendil ei esinenud hüpoglükeemia episoodi, mis vajas kolmanda osapoole abi. Võrreldes platseeboga seostati Starlixi monoteraapiat statistiliselt olulise kaalu suurenemisega, samal ajal kui Starlixi ja metformiiniga kombineeritud ravi korral olulisi kehakaalu muutusi ei täheldatud (vt tabel 2).
Ühes teises 24-nädalases topeltpimedas, platseebokontrollitud uuringus alustati esmakordselt II tüüpi diabeediga patsientidega, kellel oli HbA1C - 6,8% pärast ravi metformiiniga (â ‰ mg 1500 mg päevas 1 kuu jooksul). metformiiniga monoteraapia neljanädalasesse sissejuhatavasse perioodi (2000 mg päevas) ja randomiseeriti seejärel lisaks metformiinile saama ka Starlixit (60 mg või 120 mg kolm korda päevas enne sööki) või platseebot. Starlixi ja metformiiniga kombineeritud ravi seostati statistiliselt oluliselt suurema protsendi langusega HbA1C võrreldes monoteraapiana metformiiniga (-0,4% ja -0,6% Starlix 60 mg ja Starlix 120 mg pluss metformiin, vastavalt).
Tabel 2: Starlix®-monoteraapia ja metformiiniga kombinatsiooni 24-nädalase uuringu tulemusnäitajad
|
Platseebo |
Starlix® 120 mg kolm korda iga päev enne söögikorrad |
Metformiin 500 mg kolm korda iga päev |
Starlix® 120 mg enne söögid pluss Metformiin * |
|
| HbA1C (%) | ||||
| Kõik | N = 160 | N = 171 | N = 172 | N = 162 |
| Baasjoon (keskmine) | 8.3 | 8.3 | 8.4 | 8.4 |
| Muutus algtasemest (keskmine) | +0.4 | -0.4 bc | -0.8 c | -1.5 |
| Erinevus platseebost | -0.8 a | -1.2 a | -1.9 a | |
| NaÑ - ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Baasjoon (keskmine) | 8.2 | 8.1 | 8.3 | 8.2 |
| Muutus algtasemest (keskmine) | +0.3 | -0.7 c | -0.8 c | -1.6 |
| Erinevus platseebost | -1.0 a | -1.1 a | -1.9 a | |
| Mitte-NaÑve | N = 62 | N = 72 | N = 74 | N = 81 |
| Baasjoon (keskmine) | 8.3 | 8.5 | 8.7 | 8.7 |
| Muutus algtasemest (keskmine) | +0.6 | +0.004 bc | -0.8 c | -1.4 |
| Erinevus platseebost | -0.6 a | -1.4 a | -2.0 a | |
| FPG (mg / dL) | ||||
| Kõik | N = 166 | N = 173 | N = 174 | N = 167 |
| Baasjoon (keskmine) | 194.0 | 196.5 | 196.0 | 197.7 |
| Muutus algtasemest (keskmine) | +8.0 | -13.1 bc | -30.0 c | -44.9 |
| Erinevus platseebost | -21.1 a | -38.0 a | -52.9 a | |
| Kaal (kg) | ||||
| Kõik | N = 160 | N = 169 | N = 169 | N = 160 |
| Baasjoon (keskmine) | 85.0 | 85.0 | 86.0 | 87.4 |
| Muutus algtasemest (keskmine) | -0.4 | +0.9 bc | -0.1 | +0.2 |
| Erinevus platseebost | +1.3 a | +0.3 | +0.6 |
p-väärtus - 0,05 vs. platseebo
b p-väärtus â ‰ ¤ 0,03 vs. metformiin
c p-väärtus â ‰ ¤ 0,05 vs. kombinatsioon
* Metformiini manustati kolm korda päevas
Rosiglitasoon
II tüüpi patsientidega viidi läbi 24-nädalane topeltpime multitsentriline platseebokontrollitud uuring diabeet, mille ravi pärast ravivastust 8 mg rosiglitasooniga ei ole piisavalt kontrolli all iga päev. Starlixi (120 mg kolm korda päevas koos toiduga) lisamine oli seotud statistiliselt oluliselt suurema HbA1C langusega võrreldes rosiglitasooni monoteraapiaga. Erinevus oli 24. nädalal -0,77%. Keskmine kaalumuutus võrreldes algtasemega oli Starlixiga pluss rosiglitasooniga ravitud patsientidel umbes +3 kg, platseebo ja rosiglitasooniga ravitud patsientidel umbes +1 kg.
Glüburiid
12-nädalases uuringus II tüüpi diabeediga patsientidega, kelle glüburiidi annus 10 mg üks kord päevas ei olnud piisav. Starlixi (60 mg või 120 mg kolm korda päevas enne sööki) lisamine ei andnud täiendavat toimet kasu.
ülaosa
Näidustused ja kasutamine
Starlix® (nategliniid) on näidustatud dieedi ja treeningu lisana, et parandada II tüüpi suhkurtõvega täiskasvanute glükeemilist kontrolli.
ülaosa
Vastunäidustused
Starlix® (nategliniid) on vastunäidustatud patsientidele, kellel on:
1. Teadaolev ülitundlikkus ravimi või selle inaktiivsete koostisosade suhtes.
2. 1. tüüpi diabeet.
3. Diabeetiline ketoatsidoos. Seda seisundit tuleb ravida insuliiniga.
ülaosa
Ettevaatusabinõud
Makrovaskulaarsed tulemused: Starlixi või mõne muu diabeedivastase ravimi kasutamisel pole veenvaid tõendeid makrovaskulaarse riski vähenemise kohta.
Hüpoglükeemia: kõik suukaudsed veresuhkru taset alandavad ravimid, mis imenduvad süsteemselt, on võimelised tekitama hüpoglükeemiat. Hüpoglükeemia sagedus on seotud suhkruhaiguse raskuse, glükeemilise kontrolli taseme ja muude patsiendi omadustega. Geriaatrilised patsiendid, alatoitumusega patsiendid ning neerupealiste või hüpofüüsi puudulikkusega või raske neerukahjustusega patsiendid on nende ravimite glükoosisisaldust langetava toime suhtes vastuvõtlikumad. Hüpoglükeemia riski võib suurendada pingutav füüsiline koormus, alkoholi tarvitamine, ebapiisav kalorite tarbimine ägedal või kroonilisel alusel või kombinatsioonid teiste suukaudsete diabeediravimitega esindajad. Hüpoglükeemiat võib olla raske tuvastada autonoomse neuropaatiaga patsientidel ja / või neil, kes kasutavad beetablokaatoreid. Starlix® (nategliniid) tuleb manustada enne sööki, et vähendada hüpoglükeemia riski. Söögikorrad vahelejäänud patsiendid peaksid hüpoglükeemia riski vähendamiseks vahele jätma ka kavandatud Starlixi annuse.
Maksakahjustus: Starlixi tuleb mõõduka kuni raske maksahaigusega patsientide puhul kasutada ettevaatusega, kuna selliseid patsiente ei ole uuritud.
Glükeemilise kontrolli kaotus
Mööduv glükeemilise kontrolli kaotamine võib tekkida palaviku, infektsiooni, trauma või operatsiooni ajal. Sellistel aegadel võib Starlixi ravi asemel olla vajalik insuliinravi. Võib ilmneda sekundaarne tõrge või Starlixi efektiivsuse vähenemine teatud aja jooksul.
Teave patsientidele
Patsiente tuleb teavitada Starlixi võimalikest riskidest ja eelistest ning alternatiivsetest raviviisidest. Tuleks selgitada hüpoglükeemia riske ja juhtimist. Patsiente tuleb juhendada võtma Starlixit 1–30 minutit enne sööki, kuid söögikorra vahele jätmise korral tuleb annus vahele jätta, et hüpoglükeemia oht väheneks. Patsientidega tuleks arutada ravimite koostoimet. Patsiente tuleb teavitada võimalikest ravimite koostoimetest Starlixiga.
Laborikatsed
Ravivastust tuleb perioodiliselt hinnata glükoosiväärtuste ja HbA1C taseme järgi.
Ravimite koostoimed
Nategliniid seondub tugevalt plasmavalkudega (98%), peamiselt albumiiniga. In vitro väljatõrjumiskatsed tugevalt valkudega seotud ravimitega nagu furosemiid, propranolool, kaptopriil, nikardipiin, pravastatiin, glüburiid, varfariin, fenütoiin, atsetüülsalitsüülhape, tolbutamiid ja metformiin ei mõjutanud nategliniidvalgu ulatust siduv. Samuti ei mõjutanud nategliniid in vitro propranolooli, glüburiidi, nikardipiini, varfariini, fenütoiini, atsetüülsalitsüülhappe ja tolbutamiidi seondumist valkudega. Üksikjuhtumite kaalutletud hindamine on kliinilises keskkonnas siiski õigustatud.
Teatavad ravimid, sealhulgas mittesteroidsed põletikuvastased ained (MSPVA-d), salitsülaadid, monoaminooksüdaasi inhibiitorid ja mitteselektiivsed beeta-adrenoblokaatorid võivad tugevdada Starlixi ja teiste suukaudsete diabeedivastaste ravimite hüpoglükeemilist toimet narkootikumid.
Teatud ravimid, sealhulgas tiasiidid, kortikosteroidid, kilpnäärmeproduktid ja sümpatomimeetikumid, võivad vähendada Starlixi ja teiste suukaudsete diabeediravimite hüpoglükeemilist toimet.
Neid ravimeid Starlixi saavatel patsientidel manustades või nendelt ära võttes tuleb patsienti hoolikalt jälgida glükeemilise kontrolli muutuste suhtes.
Ravimi ja toidu koostoimed
Toidu koostis (kõrge valgusisalduse, rasva või süsivesikute sisaldus) ei mõjutanud nategliniidi farmakokineetikat. Starlixi manustamisel 10 minutit enne vedelat sööki oli vereplasma maksimaalne sisaldus siiski märkimisväärselt langenud. Atsetaminofeeni testimisel hinnati, et Starlix ei mõjutanud tervete inimeste mao tühjenemist.
Kantserogenees / Mutagenees / Viljakuse langus
Kantserogeensus: Sprague-Dawley rottidega tehti kaheaastane kartsinogeensuse uuring nategliniidi suukaudsete annustega kuni 900 mg / kg päevas, mis põhjustas AUC isastel ja emastel rottidel vastavalt umbes 30 ja 40-kordne terapeutiline ekspositsioon Starlixi soovitatavast annusest 120 mg kolm korda päevas enne söögikorrad. Kaheaastane kartsinogeensuse uuring B6C3F1 hiirtega viidi läbi suukaudsete nategliniidi annustega kuni 400 mg / kg päevas, mis andis AUC ekspositsiooni isastel ja emased hiired umbes 10 ja 30-kordse inimese terapeutilisest ekspositsioonist soovitatava Starlixi annusega 120 mg kolm korda päevas enne sööki. Rottidel ega hiirtel ei leitud tumorigeense vastuse tunnuseid.
Mutagenees: Nategliniid ei olnud genotoksiline in vitro Ames'i testis, hiire lümfoomi testis, hiina hamstri kopsurakkude kromosoomaberratsiooni katses ega hiire in vivo mikrotuuma testis.
Viljakuse langus: Nategliniidi manustamine rottidele annustes kuni 600 mg / kg ei mõjutanud viljakust. (umbes 16-kordne inimese terapeutiline ekspositsioon, Starlixi soovitatav annus on 120 mg kolm korda päevas enne seda söögikorrad).
Rasedus
C-kategooria rasedus
Nategliniid ei olnud rottidel teratogeenne annustes kuni 1000 mg / kg (ligikaudu 60-kordne inimese terapeutiline ekspositsioon soovitatud Starlixi annusega 120 mg kolm korda päevas enne sööki). Küülikul oli embrüonaalne areng kahjulik ja sapipõie ageneesi või väikese sapipõie esinemissagedus suurenes annus 500 mg / kg (ligikaudu 40 korda suurem inimese terapeutilisest ekspositsioonist soovitatud Starlixi annusega 120 mg kolm korda päevas enne söögikorrad). Rasedatel ei ole piisavalt ja hästi kontrollitud uuringuid. Starlixi ei tohi raseduse ajal kasutada.
Tööjõud ja sünnitus
Starlixi mõju sünnitusele ja sünnitusele inimestel pole teada.
Imetavad emad
Imetavate rottidega tehtud uuringud näitasid, et nategliniid eritub piima; piima ja plasma AUC0-48h suhe oli umbes 1: 4. Peri- ja postnataalsel perioodil oli kehamass nategliniidi annuses 1000 mg / kg manustatud rottide järglastel madalam. (umbes 60-kordne inimese terapeutiline ekspositsioon soovitatava Starlixi annusega 120 mg kolm korda päevas enne seda söögikorrad). Ei ole teada, kas Starlix eritub inimese rinnapiima. Kuna paljud ravimid erituvad inimese rinnapiima, ei tohiks Starlixit imetavale naisele manustada.
Kasutamine lastel
Starlixi ohutus ja efektiivsus lastel ei ole tõestatud.
Geriaatriline kasutamine
Starlixi ohutuses ja efektiivsuses ei täheldatud erinevusi 65-aastaste ja vanemate ning alla 65-aastaste patsientide vahel. Siiski ei saa välistada mõne vanema patsiendi suuremat tundlikkust Starlix-ravi suhtes.
ülaosa
Kõrvaltoimed
Kliinilistes uuringutes raviti Starlix®-iga (nategliniid) umbes 2600 II tüüpi diabeediga patsienti. Neist umbes 1335 patsienti raviti 6 kuud või kauem ja umbes 190 patsienti ühe aasta või kauem.
Hüpoglükeemia oli kliiniliste uuringute kõigis ravirühmades suhteliselt haruldane. Ainult 0,3% Starlixi patsientidest katkestas hüpoglükeemia tõttu. Seedetrakti sümptomid, eriti kõhulahtisus ja iiveldus, ei olnud Starlixi ja metformiini kombinatsiooni kasutavatel patsientidel enam levinud kui patsientidel, kes said ainult metformiini. Samuti ei olnud perifeerne turse sagedamini patsientidel, kes kasutasid Starlixi ja rosiglitasooni kombinatsiooni, kui patsientidel, kes said ainult rosiglitasooni. Järgmises tabelis on loetletud juhtumid, mida kontrollitud kliinilistes uuringutes esines Starlixi patsientidel sagedamini kui platseebot saanud patsientidel.
Sagedased kõrvaltoimed (‰ ‰ 2% Starlix® patsientidel) Starlix® monoteraapia uuringutes (% patsientidest)
| Platseebo | Starlix® | |
| N = 458 | N = 1441 | |
| Eelistatud tähtaeg | ||
| Ülemine hingamisteede infektsioon | 8.1 | 10.5 |
| Seljavalu | 3.7 | 4.0 |
| Gripi sümptomid | 2.6 | 3.6 |
| Peapööritus | 2.2 | 3.6 |
| Artropaatia | 2.2 | 3.3 |
| Kõhulahtisus | 3.1 | 3.2 |
| Juhuslik trauma | 1.7 | 2.9 |
| Bronhiit | 2.6 | 2.7 |
| Köha | 2.2 | 2.4 |
| Hüpoglükeemia | 0.4 | 2.4 |
Turustamisjärgse kogemuse ajal on teatatud harvadest ülitundlikkusreaktsioonide juhtudest, nagu lööve, sügelus ja urtikaaria. Samuti on teatatud kollatõvest, kolestaatilisest hepatiidist ja maksaensüümide aktiivsuse suurenemisest.
Laboratoorsed kõrvalekalded
Kusihape: Ainult Starlixiga ravitud patsientide, Starlixi kombinatsioonis metformiini, metformiini üksi ja glüburiidiga ravitud patsientide keskmine kusihappe sisaldus tõusis. Vastavad erinevused platseeboga võrreldes olid 0,29 mg / dL, 0,45 mg / dL, 0,28 mg / dL ja 0,19 mg / dL. Nende leidude kliiniline tähtsus pole teada.
ülaosa
Üleannustamine
II tüüpi diabeediga patsientide kliinilises uuringus manustati Starlix® (nategliniid) suurendades annuseid 720 mg-ni päevas 7 päeva jooksul ja kliiniliselt olulisi kõrvaltoimeid ei esinenud teatatud. Kliinilistes uuringutes pole Starlixi üleannustamise juhtumeid olnud. Üleannustamine võib aga põhjustada hüpoglükeemiliste sümptomite tekkega liialdatud glükoosisisaldust vähendavat toimet. Hüpoglükeemilisi sümptomeid ilma teadvuse kaotuseta või neuroloogiliste leidudeta tuleb ravida suu kaudu manustatava glükoosiga ning annuse ja / või söögikorra kohandamisega. Raskeid hüpoglükeemilisi reaktsioone koos kooma, krampide või muude neuroloogiliste sümptomitega tuleb ravida veenisisese glükoosiga. Kuna nategliniid on seotud suurel määral valkudega, pole dialüüs efektiivne vahend selle eemaldamiseks verest.
ülaosa
Annustamine ja manustamine
Starlix® (nategliniid) tuleb võtta 1 kuni 30 minutit enne sööki.
Monoteraapia ja kombinatsioon metformiiniga või tiasolidiindiooniga
Starlixi soovitatav algannus ja säilitusannus üksi või koos metformiini või tiasolidiindiooniga on 120 mg kolm korda päevas enne sööki.
Starlixi 60 mg annust, kas üksi või kombinatsioonis metformiini või tiasolidiindiooniga, võib kasutada patsientidel, kellel ravi alguses on eesmärk HbA1C lähedal.
Annustamine geriaatrilistel patsientidel
Annuse kohandamine pole tavaliselt vajalik. Siiski ei saa välistada mõne inimese suuremat tundlikkust Starlix-ravi suhtes.
Annustamine neeru- ja maksapuudulikkuse korral
Kerge kuni raske neerupuudulikkusega või kerge maksapuudulikkusega patsientidel ei ole annuse kohandamine vajalik. Mõõduka kuni raske maksafunktsiooni häirega patsientide annustamist ei ole uuritud. Seetõttu tuleb Starlix'i kasutada mõõduka kuni raske maksahaigusega patsientide puhul ettevaatusega (vt ettevaatusabinõud, maksakahjustus).
ülaosa
Kuidas komplektis
Starlix® (nategliniid) tabletid
60 mg
Roosa, ümmargune, kaldus servaga tablett, mille ühele küljele on pressitud "Starlix" ja teisele küljele "60".
Pudelid 100... NDC 0078-0351-05
120 mg
Kollane ovaalne tablett, mille ühele küljele on pressitud "Starlix" ja teisele küljele "120".
Pudelid 100... NDC 0078-0352-05
Ladustamine
Hoida temperatuuril 25 ° C (77 ° F); ekskursioonid on lubatud temperatuurini 15 ° C – 30 ° C (59 ° F – 86 ° F).
Väljastage tihedas pakendis, USP.
T2008-01
REV: juuli 2008
Toodetud:
Novartis Pharma Stein AG
Stein, Šveits
Jaotatud:
Novartis Pharmaceuticals Corporation
Ida-Hanover, New Jersey 07936
© Novartis
Viimati värskendatud 07/2008
Starlix, nategliniid, täielik teave patsiendi kohta (lihtsas inglise keeles)
Üksikasjalik teave diabeedi märkide, sümptomite, põhjuste, ravi kohta
Selles monograafias sisalduv teave ei ole mõeldud hõlmama kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet või kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi: Sirvige kõiki diabeediravimeid



