Byetta diabeedi raviks
Brändinimi: Byetta
Üldnimi: Exenatide
Annustamisvorm: süst
Sisu:
Kirjeldus
Kliiniline farmakoloogia
Kliinilised uuringud
Näidustused ja kasutamine
Vastunäidustused
Ettevaatusabinõud
Kõrvaltoimed
Üleannustamine
Annustamine ja manustamine
Ladustamine
Kuidas komplektis
Byetta (Exenatide) teave patsiendi kohta (lihtsas inglise keeles)
Kirjeldus
Byetta® (eksenatiid) on sünteetiline peptiid, millel on inkretiinimimeetiline toime ja mis tuvastati algselt sisaliku Heloderma kahtlustuses. Byetta suurendab kõhunäärme beetarakkude kaudu glükoosist sõltuvat insuliini sekretsiooni, pärsib sobimatult kõrgendatud glükagooni sekretsiooni ja aeglustab mao tühjenemist. Eksenatiid erineb keemilise struktuuri ja farmakoloogilise toime poolest insuliinist, sulfonüüluureast (sh D-fenüülalaniini derivaadid ja meglitiniidid), biguaniidid, tiasolidiindioonid ja alfa-glükosidaas inhibiitorid.
Eksenatiid on 39 aminohappe happepeptiidi amiid. Eksenatiidil on empiiriline valem C184H282N50O60S ja molekulmass 4186,6 daltonit. Eksenatiidi aminohappeline järjestus on näidatud allpool.
H - Tema - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Ser - NH2
Byetta tarnitakse subkutaanseks (SC) süstimiseks steriilse konserveeritud isotoonilise lahusena klaasist kolbampullis, mis on kokku pandud sulepeaga. Üks milliliiter (ml) sisaldab 250 mikrogrammi (mcg) sünteetilist eksenatiidi, antimikroobse säilitusainena 2,2 mg metakresooli, toonust reguleeriva ainena mannitooli ja jää-äädikhape ja naatriumatsetaat-trihüdraat süstevees puhverlahusena, mille pH on 4,5. Saadaval on kaks eeltäidetud pensüstelit ühikdoosidena 5 mikrogrammi või 10 mikrogrammi. Iga eeltäidetud pensüstel väljastab 60 annust, et tagada 30-päevane manustamine kaks korda päevas (BID).
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Inkretiinid, nagu glükagoonisarnane peptiid-1 (GLP-1), suurendavad glükoosist sõltuvat insuliini sekretsiooni ja avaldavad muid hüperglükeemilisi toimeid pärast nende ringlust vereringes soolestikust. Eksenatiid on inkretiini jäljendav aine, mis jäljendab glükoosist sõltuva insuliini sekretsiooni tugevnemist ja inkretiinide mitut muud hüperglükeemilist toimet.
Eksenatiidi aminohappeline järjestus kattub osaliselt inimese GLP-1 omaga. On näidatud, et eksenatiid seob ja aktiveerib inimese teadaolevat GLP-1 retseptorit in vitro. See viib nii glükoosist sõltuva insuliini sünteesi kui ka insuliini sekretsiooni in vivo suurenemiseni pankrease beetarakkudest tsüklilise AMP ja / või muu rakusisese signaaliülekande kaudu radu. Eksenatiid soodustab kõrgema glükoosikontsentratsiooni korral beetarakkudest insuliini vabanemist. In vivo manustamisel jäljendab eksenatiid GLP-1 teatavaid hüperglükeemilisi toimeid.
Byetta parandab glükeemilist kontrolli, vähendades allpool kirjeldatud toimingute kaudu 2. tüüpi diabeediga patsientide tühja kõhu ja söögijärgse glükoosikontsentratsiooni.
Glükoosist sõltuv insuliini sekretsioon: Byetta avaldab ägedat mõju pankrease beetarakkude reageerimisele glükoosile ja põhjustab insuliini vabanemist ainult kõrgenenud glükoosikontsentratsiooni korral. See insuliini sekretsioon kaob, kui veresuhkru kontsentratsioon väheneb ja läheneb euglükeemiale.
Esimese faasi insuliinivastus: Tervetel inimestel toimub insuliini tugev sekretsioon esimese 10 minuti jooksul pärast intravenoosset (IV) glükoosi manustamist. Seda sekretsiooni, mida nimetatakse "esimese faasi insuliinivastuseks", puudub II tüüpi diabeediga patsientidel iseloomulikult. Esimese faasi insuliinivastuse kaotamine on II tüüpi diabeedi varajane beetarakkude defekt. Byetta manustamine terapeutilises plasmakontsentratsioonis taastas II tüüpi diabeediga patsientidel esimese faasi insuliinivastuse glükoosi IV boolusannuse korral (joonis 1). Byetta-ravi saanud II tüüpi diabeediga patsientidel suurenes märkimisväärselt nii esimese faasi kui ka teise faasi insuliini sekretsioon võrreldes soolalahusega (p
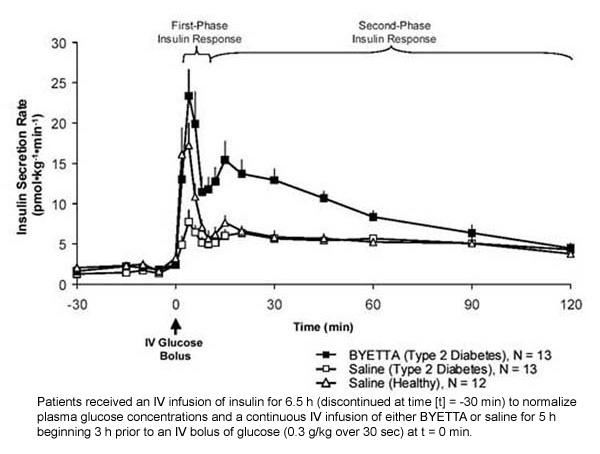
Joonis 1: Keskmine (+ SEM) insuliini sekretsiooni kiirus Byetta või soolalahuse infusiooni ajal II tüüpi diabeediga patsientidel ja füsioloogilise lahuse infusiooni ajal tervetel isikutel
Glükagooni sekretsioon: II tüüpi diabeediga patsientidel aeglustab Byetta glükagooni sekretsiooni ja vähendab hüperglükeemia perioodidel seerumi glükagooni kontsentratsiooni. Madalam glükagooni kontsentratsioon vähendab maksa glükoosiväljundit ja vähendab insuliinivajadust. Kuid Byetta ei kahjusta normaalset glükagooni vastust hüpoglükeemiale.
Mao tühjendamine: Byetta aeglustab mao tühjenemist, vähendades seeläbi toidust saadava glükoosi ringluses ilmumise kiirust.
Toidu tarbimine: On näidatud, et eksenatiidi manustamine vähendab nii loomadel kui ka inimestel toidu tarbimist.
Farmakokineetika
Imendumine
Pärast SC manustamist II tüüpi diabeediga patsientidele saavutab eksenatiidi keskmine plasmakontsentratsioon 2,1 tunniga. Keskmine eksenatiidi maksimaalne kontsentratsioon (Cmax) pärast Byetta 10 mcg annuse manustamist SC-le oli 211 pg / ml ja keskmine kõvera alune pindala (AUC0-inf) oli 1036 pg-h / ml. Eksenatiidi ekspositsioon (AUC) suurenes proportsionaalselt terapeutiliste annuste vahemikus 5 kuni 10 mikrogrammi. Cmax väärtused suurenesid vähem kui proportsionaalselt samas vahemikus. Sarnane kokkupuude saavutatakse Byetta SC manustamisega kõhu-, reie- või käsivarresse.
Jaotus
Eksenatiidi keskmine näiv jaotusruumala pärast Byetta ühekordse annuse manustamist SC-le on 28,3 L.
Ainevahetus ja eliminatsioon
Mittekliinilised uuringud on näidanud, et eksenatiid elimineeritakse peamiselt glomerulaarfiltratsiooni teel koos sellele järgneva proteolüütilise lagunemisega. Eksenatiidi keskmine näiv kliirens inimestel on 9,1 L / h ja keskmine terminaalne poolväärtusaeg on 2,4 tundi. Need eksenatiidi farmakokineetilised omadused ei sõltu annusest. Enamikul inimestel on eksenatiidi kontsentratsioonid mõõdetavad umbes 10 tunni jooksul pärast manustamist.
Eripopulatsioonid
Neerupuudulikkus
Kerge kuni mõõduka neerukahjustusega (kreatiniini kliirens 30–80 ml / min) patsientidel vähenes eksenatiidi kliirens ainult kergelt; seetõttu ei ole kerge kuni mõõduka neerukahjustusega patsientidel Byetta annuse kohandamine vajalik. Dialüüsi saavate lõppstaadiumis neeruhaigusega patsientide puhul langeb keskmine eksenatiidi kliirens aga 0,9 l / h, tervetel isikutel 9,1 l / h (vt. ETTEVAATUSABINÕUD, Kindral).
Maksapuudulikkus
Ägeda või kroonilise maksapuudulikkuse diagnoosiga patsientidel ei ole farmakokineetilisi uuringuid läbi viidud. Kuna eksenatiid eritub peamiselt neerude kaudu, ei tohiks maksafunktsiooni häired eeldada eksenatiidi kontsentratsiooni veres (vt Farmakokineetika, Ainevahetus ja eliminatsioon).
Geriaatriline
Patsientide (vahemikus 22 kuni 73 aastat) populatsiooni farmakokineetiline analüüs näitab, et vanus ei mõjuta eksenatiidi farmakokineetilisi omadusi.
Pediaatriline
Exenatiidi ei ole lastel uuritud.
Sugu
Mees- ja naispatsientide populatsiooni farmakokineetiline analüüs näitab, et sugu ei mõjuta eksenatiidi jaotumist ega elimineerimist.
Rass
Patsientide, sealhulgas kaukaasia, hispaanlase ja mustanahaliste populatsiooni farmakokineetiline analüüs näitab, et rassil ei ole olulist mõju eksenatiidi farmakokineetikale.
Rasvumine
Rasvunud (KMI kg kg kg 30 kg / m2) ja mitterasvunud patsientide populatsiooni farmakokineetiline analüüs näitab, et rasvumine ei oma märkimisväärset mõju eksenatiidi farmakokineetikale.
Ravimite koostoimed
Digoksiin
Byetta korduvate annuste (10 mikrogrammi kaks korda päevas) samaaegne manustamine vähendas C tasetmax suu kaudu manustatud digoksiini (0,25 mg QD) 17% ja viivitas Tmax umbes 2,5 tunni võrra; üldine püsiseisundi farmakokineetiline ekspositsioon (AUC) ei muutunud.
Lovastatiin
Lovastatiini AUC ja Cmax vähenesid vastavalt vastavalt 40% ja 28% ning Tmax hilines umbes 4 tundi, kui Byetta (10 mikrogrammi kaks korda päevas) manustati samaaegselt lovastatiini ühekordse annusega (40 mg), võrreldes manustatud lovastatiiniga üksi. Byetta 30-nädalases kontrollitud kliinilises uuringus oli Byetta kasutamine patsientidel, kes juba saavad HMG-d CoA reduktaasi inhibiitoreid ei seostatud lipiidiprofiilide pidevate muutustega võrreldes algtase.
Lisinopriil
Lisinopriilil (5... 20 mg / päevas) stabiliseerunud kerge kuni mõõduka hüpertensiooniga patsientidel ei muutnud Byetta (10 mikrogrammi kaks korda päevas) lisinopriili püsiseisundi Cmax ega AUC. Lisinopriili püsiseisundis Tmax hilines 2 h. 24-tunnises keskmises süstoolses ja diastoolses vererõhus muutusi ei olnud.
Atsetaminofeen
Kui pärast Byetta süstimist manustati 1000 mg atsetaminofeeni eliksiiri koos 10 mcg Byetta (0 h) ja 1 h, 2 h ja 4 h, vähenes atsetaminofeeni AUC vastavalt 21%, 23%, 24% ja 14%; Cmax vähenes vastavalt 37%, 56%, 54% ja 41%; Tmax tõsteti kontrollperioodi 0,6 tunnilt vastavalt 0,9 tunnile, 4,2 tunnile, 3,3 tunnile ja 1,6 tunnile. Atsetaminofeeni AUC, Cmax ja Tmax ei muutunud oluliselt, kui atsetaminofeeni manustati 1 tund enne Byetta süstimist.
Varfariin
Byetta korduvate annuste (5 mg kaks korda päevas 1–2 päeva ja 10 µg kaks korda päevas 3–9 päeva) samaaegne manustamine tervetele vabatahtlikele, varfariini (25 mg) Tmax hilineb umbes 2 tunni võrra. Varfariini S- ja R-enantiomeeride kliiniliselt olulist mõju Cmax ega AUC ei täheldatud. Byetta ei muutnud varfariini farmakodünaamilisi omadusi (vastavalt INR-vastusele).
Farmakodünaamika
Postprandiaalne glükoos
II tüüpi diabeediga patsientidel vähendab Byetta söögijärgset vere glükoosikontsentratsiooni (joonis 2).
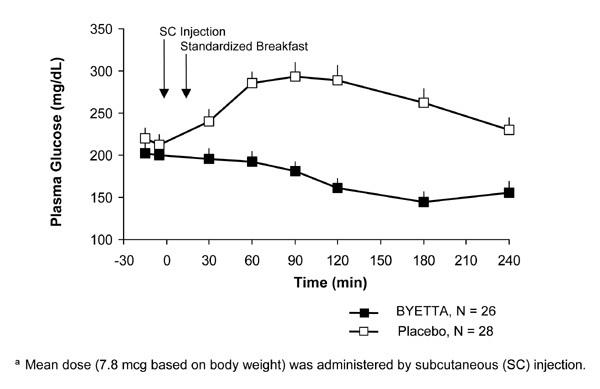
Joonis 2: Keskmine (+ SEM) söögijärgne plasma glükoosikontsentratsioon Byetta 1. päevala Ravi II tüüpi diabeediga patsientidel, keda ravitakse metformiiniga, sulfonüüluureaga või mõlemaga (N = 54)
Tühja kõhuga glükoos
Ühes annuses tehtud ristandusuuringus II tüüpi diabeedi ja tühja kõhuga hüperglükeemiaga patsientidel järgnes Byetta süstimisele insuliini viivitamatu vabanemine. Võrreldes platseeboga vähenes Byetta kasutamisel vere glükoosikontsentratsioon märkimisväärselt (joonis 3).
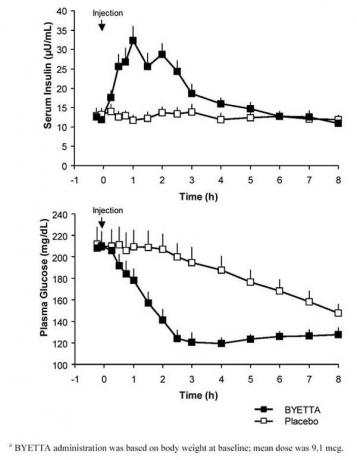
Joonis 3: Seerumi insuliini ja plasma glükoosisisalduse keskmised (+ SEM) kontsentratsioonid pärast Byetta ühekordset süstimista või platseebo 2. tüüpi diabeediga patsientide tühja kõhuga patsientidel (N = 12)
ülaosa
Kliinilised uuringud
Kasutamine koos metformiini ja / või sulfonüüluureaga
Byetta ohutuse ja efektiivsuse hindamiseks tüüp-tüüpi patsientidel viidi läbi kolm 30-nädalast topeltpimedat, platseebokontrollitud uuringut. 2 diabeet, mille glükeemiline kontroll ei olnud piisav ainult metformiini, ainult sulfonüüluurea või metformiini kasutamisel koos sulfonüüluurea.
Nendes kolmes uuringus randomiseeriti kokku 1446 patsienti: 991 (68,5%) olid kaukaasialased, 224 (15,5%) olid hispaanlased ja 174 (12,0%) olid mustanahalised. Uuringute alguses olid HbA1c keskmised väärtused vahemikus 8,2% kuni 8,7%. Pärast neljanädalast platseebo sissejuhatavat perioodi määrati patsiendid juhuslikult määrama Byetta 5 mikrogrammi kaks korda päevas, Byetta 10 mikrogramm kaks korda päevas või platseebo kaks korda päevas enne hommikust ja õhtust sööki lisaks olemasolevale suukaudsele diabeediravimile agent. Kõik patsiendid, kellele määrati Byetta, algasid ravi alustamise perioodiga 5 mikrogrammi kaks korda päevas 4 nädala jooksul. 4 nädala möödudes said need patsiendid jätkuvalt Byetta 5 mikrogrammi kaks korda päevas või suurendati nende annust 10 mikrogrammini kaks korda päevas. Platseeboga määratud patsiendid said kogu uuringu jooksul platseebot kaks korda päevas.
Igas uuringus oli esmaseks tulemusnäitajaks HbA keskmist muutust1c 30 nädala pärast. Kolmekümnenädalase uuringu tulemused on kokku võetud tabelis 1.
Tabel 1: Byetta 30-nädalaste platseebokontrolliga uuringute tulemused patsientidel, kelle glükoosisisaldus on ebapiisav, hoolimata metformiini, sulfonüüluurea või mõlema kasutamisest
| Platseebo BID |
Byetta 5 mikrogrammi kaks korda päevas |
Byetta 10 mikrogrammi* BID |
|
|---|---|---|---|
| |||
| Kombinatsioonis metformiiniga | |||
| Ravitav rahvastik (N) | 113 | 110 | 113 |
| HbA1c (%), Keskmine | |||
| Baasjoon | 8.2 | 8.3 | 8.2 |
| Muutus 30. nädalal | +0.1 | −0.4†| −0.8c |
| Proportsioon HbA saavutamisel1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Kehakaal (kg), keskmine | |||
| Baasjoon | 99.9 | 100.0 | 100.9 |
| Muutus 30. nädalal | −0.3 | −1.6†| −2.8c |
| Kombinatsioonis sulfonüüluureaga | |||
| Ravitav rahvastik (N) | 123 | 125 | 129 |
| HbA1c (%), Keskmine | |||
| Baasjoon | 8.7 | 8.5 | 8.6 |
| Muutus 30. nädalal | +0.1 | −0.5†| −0.9c |
| Proportsioon HbA saavutamisel1c≤7% § | 8.8% | 32.6%†| 41.3%c |
| Kehakaal (kg), keskmine | |||
| Baasjoon | 99.1 | 94.9 | 95.2 |
| Muutus 30. nädalal | −0.6 | −0.9 | −1.6†|
| Kombinatsioonis metformiini ja sulfonüüluureaga | |||
| Ravitav rahvastik (N) | 247 | 245 | 241 |
| HbA1c (%), Keskmine | |||
| Baasjoon | 8.5 | 8.5 | 8.5 |
| Muutus 30. nädalal | +0.2 | −0.6c | −0.8c |
| Proportsioon HbA saavutamisel1c≤7% § | 9.2% | 27.4%c | 33.5%c |
| Kehakaal (kg), keskmine | |||
| Baasjoon | 99.1 | 96.9 | 98.4 |
| Muutus 30. nädalal | −0.9 | −1.6†| −1.6†|
HbA1c
Byetta lisamine metformiini, sulfonüüluurea või mõlema raviskeemile põhjustas statistiliselt olulist HbA langust1c kolmel kontrollitud uuringul (võrreldes nende ravimitega platseebot saanud patsientidega) 30. nädalal (Tabel 1). Lisaks täheldati muutuste suhtes algväärtusest HbA statistiliselt olulist annusefekti 5-mcg ja 10-mcg Byetta rühmade vahel1c kolmes uuringus 30. nädalal.
Paastumine ja söögijärgne glükoos
Byetta pikaajaline kasutamine koos metformiini, sulfonüüluurea või mõlemaga vähendas nii tühja kõhuga kui ka postprandiaalsed plasma glükoosikontsentratsioonid nädala jooksul statistiliselt olulisel, annusest sõltuval viisil 30. Statistiliselt oluline vähenemine nii tühja kõhuga kui ka söögijärgse glükoosikontsentratsiooni osas võrreldes algtasemega täheldati 30. nädalal mõlemas Byetta rühmas, võrreldes platseeboga, kolmest kontrollitud patsiendist saadud andmetega kohtuprotsessid. Paastunud glükoosikontsentratsiooni muutus 30. nädalal võrreldes algtasemega oli Byetta 5 mikrogrammi kaks korda päevas 8 mg / dl ja Byetta 10 mikrogrammi kaks korda päevas 10 mg / dl, platseebo puhul +12 mg / dl. 2-tunnise söögijärgse glükoosikontsentratsiooni muutust pärast Byetta manustamist 30. nädalal võrreldi algtasemega oli ≥ 63 mg / dL 5 mcg kaks korda päevas ja 71 mg 71 mg / dL 10 mcg kaks korda päevas, võrreldes +11 mg / dL platseebo.
HbA saavutanud patsientide osakaal1c≤7%
Byetta koos metformiiniga, sulfonüüluureaga või mõlemaga andis suurema, statistiliselt olulise patsientide osakaal, kes saavutasid HbA1câ ‰ ¤ 7% 30. nädalal, võrreldes patsientidega, kes said platseebot kombinatsioonis need esindajad (Tabel 1).
Kehakaal
Kolmes kontrollitud uuringus seostati Byetta 10 mikrogrammi kaks korda päevas kaks korda vähem kui algtasemel kehakaal võrreldes platseebo kahekordse manustamisega II tüüpi diabeediga patsientidel (Tabel 1).
Üheaastased kliinilised tulemused
30-nädalastes platseebokontrollitud uuringutes osalenud 163 patsiendi kohordil, kes lõpetasid Byetta 10 mikrogrammi kaks korda päevas 52-nädalase ravi, HbA1c muutused algtasemest olid „1,0% ja“ 1,1% vastavalt 30 ja 52 ravinädalal koos sellega kaasnevate muutustega algtasemest tühja kõhu plasma glükoosisisalduses ‚14,0 mg / dL ja‚ 25,3 mg / dL ning kehakaalu muutustega ´2,6 kg ja ´3,6 kg. Selle kohordi põhiväärtused olid sarnased kogu kontrollitud uuringu populatsiooni omadega.
Kasutage koos tiasolidiindiooniga
Randomiseeritud, topeltpimedas, platseebokontrollitud 16-nädalases uuringus lisati olemasolevatele olemasolevatele Byetta (n = 121) või platseebo (n = 112) tiasolidiindioon (pioglitasoon või rosiglitasoon) ravi metformiiniga või ilma, II tüüpi diabeediga patsientidel glükeemiline kontroll. Randomiseerimine Byetta või platseeboga kihistati vastavalt sellele, kas patsiendid said metformiini. Platseeboga määratud patsiendid said kogu uuringu jooksul platseebot kaks korda päevas. Byetta või platseebot süstiti naha alla enne hommikust ja õhtust sööki. 74 protsenti patsientidest võttis tiasolidiindiooni ja metformiini ning 21% patsientidest ainult tiasolidiindiooni. Enamik patsiente (84%) olid kaukaasia päritolu, 8% hispaanlased ja 3% mustanahalised. HbA1c keskmised algväärtused olid Byetta ja platseebo puhul sarnased (7,9%). Ravi Byettaga alustati 4 nädala jooksul annusega 5 mikrogrammi kaks korda ööpäevas, seejärel suurendati seda veel 12 nädala jooksul 10 mikrogrammini kaks korda päevas.
Kuusteist nädalat kestnud uuringutulemused on kokku võetud tabelis 2. Platseeboga võrreldes põhjustas Byetta 16. nädalal statistiliselt olulist HbA1c langust võrreldes algtasemega. HbA1c raviefektid olid sarnased kahes alamrühmas, mis olid määratletud aluseks oleva ravikihi järgi (üksi tiasolidiindioonid versus tiasolidiindioonid pluss metformiin). Paastunud seerumi glükoosikontsentratsiooni muutus algtasemest 16. nädalani oli statistiliselt oluline võrreldes platseeboga (−21 mg / dl Byetta puhul 10 µg kaks korda päevas, +4 mg / dL platseebo puhul).
Tabel 2: Byetta 16-nädalase platseebo-kontrollitud uuringu tulemused ebapiisava glükoositasemega patsientidel, hoolimata tiasolidiindiooni (TZD) või tiasolidiindiooni ja metformiini kasutamisest
| Platseebo BID |
Byetta 10 mikrogrammi* BID |
|
|---|---|---|
| ||
| Kombinatsioonis TZD või TZD pluss MET | ||
| Ravitav rahvastik (N) | 112 | 121 |
| HbA1c (%), Keskmine | ||
| Baasjoon | 7.9 | 7.9 |
| Muutus 16. nädalal | +0.1 | −0.8†|
| Proportsioon HbA saavutamisel1c≤7%c | 16.2% | 62.3%†|
| Kehakaal (kg), keskmine | ||
| Baasjoon | 96.9 | 97.5 |
| Muutus 16. nädalal | −0.2 | −1.5†|
ülaosa
Näidustused ja kasutamine
Byetta on näidustatud täiendava ravina glükeemilise kontrolli parandamiseks II tüüpi suhkurtõvega patsientidel, kes võtavad metformiini, sulfonüüluurea, tiasolidiindioon, metformiini ja sulfonüüluurea kombinatsioon või metformiini ja tiasolidiindiooni kombinatsioon, kuid ei ole saavutanud piisavat glükeemilist kontroll.
ülaosa
Vastunäidustused
Byetta on vastunäidustatud patsientidele, kellel on ülitundlikkus eksenatiidi või ravimi mõne koostisosa suhtes.
ülaosa
Ettevaatusabinõud
Üldine
Byetta ei asenda insuliini vajavatel patsientidel insuliini. Byetta't ei tohi kasutada 1. tüüpi diabeediga patsientidel ega diabeetilise ketoatsidoosi raviks.
Patsientidel võivad pärast Byetta-ravi tekkida eksenatiidi vastased antikehad, mis on kooskõlas valkude ja peptiidide ravimite potentsiaalsete immunogeensete omadustega. Byetta-ravi saavaid patsiente tuleb jälgida ülitundlikkusreaktsioonide nähtude ja sümptomite suhtes.
Väikesel osal patsientidest võib kõrge tiitriga antikehade moodustumine põhjustada glükeemilise kontrolli piisava paranemise saavutamist. Kui glükeemiline kontroll halveneb või kui glükeemilise kontrolli sihipärast kontrolli ei saavutata, tuleks kaaluda alternatiivset diabeedivastast ravi.
Byetta samaaegset kasutamist insuliini, D-fenüülalaniini derivaatide, meglitiniidide või alfa-glükosidaasi inhibiitoritega ei ole uuritud.
Byetta't ei soovitata kasutada lõppstaadiumis neeruhaiguse või raske neerukahjustusega patsientidel (kreatiniini kliirens, farmakokineetika, eripopulatsioonid). Dialüüsi saavatel lõppstaadiumis neeruhaigusega patsientidel ei talunud Byetta 5 mikrogrammi ühekordsed annused seedetrakti kõrvaltoimete tõttu hästi.
Neerufunktsiooni muutusi, sealhulgas seerumi suurenemist, on esinenud harva, spontaanselt kreatiniin, neerukahjustus, halvenenud krooniline neerupuudulikkus ja äge neerupuudulikkus, mõnikord vajavad hemodialüüs. Mõned neist juhtudest esines patsientidel, kes said üht või mitut teadaolevalt neeru mõjutavat farmakoloogilist ainet funktsiooni / hüdratsiooni seisund ja / või iiveldust, oksendamist ja / või kõhulahtisust põdevatel patsientidel, kas koos või ilma dehüdratsioon. Samaaegsete ravimite hulka kuulusid angiotensiini konverteeriva ensüümi inhibiitorid, mittesteroidsed põletikuvastased ravimid ja diureetikumid. Neerufunktsiooni muutust on täheldatud toetava ravi ja potentsiaalselt põhjustavate ravimite, sealhulgas eksenatiidi, katkestamisel. Prekliinilistes või kliinilistes uuringutes ei ole eksenatiidi leitud olevat otseselt nefrotoksiline.
Byetta't ei ole uuritud raske seedetraktihaiguse, sealhulgas gastropareesiga patsientidel. Selle kasutamist seostatakse tavaliselt seedetrakti kahjulike mõjudega, sealhulgas iivelduse, oksendamise ja kõhulahtisusega. Seetõttu ei soovitata Byetta kasutamist raskete seedetraktihaigustega patsientidel. Byetta-ga ravitud patsiendil tuleks uurida tugeva kõhuvalu tekkimist, kuna see võib olla tõsise seisundi hoiatav märk.
Hüpoglükeemia
30-nädalases kontrollitud kliinilises uuringus Byettaga registreeriti hüpoglükeemia episood kõrvaltoimena, kui patsient teatas hüpoglükeemiaga seotud sümptomitest koos kaasneva veresuhkruga HALDUS).
Tabel 3: hüpoglükeemia esinemissagedus (%) samaaegse diabeediravi korral
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Platseebo BID |
5 mikrogrammi BID |
10 mikrogrammi BID |
Platseebo BID |
5 mikrogrammi BID |
10 mikrogrammi BID |
Platseebo BID |
5 mikrogrammi BID |
10 mikrogrammi BID |
|
| Metformiiniga | Sulfonüüluureaga | MET / SFU abil | |||||||
| Byetta ja platseebot manustati enne hommikust ja õhtust sööki. | |||||||||
| Lühendid: kaks korda päevas kaks korda päevas; MET / SFU, metformiin ja sulfonüüluurea. | |||||||||
| |||||||||
| N | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| Hüpoglükeemia | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Tiasolidiindiooni lisamisel koos metformiiniga või ilma, oli Byetta-ga sümptomaatilise kerge kuni mõõduka hüpoglükeemia esinemissagedus 11%, platseebo puhul 7%.
Byetta ei muutnud tervetel isikutel randomiseeritud, topeltpimedas, kontrollitud uuringus insuliini põhjustatud hüpoglükeemia vastureguleerivat hormooni vastust.
Teave patsientidele
Patsiente tuleb Byetta potentsiaalsetest ohtudest teavitada. Patsiente tuleb ka täielikult informeerida enesejuhtimise tavadest, sealhulgas Byetta õige süstimise olulisusest tehnika, Byetta ja samaaegselt manustatavate suukaudsete ravimite annustamise ajastus, toidukorra järgimine, regulaarne füüsiline aktiivsus, perioodiline vere glükoosisisalduse jälgimine ja HbA1c testimine, hüpoglükeemia ja hüperglükeemia tuvastamine ja haldamine ning suhkurtõve hindamine tüsistused.
Patsientidel tuleb soovitada arstiga informeerida, kui nad on rasedad või kavatsevad rasestuda.
Iga Byetta annus tuleb igal ajal süstida reie, kõhu või õlavarre süstena. 60 minutit enne hommikust ja õhtust sööki (või enne päeva kahte peamist söögikorda, umbes 6 tundi või rohkem) peale). Byetta't ei tohi manustada pärast sööki. Kui mõni annus jääb vahele, tuleb raviskeemi jätkata vastavalt ettenähtud annusele.
Hüpoglükeemia oht suureneb, kui Byetta kasutatakse koos hüpoglükeemiat esile kutsuva ainega, näiteks sulfonüüluureaga. Patsiendile tuleb selgitada hüpoglükeemia tekke sümptomeid, ravi ja seisundit. Ehkki patsiendi tavalisi hüpoglükeemia ravi juhiseid ei pea muutma, peaksid need juhendid olema vaadatakse läbi ja tugevdatakse Byetta-ravi alustamisel, eriti kui neid manustatakse samaaegselt sulfonüüluureaga (vt ETTEVAATUSABINÕUD, Hüpoglükeemia).
Patsiente tuleb hoiatada, et Byetta-ravi võib põhjustada söögiisu vähenemist tarbimist ja / või kehakaalu ning selle tõttu ei ole vaja annustamisrežiimi muuta efektid. Byetta-ravi võib põhjustada ka iiveldust, eriti ravi alustamisel (vt KÕRVALTOIMED).
Enne Byetta-ravi alustamist peab patsient lugema infolehte "Patsiendi teave" ja pensüsteli kasutusjuhendit ning lugema need üle iga kord, kui retsepti täidetakse. Patsienti tuleb juhendada pensüsteli õige kasutamise ja hoidmise osas, rõhutades, kuidas ja millal uut ampullsüstalt üles seada, ning märkides, et esmasel kasutamisel on vajalik ainult üks seadistamise samm. Patsiendile tuleb soovitada pensüstelit ja nõelu mitte jagada.
Patsiente tuleb teavitada sellest, et pensüsteli nõelad ei kuulu pensüsteli juurde ja neid tuleb eraldi osta. Patsientidele tuleb selgitada, millist nõela pikkust ja mõõtmeid tuleks kasutada.
Ravimite koostoimed
Byetta mõju mao aeglasele tühjenemisele võib vähendada suukaudselt manustatavate ravimite imendumise ulatust ja kiirust. Byetta't tuleb ettevaatusega kasutada patsientidel, kes saavad suukaudseid ravimeid, mis vajavad kiiret imendumist seedetraktist. Suukaudsete ravimite puhul, mis sõltuvad efektiivsuse lävikontsentratsioonist, näiteks rasestumisvastaseid vahendeid ja antibiootikume, tuleb patsientidel soovitada neid ravimeid võtta vähemalt 1 tund enne kasutamist Byetta süst. Kui selliseid ravimeid tuleb manustada koos toiduga, tuleb patsientidel soovitada võtta neid koos toiduga või suupistetega, kui Byetta't ei manustata. Byetta mõju suukaudsete kontratseptiivide imendumisele ja efektiivsusele pole iseloomustatud.
Varfariin
Tervete vabatahtlikega läbi viidud kontrollitud kliinilises farmakoloogilises uuringus täheldati varfariini Tmax viivitust umbes 2 tundi, kui varfariini manustati 30 minutit pärast Byetta. Kliiniliselt olulist mõju Cmax ega AUC ei täheldatud. Pärast turule toomist on spontaanselt teatatud INR-i suurenemise juhtudest (Rahvusvaheline normaliseeritud suhe) varfariini ja Byetta samaaegsel kasutamisel, mis on mõnikord seotud verejooks.
Kantserogenees, mutagenees, viljakuse langus
104-nädalase kartsinogeensuse uuring viidi läbi isastel ja emastel rottidel annustes 18, 70 või 250 mcg / kg päevas, manustatuna boolussüstina. Kilpnäärme healoomulisi adenoome täheldati emastel rottidel kõigil eksenatiidi annustel. Emaste rottide esinemissagedused olid kahes kontrollrühmas 8% ja 5% ning süsteemse ekspositsiooniga madala, keskmise ja kõrge annusega rühmas 14%, 11% ja 23% Inimese kokkupuude vastavalt 5, 22 ja 130-kordsele maksimaalsele soovitatavale annusele 20 mcg päevas, lähtudes kõvera alusest plasmapinnast (AUC).
104-nädalases kartsinogeensuse uuringus hiirtel annustega 18, 70 või 250 mikrogrammi / kg päevas, manustatuna boolus SC-ga, ei täheldatud kasvajate tunnuseid annustes kuni 250 mcg / kg / päevas, süsteemne kokkupuude kuni 95-kordne inimesega kokkupuutel, mis tuleneb maksimaalsest soovitatavast annusest 20 mcg päevas, mis põhineb AUC.
Hiina hamstri munasarjarakkude Ames'i bakteriaalse mutageensuse või kromosoomaberratsiooni testis ei olnud eksenatiid mutageenne ega klastogeenne, metaboolse aktiveerimisega või ilma. Exenatiid oli hiire in vivo mikrotuuma testis negatiivne.
Hiirte viljakuse uuringutes SC annustega 6, 68 või 760 mikrogrammi / kg päevas raviti mehi 4 nädalat enne paaritumise ajal ja ajal ning emasloomi töödeldi 2 nädalat enne paaritumist ja kogu selle vältel kuni tiinuspäevani 7. Kõrvaltoimeid viljakusele ei täheldatud annuses 760 mcg / kg päevas, süsteemne ekspositsioon on 390-kordne inimese ekspositsioonist, mis tuleneb maksimaalsest soovitatavast annusest 20 mcg päevas AUC põhjal.
Rasedus
C-kategooria rasedus
On näidatud, et eksenatiid põhjustab hiirtel loote ja vastsündinute kasvu ja luustiku vähenenud toimet süsteemne kokkupuude 3-kordse inimesega kokkupuutega, mis tuleneb maksimaalsest soovitatavast annusest 20 mikrogrammi päevas, põhineb AUC-l. On näidatud, et eksenatiid põhjustab küülikutel skeleti toimet süsteemse ekspositsiooni korral, mis on 12 korda suurem inimese ekspositsioonist, mis tuleneb maksimaalsest soovitatavast annusest 20 mikrogrammi päevas AUC põhjal. Rasedatel ei ole piisavalt ja hästi kontrollitud uuringuid. Byetta't tuleb raseduse ajal kasutada ainult siis, kui potentsiaalne kasu õigustab potentsiaalset ohtu lootele.
Emastel hiirtel, kellele manustati SC annuseid 6, 68 või 760 mikrogrammi / kg päevas, alustades 2 nädalat enne paaritamist ja kogu selle ajal kuni 7. tiinuspäevani, loote kahjulikku toimet ei ilmnenud. toimed annustes kuni 760 mcg / kg / päevas, süsteemne ekspositsioon kuni 390-kordne inimese kokkupuude, mis tuleneb maksimaalsest soovitatavast annusest 20 mcg päevas, põhinedes AUC.
Tiinetel hiirtel, kellele manustati SC annuseid 6, 68, 460 või 760 mikrogrammi / kg päevas raseduspäevast 6-15 (organogenees), suulaelõhe (mõnel augud) ja ebakorrapärase luustikuga ribide ja kolju luude luustumist täheldati annuses 6 mcg / kg päevas, süsteemne ekspositsioon inimesest 3 korda suurem, kui maksimaalne soovitatav annus oli 20 mcg / kg päevas, põhineb AUC-l.
Tiinetel küülikutel, kellele manustati SC annuseid 0,2, 2, 22, 156 või 260 mikrogrammi / kg päevas alates 6. kuni 18. raseduspäevast (organogenees), ebakorrapärane luustik luustumist täheldati annuses 2 mcg / kg päevas, süsteemne ekspositsioon 12-kordne inimese kokkupuutel maksimaalse soovitatava annuse 20 mcg päevas, põhineb AUC-l.
Tiinetel hiirtel, kellele manustati SC annuseid 6, 68 või 760 mikrogrammi / kg päevas raseduspäevast 6 kuni laktatsioonipäevani 20 (võõrutamine), täheldati vastsündinute surmajuhtumite arvu suurenemist sünnitusjärgsetel päevadel 2–4 emadel, kellele manustati 6 mikrogrammi kg kohta päevas, süsteemne ekspositsioon inimesest 3-kordselt, mis tuleneb AUC põhjal maksimaalsest soovitatavast annusest 20 mikrogrammi päevas.
Imetavad emad
Ei ole teada, kas eksenatiid eritub inimese rinnapiima. Paljud ravimid erituvad inimese rinnapiima ja kuna eksenatiid võib põhjustada rinnaga toitvatel imikutel kliiniliselt olulisi kõrvaltoimeid, on otsus tuleks otsustada, kas lõpetada tarbimispiima tootmine või lõpetada ravim, võttes arvesse selle tähtsust imetavale lapsele naine. Imetavatel hiirtel tehtud uuringud on näidanud, et eksenatiidi kontsentratsioon piimas on väike (kuni 2,5% või väiksem kui emaka plasma kontsentratsioon pärast nahaalust manustamist). Byetta manustamisel imetavale naisele tuleb olla ettevaatlik.
Kasutamine lastel
Byetta ohutust ja efektiivsust lastel ei ole kindlaks tehtud.
Geriaatriline kasutamine
Byetta't uuriti 282-l 65-aastasel või vanemal patsiendil ja 16-l 75-aastasel või vanemal patsiendil. Nende patsientide ja nooremate patsientide vahel ei täheldatud erinevusi ohutuses ega efektiivsuses.
ülaosa
Kõrvaltoimed
Kasutamine koos metformiini ja / või sulfonüüluureaga
Kolmes 30-nädalases kontrollitud Byetta uuringus metformiini ja / või sulfonüüluurea lisamisega olid kõrvaltoimed esinemissagedusega ‰ â ‰ (välja arvatud hüpoglükeemia; vaata Tabel 3), mida esines Byetta-ravi saanud patsientidel sagedamini kui platseebot saanud patsientidel, on kokku võetud tabelis 4.
Tabel 4: Sagedased raviga kaasnevad kõrvaltoimed (esinemissagedus â ‰% ja suurem esinemissagedus Byetta-ravi korral), välja arvatud hüpoglükeemia *
| Platseebo BID N = 483 % |
Kõik Byetta BID N = 963 % |
|
|---|---|---|
| ||
| Iiveldus | 18 | 44 |
| Oksendamine | 4 | 13 |
| Kõhulahtisus | 6 | 13 |
| Ere tunne | 4 | 9 |
| Peapööritus | 6 | 9 |
| Peavalu | 6 | 9 |
| Düspepsia | 3 | 6 |
Byettaga seotud kõrvaltoimed olid tavaliselt kerge kuni mõõduka intensiivsusega. Kõige sagedamini teatatud kõrvaltoime, kerge kuni mõõdukas iiveldus, esines annusest sõltuval viisil. Ravi jätkamisel vähenes aja jooksul enamuse iiveldust põdevate patsientide sagedus ja raskusaste. Kõrvaltoimed, mida on täheldatud vahemikus 1,0– <5,0% Byetta-ravi saanud patsientidest, ja neid esines sagedamini kui platseeboga sealhulgas asteenia (enamasti teatatud nõrkusest), söögiisu vähenemine, gastroösofageaalne reflukshaigus ja hüperhidroos. Pikendusuuringutes 52. nädalal osalenud patsientidel esines 30-nädalases kontrollitud uuringus sarnaseid kõrvaltoimeid.
Kõrvaltoimete tõttu ärajätmise esinemissagedus oli Byetta-ravi saanud patsientidel 7% ja platseebot saanud patsientidel 3%. Byetta-ravi saanud patsientide levinumad kõrvalnähud olid iiveldus (3% patsientidest) ja oksendamine (1%). Platseeboga ravitud patsientidest katkestas iivelduse tõttu <1% ja oksendamise tõttu 0%.
Kasutage koos tiasolidiindiooniga
Byetta 16-nädalases platseebokontrollitud uuringus tiasolidiindiooni lisamisega metformiiniga või ilma, metformiiniga või ilma, esines muud täheldatud kõrvaltoimed olid sarnased metformiini ja / või a 30-nädalases kontrollitud kliinilises uuringus täheldatuga sulfonüüluurea. Platseebo rühmas ei ole tõsiseid kõrvaltoimeid teatatud. Byetta-rühmas teatati kahest tõsisest kahjulikust juhtumist, nimelt valu rinnus (põhjustades ärajätmist) ja kroonilisest ülitundlikkuspneumoniidist.
Kõrvaltoimete tõttu ärajätmise esinemissagedus oli Byetta-ravi saanud patsientidel 16% (19/121) ja platseebot saanud patsientidel 2% (2/112). Byetta-ravi saanud patsientide kõige levinumad kõrvalnähud olid iiveldus (9%) ja oksendamine (5%). Platseeboga ravitud patsientidest loobus iivelduse tõttu <1%. Külmavärinad (n = 4) ja süstekoha reaktsioonid (n = 2) esinesid ainult Byetta-ravi saanud patsientidel. Kahel patsiendil, kes teatasid süstekoha reaktsioonist, oli kõrge eksenatiidi antikehade tiiter.
Spontaansed andmed
Pärast Byetta turuletoomist on teatatud järgmistest täiendavatest kõrvaltoimetest. Kuna nendest juhtudest teatatakse vabatahtlikult ebakindla suurusega elanikkonnast, ei ole alati võimalik usaldusväärselt hinnata nende esinemissagedust ega tuvastada põhjuslikku seost narkomaaniaga.
Üldine: süstekoha reaktsioonid; düsgeusia; unisus, INR suurenes samaaegse varfariini kasutamise korral (mõned teated on seotud verejooksuga).
Allergia / ülitundlikkus: üldine kihelus ja / või urtikaaria, maakula- või papulaarne lööve, angioödeem; harvaesinevad anafülaktilised reaktsioonid.
Seedetrakt: iiveldus, oksendamine ja / või kõhulahtisus, mis põhjustab dehüdratsiooni; kõhu laienemine, kõhuvalu, eruktsioon, kõhukinnisus, kõhupuhitus, äge pankreatiit.
Neerude ja kuseteede häired: muutunud neerufunktsioon, sealhulgas äge neerupuudulikkus, halvenenud krooniline neerupuudulikkus, neerukahjustus, suurenenud seerumi kreatiniini sisaldus (vt ETTEVAATUSABINÕUD).
Immunogeensus
Kooskõlas valkude ja peptiidide farmatseutiliste ravimite potentsiaalsete immunogeensete omadustega võivad patsiendid pärast ravi Byettaga välja töötada eksenatiidi vastaseid antikehi. Enamikul patsientidest, kellel tekivad antikehad, antikehade tiitrid aja jooksul vähenevad.
30-nädalasetes kontrollitud uuringutes Byetta metformiini ja / või sulfonüüluurea lisamisega olid 38% -l patsientidest 30. nädalal madala tiitriga anti-eksenatiidi antikehad. Selle rühma puhul oli glükeemilise kontrolli tase (HbA1c) üldiselt võrreldav tasemega, mida täheldati antikehade tiitriteta patsientidel. Veel 6% patsientidest olid kõrgemad tiitri antikehad 30. nädalal. Ligikaudu pooled sellest 6% -st (3% kõigist patsientidest, kellele manustati Byetta 30-nädalases kontrollitud uuringus) oli nõrgem Byetta glükeemiline vastus; ülejäänud osadel oli glükeemiline vastus võrreldav antikehadeta patsientidega.
Byetta 16-nädalases uuringus tiasolidiindioonide lisamisega metformiiniga või ilma, 9% -l patsientidest olid kõrgemad tiitri antikehad 16. nädalal. Võrreldes patsientidega, kellel ei tekkinud Byetta vastu antikehi, oli kõrgema tiitriga antikehadega patsientide glükeemiline vastus keskmiselt nõrgenenud.
Jälgida tuleb patsiendi glükeemilist reaktsiooni Byetta suhtes. Kui glükeemiline kontroll halveneb või kui glükeemilise kontrolli sihipärast kontrolli ei saavutata, tuleks kaaluda alternatiivset diabeedivastast ravi.
ülaosa
Üleannustamine
Byetta kliinilises uuringus esines kolmel II tüüpi diabeediga patsiendil ühel korral 100 mikrogrammi SC üledoos (10 korda suurem maksimaalsest soovitatavast annusest). Üleannustamise tagajärgede hulka kuulus tugev iiveldus, tugev oksendamine ja kiiresti langev veresuhkru kontsentratsioon. Ühel kolmest patsiendist esines rasket hüpoglükeemiat, mis vajas parenteraalset glükoosi manustamist. Kolm patsienti paranesid komplikatsioonideta. Üleannustamise korral tuleb vastavalt patsiendi kliinilistele tunnustele ja sümptomitele alustada sobivat toetavat ravi.
ülaosa
Annustamine ja manustamine
Byetta-ravi tuleb alustada annusega 5 mikrogrammi annuse kohta, mida manustatakse kaks korda päevas igal ajal 60 minuti jooksul periood enne hommikust ja õhtust sööki (või enne päeva kahte peamist söögikorda, umbes 6 tundi või rohkem) peale). Byetta't ei tohi manustada pärast sööki. Kliinilise ravivastuse põhjal võib Byetta annust pärast 1-kuulist ravi suurendada kuni 10 mikrogrammini kaks korda päevas. Iga annus tuleb manustada subkutaanselt süstena reide, kõhtu või õlavarre.
Byetta't soovitatakse kasutada II tüüpi suhkurtõvega patsientidel, kes saavad juba metformiini, sulfonüüluurea, tiasolidiindioon, metformiini ja sulfonüüluurea kombinatsioon või metformiini ja tiasolidiindiooni kombinatsioon ning neil on optimaalne glükeemiline kontroll. Kui Byetta lisatakse metformiini või tiasolidiindioonravi, võib metformiini või tiasolidiindiooni praegust annust jätkata kuna Byetta kasutamisel on ebatõenäoline, et metformiini või tiasolidiindiooni annus vajab hüpoglükeemia tõttu kohandamist. Byetta lisamisel sulfonüüluurearavile võib hüpoglükeemia riski vähendamiseks kaaluda sulfonüüluurea annuse vähendamist (vt ETTEVAATUSABINÕUD, Hüpoglükeemia).
Byetta on selge ja värvitu vedelik ning seda ei tohiks kasutada, kui ilmnevad osakesed või kui lahus on hägune või värviline. Byetta't ei tohi kasutada kõlblikkusaja möödumisel. Byetta intravenoosse või intramuskulaarse süstimise ohutuse või efektiivsuse kohta andmed puuduvad.
ülaosa
Ladustamine
Enne esmakordset kasutamist tuleb Byetta'i hoida külmkapis temperatuuril 36 ° C kuni 46 ° F (2 ° C kuni 8 ° C). Pärast esimest kasutamist saab Byetta hoida temperatuuril, mis ei ületa 25 ° C (77 ° F). Mitte külmuda. Ärge kasutage Byetta't, kui see on külmunud. Byetta tuleb kaitsta valguse eest. 30 päeva pärast esmakordset kasutamist tuleb pensüstel ära visata, isegi kui pensüstlisse jääb mõni ravim.
ülaosa
Kuidas komplekteeritakse?
Byetta tarnitakse subkutaanseks süstimiseks mõeldud steriilse lahusena, mis sisaldab 250 mcg / ml eksenatiidi. Saadaval on järgmised paketid:
5 mcg annuse kohta, 60 annust, 1,2 ml eeltäidetud pensüstel NDC 66780-210-07
10 ug annuse kohta, 60 annust, 2,4 ml eeltäidetud pensüstel NDC 66780-210-08
RX AINULT
Toodetud ettevõttele Amylin Pharmaceuticals, Inc., San Diego, CA 92121
Turustas Amylin Pharmaceuticals, Inc. ja Eli Lilly ja ettevõte
1-800-868-1190
http://www.Byetta.com
Byetta on ettevõtte Amylin Pharmaceuticals, Inc. registreeritud kaubamärk.
© 2007 Amylin Pharmaceuticals, Inc. Kõik õigused kaitstud.
viimati värskendatud 09/2007
Byetta (Exenatide) teave patsiendi kohta (lihtsas inglise keeles)
Üksikasjalik teave diabeedi märkide, sümptomite, põhjuste, ravi kohta
Selles monograafias sisalduv teave ei ole mõeldud hõlmama kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet või kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi: Sirvige kõiki diabeediravimeid



