Apidra diabeedi raviks
Kaubamärk: Apidra
Üldnimi: Insuliinglulisiin
Apidra (glulisiininsuliin) on inimese valmistatud toode, mis on peaaegu identne humaaninsuliiniga. Seda kasutatakse suhkruhaiguse raviks. Kasutamine, annustamine, kõrvaltoimed.
Sisu:
Näidustused ja kasutamine
Annustamine ja manustamine
Vastunäidustused
Hoiatused ja ettevaatusabinõud
Kõrvaltoimed
Ravimite koostoimed
Kasutamine konkreetsetes populatsioonides
Üleannustamine
Kirjeldus
Kliiniline farmakoloogia
Mittekliiniline toksikoloogia
Kliinilised uuringud
Kuidas komplektis
Apidra, glusiiniinsuliin, teave patsiendi kohta (lihtsas inglise keeles)
Näidustused
Apidra on kiire toimega humaaninsuliini analoog, mis on ette nähtud suhkruhaigusega täiskasvanute ja laste glükeemilise kontrolli parandamiseks.
ülaosa
Annustamine ja manustamine
Annustamiskaalutlused
APIDRA on rekombinantne insuliini analoog, mis on ekvivalentne humaaninsuliiniga (st APIDRA ühel ühikul on sama glükoosisisaldust langetav toime kui ühel ühikul tavalist humaaninsuliini), kui seda manustatakse intravenoosselt. Subkutaansel manustamisel on APIDRA toime kiirem ja toime kestus lühem kui tavalisel humaaninsuliinil.
APIDRA annus peab olema individuaalne. Kõigil insuliinravi saavatel patsientidel on oluline jälgida veresuhkru taset.
Kogu päevane insuliinivajadus võib varieeruda ja jääb tavaliselt vahemikku 0,5–1 ühikut / kg / päevas. Insuliinivajadused võivad muutuda stressi, raskete haiguste korral või muutustega treeningutes, söömisharjumustes või koosmanustatavate ravimite kasutamisel.
Subkutaanne manustamine
APIDRA tuleb manustada 15 minuti jooksul enne sööki või 20 minuti jooksul pärast söögi alustamist.
Subkutaanse süstena manustatud APIDRAt tuleks üldiselt kasutada režiimides koos keskmise või pika toimeajaga insuliiniga.
APIDRA tuleb manustada subkutaanselt kõhupiirkonda, reide või õlavarre. Lipodüstroofia riski vähendamiseks tuleb süstekohti samas piirkonnas (kõhu, reie või õlavarre piirkonnas) pöörata ühest süstist teise. KÕRVALTOIMED].
Pidev nahaalune infusioon (insuliinipump)
APIDRAt võib manustada pideva subkutaanse infusioonina kõhupiirkonda. Ärge kasutage lahjendatud või segatud insuliini välistes insuliinipumpades. Lipodüstroofia riski vähendamiseks tuleks infusioonikohti pöörata samas piirkonnas KÕRVALTOIMED]. Välise insuliini infusioonipumba algne programmeerimine peaks põhinema eelmise raviskeemi päevasel insuliini koguannusel.
APIDRA tootja Sanofi-aventis, APIDRA tootja läbi viidud kliinilistes uuringutes on kasutatud järgmisi insuliinipumpasid:
- Disetronic® H-Tron® pluss V100 ja D-Tron® koos Disetronic kateetritega (Rapid ™, Rapid C ™, Rapid D ™ ja Tender ™)
- MiniMed® mudelid 506, 507, 507c ja 508 koos MiniMed kateetritega (Sof-set Ultimate QR ™ ja Quick-set ™).
Enne APIDRA-ga erineva insuliinipumba kasutamist lugege pumba etiketti ja veenduge, et seda on APIDRA-ga hinnatud.
Arstid ja patsiendid peaksid hoolikalt hindama APIDRA väljakirjutamise, patsiendi infolehe ja pumba tootja käsiraamatus sisalduvat teavet pumba kasutamise kohta. Kasutusaja, infusioonikomplektide vahetamise sageduse või muu osas tuleb järgida APIDRA-spetsiifilist teavet APIDRA kasutamise konkreetsed üksikasjad, kuna APIDRA spetsiifiline teave võib erineda pumba üldkäsiraamatust juhiseid.
In vitro uuringute põhjal, mis on näidanud säilitusainete, metakresooli ja insuliini lagunemist, tuleb APIDRAt reservuaaris muuta vähemalt iga 48 tunni järel. Kliinilises kasutuses olev APIDRA ei tohiks olla temperatuuril üle 37 ° C (98,6 ° F). [Vaata HOIATUSED JA ETTEVAATUSABINÕUD ja KUIDAS TARNIVAD / Ladustamine ja käitlemine].
Intravenoosne manustamine
APIDRAt võib manustada intravenoosselt meditsiinilise järelevalve all glükeemilise kontrolli all hoidmiseks, jälgides hoolikalt veresuhkru ja seerumi kaaliumisisaldust, et vältida hüpoglükeemiat ja hüpokaleemiat. Intravenoosseks kasutamiseks tuleb infusioonisüsteemides APIDRA-d kasutada kontsentratsioonides 0,05 ühikut / ml kuni 1 ühik / ml glulisiininsuliini kohta, kasutades polüvinüülkloriidi (PVC) kotte. APIDRA on osutunud stabiilseks ainult tavalises soolalahuses (0,9% naatriumkloriid). Parenteraalseid ravimeid tuleb enne manustamist visuaalselt kontrollida tahkete osakeste ja värvuse muutuse suhtes, kui lahus ja konteiner seda võimaldavad. Ärge manustage insuliinisegusid intravenoosselt.
Annustamisvormid ja tugevused
Apidra 100 ühikut ml kohta (U-100) on saadaval järgmistes vormides:
- 10 ml viaalid
- 3 ml kolbampullid kasutamiseks OptiClikis® Insuliini kohaletoimetamise seade
- 3 ml SoloStar eeltäidetud pensüstelit
ülaosa
Vastunäidustused
Apidra on vastunäidustatud:
- hüpoglükeemia episoodide ajal
- patsientidel, kellel on ülitundlikkus Apidra või selle abiainete suhtes
Kui ravimit kasutatakse ülitundlikkusega Apidra või selle abiainete suhtes, võivad patsiendid tekkida lokaalsed või generaliseerunud ülitundlikkusreaktsioonid. Kõrvaltoimed].
ülaosa
Hoiatused ja ettevaatusabinõud
Annuse kohandamine ja jälgimine
Glükoosisisalduse jälgimine on insuliinravi saavate patsientide jaoks hädavajalik. Insuliinirežiimi tuleb muuta ettevaatlikult ja ainult arsti järelevalve all. Insuliini tugevuse, tootja, tüübi või manustamisviisi muutused võivad põhjustada vajaduse muuta insuliini annust. Võib osutuda vajalikuks kohandada samaaegset suukaudset diabeediravi.
Nagu kõigi insuliinipreparaatide puhul, võib Apidra toimeaeg erinevatel inimestel või eri aegadel varieeruda sama isik ja sõltub paljudest haigusseisunditest, sealhulgas süstekohast, kohalikust verevarustusest või kohalikust temperatuur. Patsiendid, kes muudavad oma kehalise aktiivsuse taset või söögiplaani, võivad vajada insuliiniannuste kohandamist.
Hüpoglükeemia
Hüpoglükeemia on insuliinravi, sealhulgas Apidra, kõige levinum kõrvaltoime. Hüpoglükeemia risk suureneb rangema glükeemilise kontrolli korral. Patsiente tuleb harida hüpoglükeemia tuvastamiseks ja haldamiseks. Raske hüpoglükeemia võib põhjustada teadvuse kaotust ja / või krampe ning põhjustada ajutisi või püsivaid ajufunktsioone või surma. Raske hüpoglükeemia, mis nõuab teise inimese abi ja / või parenteraalset glükoosiinfusiooni või glükagooni manustamist on täheldatud insuliiniga läbiviidud kliinilistes uuringutes, sealhulgas uuringutes Apidra.
Hüpoglükeemia ajastus kajastab tavaliselt manustatud insuliinipreparaatide ajalisi toimeprofiile. Hüpoglükeemia riski võivad muuta ka muud tegurid, näiteks muutused toidutarbimises (nt toidu kogus või söögikordade aeg), süstekoht, treening ja samaaegsed ravimid. Ravimite koostoimed].
Nagu kõigi insuliinide puhul, olge ettevaatlik hüpoglükeemiaga patsientidel ja patsientidel, kes võivad olla eelsoodumus hüpoglükeemia tekkeks (nt lastel ja patsientidel, kellel on tühja kõhuga toit või toit on ebaregulaarne) sissevõtmine). Hüpoglükeemia tagajärjel võib halveneda patsiendi keskendumis- ja reageerimisvõime. See võib kujutada ohtu olukordades, kus need võimed on eriti olulised, näiteks autojuhtimine või muude masinate käsitsemine.
Seerumi glükoositaseme kiired muutused võivad diabeediga inimestel põhjustada hüpoglükeemiaga sarnaseid sümptomeid, sõltumata glükoosisisaldusest. Hüpoglükeemia varajased hoiatavad sümptomid võivad teatud tingimustel olla erinevad või vähem väljendunud, nagu pikaajaline diabeet, diabeetiline närvihaigus, selliste ravimite kasutamine nagu beetablokaatorid [vt Ravimite koostoimed] või intensiivistunud diabeedikontroll. Need olukorrad võivad põhjustada tõsise hüpoglükeemia (ja võib-olla teadvuse kaotuse) enne patsiendi teadlikkust hüpoglükeemiast.
Intravenoosselt manustatud insuliinil on toime kiirem kui subkutaanselt manustatud insuliinil, mis nõuab hüpoglükeemia jälgimist.
Ülitundlikkus ja allergilised reaktsioonid
Insuliinipreparaatide, sealhulgas Apidra, korral võib tekkida tõsine, eluohtlik, üldine allergia, sealhulgas anafülaksia [vt Kõrvaltoimed].
Hüpokaleemia
Kõik insuliinitooted, sealhulgas Apidra, põhjustavad kaaliumi nihke rakuvälisest ruumist rakusisesesse ruumi, mis võib põhjustada hüpokaleemiat. Ravimata hüpokaleemia võib põhjustada hingamisteede halvatust, vatsakeste arütmia ja surma. Olge ettevaatlik patsientidel, kellel võib olla hüpokaleemia oht (nt patsiendid, kes kasutavad kaaliumi alandavaid ravimeid, patsiendid, kes võtavad seerumi kaaliumisisalduse suhtes tundlikke ravimeid). Apidra intravenoosse manustamise korral jälgige sageli glükoosi ja kaaliumi sisaldust.
Neeru- või maksakahjustus
Neeru- või maksapuudulikkusega patsientidel võib olla vajalik sagedane glükoosisisalduse jälgimine ja insuliini annuse vähendamine Kliiniline farmakoloogia].
Insuliinide segamine
Subkutaanseks süstimiseks mõeldud Apidrat ei tohi segada muude insuliinipreparaatidega kui NPH-insuliin. Kui Apidrat segatakse NPH-insuliiniga, tuleb Apidra kõigepealt süstlasse tõmmata. Süstimine peaks toimuma kohe pärast segamist.
Ärge segage Apidrat teiste insuliinidega intravenoosseks manustamiseks ega pideva subkutaanse infusioonipumba jaoks.
Intravenoosseks manustamiseks mõeldud Apidrat ei tohi lahjendada muude lahustega kui 0,9% naatriumkloriidi (tavaline soolalahus). Apidra segamise efektiivsust ja ohutust välistes nahaaluses infusioonipumpades lahjendite või muude insuliinidega ei ole kindlaks tehtud.
Subkutaansed insuliini infusioonipumbad
Apidrat ei tohi lahjendada ega segada ühegi teise insuliiniga, kui seda kasutatakse välispidises insuliinipumbris. Veepaagis olevat Apidrat tuleb vahetada vähemalt iga 48 tunni järel. Apidrat ei tohiks hoida temperatuuril, mis on kõrgem kui 37 ° C.
Insuliinipumba või infusioonikomplekti talitlushäire või insuliini lagunemine võib kiiresti põhjustada hüperglükeemiat ja ketoosi. Vajalik on hüperglükeemia või ketoosi põhjuse kiire tuvastamine ja parandamine. Võib osutuda vajalikuks ajutine nahaalune süstimine Apidra'ga. Pidevat subkutaanset infusioonipumbaravi vajavad patsiendid peavad olema koolitatud insuliini manustamiseks süstimise teel ja pumba rikke korral peab olema võimalik kasutada alternatiivset insuliinravi. [Vaata Annustamine ja manustamine, Kuidas komplekteeritud / ladustamine ja käitlemine].
Intravenoosne manustamine
Apidra intravenoossel manustamisel tuleb potentsiaalselt fataalse hüpoglükeemia ja hüpokaleemia vältimiseks hoolikalt jälgida glükoosi ja kaaliumi taset.
Ärge segage Apidrat veenisiseseks manustamiseks teiste insuliinidega. Apidrat võib lahjendada ainult tavalises soolalahuses.
Ravimite koostoime
Mõned ravimid võivad muuta insuliinivajadust ja hüpoglükeemia või hüperglükeemia riski Ravimite koostoimed].
ülaosa
Kõrvaltoimed
Järgmisi kõrvaltoimeid käsitletakse mujal:
- Hüpoglükeemia [vt Hoiatused ja ettevaatusabinõud]
- Hüpokaleemia [vt Hoiatused ja ettevaatusabinõud]
Kliiniliste uuringute kogemus
Kuna kliinilisi uuringuid viiakse läbi väga erineva kujundusega, ei pruugi ühe kliinilise uuringu käigus teatatud kõrvaltoimete määr olla on hõlpsasti võrreldav mõnes teises kliinilises uuringus teatatud sagedusega ega pruugi kajastada kliinilises uuringus tegelikult täheldatud sagedust harjutama.
Allpool toodud tabelites on loetletud kõrvaltoimete esinemissagedus Apidra kliinilistes uuringutes I tüüpi suhkurtõve ja II tüüpi suhkurtõvega patsientidel.
Tabel 1: Ravi - tekkivad kõrvaltoimed I tüüpi diabeediga täiskasvanute ühendatud uuringutes (kõrvaltoimed sagedusega ¥% 5%)
| APIDRA,% (n = 950) |
Kõik komparaatorida, % (n = 641) |
|
| Nasofarüngiit | 10.6 | 12.9 |
| Hüpoglükeemiab | 6.8 | 6.7 |
| Ülemiste hingamisteede infektsioon | 6.6 | 5.6 |
| Gripp | 4.0 | 5.0 |
|
a Lisproinsuliin, tavaline iniminsuliin, aspartinsuliin b Ainult raske sümptomaatiline hüpoglükeemia |
Tabel 2: Ravi - tekkivad kõrvaltoimed II tüüpi diabeediga täiskasvanute ühendatud uuringutes (kõrvaltoimed sagedusega ¥% 5%)
| APIDRA,% (n = 883) |
Regulaarne humaaninsuliin,% (n = 883) |
|
| Ülemiste hingamisteede infektsioon | 10.5 | 7.7 |
| Nasofarüngiit | 7.6 | 8.2 |
| Tursed perifeerne | 7.5 | 7.8 |
| Gripp | 6.2 | 4.2 |
| Liigesevalu | 5.9 | 6.3 |
| Hüpertensioon | 3.9 | 5. |
- Pediaatria
Tabelis 3 on kokku võetud kõrvaltoimed, mis ilmnevad kliinilises uuringus sagedamini kui 5% I tüüpi diabeediga lastel ja noorukitel, keda ravitakse APIDRA (n = 277) või insuliin lisproga (n = 295).
Tabel 3: Ravi - võimalikud kõrvaltoimed 1. tüüpi diabeediga lastel ja noorukitel (kõrvaltoimed sagedusega ¥% 5%)
| APIDRA,% (n = 277) |
Lispro,% (n = 295) |
|
| Nasofarüngiit | 9.0 | 9.5 |
| Ülemiste hingamisteede infektsioon | 8.3 | 10.8 |
| Peavalu | 6.9 | 11.2 |
| Hüpoglükeemiline haigushoog | 6.1 | 4.7 |
- Raske sümptomaatiline hüpoglükeemia
Hüpoglükeemia on insuliini, sealhulgas Apidra, kasutavatel patsientidel kõige sagedamini täheldatud kõrvaltoime Hoiatused ja ettevaatusabinõud]. Raske sümptomaatilise hüpoglükeemia esinemissagedus ja esinemissagedus, mida määratletakse kui kolmanda osapoole sekkumist nõudvaks hüpoglükeemiaks, olid kõigi raviskeemide korral võrreldavad (vt tabel 4). 3. faasi kliinilises uuringus oli I tüüpi diabeediga lastel ja noorukitel kõrgem esinemissagedus raske sümptomaatilise hüpoglükeemia esinemissagedus kahes ravirühmas võrreldes 1. tüüpi täiskasvanutega diabeet. (vt tabel 4) [Vt Kliinilised uuringud].
Tabel 4: raske sümptomaatiline hüpoglükeemia *
| 1. tüüpi diabeet Täiskasvanud 12 nädalat koos glargiiniinsuliiniga |
1. tüüpi diabeedi täiskasvanud 26 nädalat koos glargiiniinsuliiniga |
2. tüüpi diabeet Täiskasvanud 26 nädalat koos NPH humaaninsuliiniga |
1. tüüpi diabeedi pediaatria 26 nädalat |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Enne sööki |
Apidra Söögijärgne |
Regulaarne iniminsuliin | Apidra | Insuliin Lispro | Apidra | Regulaarne iniminsuliin | Apidra | Insuliin Lispr | |
| * Raske sümptomaatiline hüpoglükeemia, mis on määratletud kui teise inimese abi vajav hüpoglükeemiline sündmus, mis vastas ühele järgmistest kriteeriumidest: seda sündmust seostati täisvere referentsglükoosisisaldusega <36 mg / dL või sündmusega seostati kiire taastumine pärast suukaudsete süsivesikute, intravenoosse glükoosi või glükagooni manustamist. | |||||||||
| Sündmused kuus patsiendi kohta | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Patsientide protsent (n / kokku N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Insuliini käivitamine ja glükoosikontrolli intensiivistamine
Glükoosikontrolli intensiivistumist või kiiret paranemist on seostatud mööduva, pöörduvaga oftalmoloogiline refraktsioonihäire, diabeetilise retinopaatia süvenemine ja äge valulik perifeerne neuropaatia. Pikaajaline glükeemiline kontroll vähendab aga diabeetilise retinopaatia ja neuropaatia riski.
- Lipodüstroofia
Pikaajaline insuliini, sealhulgas Apidra, kasutamine võib põhjustada lipodüstroofiat korduvate insuliini süstide või infusiooni korral. Lipodüstroofia hõlmab lipohüpertroofiat (rasvkoe paksenemine) ja lipoatroofiat (rasvkoe hõrenemine) ning see võib mõjutada insuliini imendumist. Lipodüstroofia riski vähendamiseks pöörake insuliini süste- või infusioonikohti samas piirkonnas. [Vaata Annustamine ja manustamine].
- Kaalutõus
Kaalutõus võib ilmneda insuliinravi, sealhulgas Apidra kasutamisel. Seda võib seostada insuliini anaboolsete mõjude ja glükosuuria vähenemisega.
- Perifeerne tursed
Insuliin, sealhulgas Apidra, võib põhjustada naatriumipeetust ja turset, eriti kui intensiivse insuliinravi abil parandatakse varem halba metaboolset kontrolli.
- Kõrvaltoimed pideva subkutaanse insuliini infusiooniga (CSII)
12-nädalases randomiseeritud uuringus I tüüpi diabeediga patsientidel (n = 59) kateetri esinemissagedus oklusioonid ja infusioonikoha reaktsioonid olid Apidra ja aspartinsuliiniga ravitud patsientidel sarnased (Tabel 5).
Tabel 5: kateetri oklusioonid ja reaktsioonid infusioonikohas.
| Apidra (n = 29) |
aspartinsuliin (n = 30) |
|
|---|---|---|
| Kateetri oklusioonid kuus | 0.08 | 0.15 |
| Infusioonikoha reaktsioonid | 10.3% (3/29) | 13.3% (4/30) |
- Allergilised reaktsioonid
Kohalik allergia
Nagu iga insuliinravi korral, võib ka Apidrat kasutavatel patsientidel süstekohal tekkida punetus, turse või sügelus. Need vähemolulised reaktsioonid taanduvad tavaliselt mõne päeva kuni mõne nädala jooksul, kuid mõnel juhul võib osutuda vajalikuks Apidra katkestamine. Mõnel juhul võivad need reaktsioonid olla seotud muude teguritega peale insuliini, näiteks nahapuhastusvahendi ärritajate või halva süstimistehnikaga.
Süsteemne allergia
Mis tahes insuliini, sealhulgas Apidra, korral võib tekkida raske, eluohtlik, üldine allergia, sealhulgas anafülaksia. Üldine insuliiniallergia võib põhjustada kogu keha löövet (sh sügelust), hingeldust, vilistavat hingamist, hüpotensiooni, tahhükardiat või diaforeesi.
Kuni 12-kuulise kestusega kontrollitud kliinilistes uuringutes esines võimalikust süsteemsest allergilisest reaktsioonist 79 juhul 1833 patsienti (4,3%), kes said Apidrat, ja 58 patsienti 1524-st (3,8%), kes said võrdlusravimit lühikese toimeajaga insuliinid. Nende uuringute ajal katkestati ravi Apidraga püsivalt ühel 1833 patsiendist võimaliku süsteemse allergilise reaktsiooni tõttu.
Apidra abiaine metakresooli kasutamisel on teatatud lokaliseeritud reaktsioonidest ja üldistest müalgiatest.
Antikehade tootmine
I tüüpi diabeediga patsientidega läbiviidud uuringus (n = 333) määrati insuliinivastaste antikehade kontsentratsioonid, mis reageerivad nii iniminsuliiniga kui ka insuliiniga glulisiin (ristreaktiivsed insuliini antikehad) püsis uuringu esimese 6 kuu jooksul lähtetaseme lähedal Apidra. Järgmise 6 kuu jooksul täheldati antikehade kontsentratsiooni langust. II tüüpi diabeediga (n = 411) patsientidega läbiviidud uuringus täheldati ristreaktiivse insuliini antikehade kontsentratsiooni sarnast suurenemist täheldatud Apidraga ravitud patsientidel ja iniminsuliiniga ravitud patsientidel esimese 9 kuu jooksul Uuring. Seejärel antikehade kontsentratsioon vähenes Apidra patsientidel ja püsis humaaninsuliiniga patsientidel stabiilsena. Ristreaktiivsete insuliini antikehade kontsentratsiooni ja HbA1c, insuliini annuste või hüpoglükeemia esinemissageduse muutuste vahel ei olnud seost. Nende antikehade kliiniline tähtsus ei ole teada.
I tüüpi diabeediga laste ja noorukite uuringus Apidra olulist antikehavastust ei esile kutsunud.
Turundusjärgne kogemus
Apidra müügiloa saamise järgsel kasutamisel on tuvastatud järgmised kõrvaltoimed.
Kuna neid reaktsioone teatatakse vabatahtlikult ebakindla suurusega elanikkonnast, ei ole see nii alati on võimalik usaldusväärselt hinnata nende esinemissagedust või tuvastada põhjuslik seos ravimiga kokkupuude.
On teatatud ravivigadest, mille korral Apidra asemel on kogemata manustatud muid insuline, eriti pika toimeajaga insuline.
ülaosa
Ravimite koostoimed
Paljud ravimid mõjutavad glükoosi metabolismi ja võivad vajada insuliini annuse kohandamist ja eriti hoolikat jälgimist.
Ravimid, mis võivad suurendada insuliinide, sealhulgas Apidra, veresuhkru taset alandavat toimet ja suurendada seetõttu hüpoglükeemia riski, hõlmavad suukaudseid diabeedivastaseid ravimeid, pramlintiid, AKE inhibiitorid, disopüramiid, fibraadid, fluoksetiin, monoaminooksüdaasi inhibiitorid, propoksüfeen, pentoksüfülliin, salitsülaadid, somatostatiini analoogid ja sulfoonamiid antibiootikumid.
Ravimiteks, mis võivad vähendada Apidra vere glükoosisisaldust langetavat toimet, on kortikosteroidid, niatsiin, danasool, diureetikumid, sümpatomimeetilised ained (nt epinefriin, albuterool, terbutaliin), glükagoon, isoniasiid, fenotiasiini derivaadid, somatropiin, kilpnäärmehormoonid, östrogeenid, progestogeenid (nt suukaudsetes rasestumisvastastes vahendites), proteaasi inhibiitorid ja ebatüüpilised antipsühhootikumid.
Beeta-blokaatorid, klonidiin, liitiumsoolad ja alkohol võivad insuliini vere glükoosisisaldust langetavat toimet kas tugevdada või vähendada.
Pentamidiin võib põhjustada hüpoglükeemiat, millele võib mõnikord järgneda hüperglükeemia.
Hüpoglükeemia tunnused võivad väheneda või puududa patsientidel, kes võtavad anti-adrenergilisi ravimeid, nagu beetablokaatorid, klonidiin, guanetidiin ja reserpiin.
ülaosa
Kasutamine konkreetsetes populatsioonides
Rasedus
C-kategooria rasedus: Rottidel ja küülikutel on insuliinglulisiiniga tehtud reproduktsiooni- ja teratoloogilisi uuringuid, kasutades võrdlusena tavalist humaaninsuliini. Emastele rottidele manustati glulisuliininsuliini kogu raseduse ajal subkutaansetes annustes kuni 10 ühikut / kg üks kord päevas (annus andis tulemuseks kokkupuude inimese keskmise doosiga kahekordne, mis põhineb kehapindala võrdlusel) ja sellel ei olnud embrüo-lootele märkimisväärset toksilist toimet areng.
Insuliinglulisiini manustati emastele küülikutele kogu raseduse ajal nahaaluste annustena kuni 1,5 Ühikud / kg / päevas (annus, mille tulemuseks on kokkupuude, mis on 0,5 korda suurem inimese keskmisest annusest, lähtudes kehapindalast võrdlus). Embrüo ja loote arengule avaldati kahjulikku toimet ainult emasloomale toksiliste annuste korral, mis kutsusid esile hüpoglükeemiat. Implantatsioonijärgsete kaotuste ja luustiku defektide esinemissageduse suurenemist täheldati annuse 1,5 ühikut / kg üks kord päevas (annus mille tulemuseks on inimese keskmise doosist 0,5 korda suurem kokkupuude, mis põhineb kehapindala võrdlusel), mis põhjustas ka suremuse tammid. Järgmisel madalamal annusel 0,5 ühikut / kg üks kord päevas täheldati implantatsioonijärgsete kadude esinemissageduse kerget suurenemist (annus andis tulemuseks 0,2 kordades inimese keskmise annuse, mis põhineb kehapindala võrdlusel), mida seostati ka raske hüpoglükeemiaga, kuid sellel puudusid puudused annus. Küülikutel annuses 0,25 ühikut / kg üks kord ööpäevas ei täheldatud mingeid toimeid (annus, mille tulemuseks oli kokkupuude 0,1-kordse inimese keskmise annusega, kehapinna võrdluse põhjal). Insuliinglulisiini toime ei erinenud samades annustes subkutaanse regulaarse humaaninsuliini korral täheldatud toimetest ja see omistati emade hüpoglükeemia sekundaarsele toimele.
Apidra kasutamise kohta rasedatel ei ole hästi kontrollitud kliinilisi uuringuid. Kuna loomade paljunemise uuringud ei ennusta alati inimese reageeringut, tuleks seda ravimit raseduse ajal kasutada ainult siis, kui potentsiaalne kasu õigustab potentsiaalset ohtu lootele. Suhkurtõve või rasedusdiabeedi anamneesiga patsientide jaoks on oluline säilitada hea metaboolne kontroll enne rasestumist ja kogu raseduse ajal. Insuliinivajadus võib esimesel trimestril väheneda, teisel ja kolmandal trimestril suureneda ning pärast sünnitust kiiresti väheneda. Nendel patsientidel on oluline hoolikalt jälgida glükoosisisaldust.
Imetavad emad
Pole teada, kas glulisiininsuliin eritub inimese rinnapiima. Kuna paljud ravimid erituvad inimese rinnapiima, tuleb Apidra manustamisel imetavale naisele olla ettevaatlik. Apidra kasutamine sobib imetamisega, kuid imetavad diabeediga naised võivad vajada insuliiniannuste kohandamist.
Kasutamine lastel
Apidra nahaaluste süstide ohutus ja efektiivsus on kindlaks tehtud 1. tüüpi diabeediga lastel (vanuses 4–17 aastat) [vt Kliinilised uuringud]. Apidrat ei ole uuritud alla 4-aastastel I tüüpi diabeediga lastel ja II tüüpi diabeediga lastel.
Nagu täiskasvanutel, peab ka Apidra annus lastel olema individuaalne, lähtudes ainevahetuse vajadustest ja vere glükoosisisalduse sagedast jälgimisest.
Geriaatriline kasutamine
Kliinilistes uuringutes (n = 2408) manustati Apidrat 147-le 65-aastasele patsiendile ja 27-le 75-aastasele patsiendile. Enamikul sellest väikesest eakate patsientide alarühmast oli II tüüpi diabeet. HbA1c väärtuste ja hüpoglükeemia sageduse muutus ei erinenud vanusest. Sellegipoolest tuleb Apidra manustamisel geriaatrilistele patsientidele olla ettevaatlik.
ülaosa
Üleannustamine
Liigne insuliin võib põhjustada hüpoglükeemiat ja eriti intravenoosselt manustatuna hüpokaleemiat. Hüpoglükeemia kergeid episoode saab tavaliselt ravida suu kaudu manustatava glükoosiga. Vajalikuks võib osutuda ravimite annuse, söögikordade või treeningu kohandamine. Tõsisemaid hüpoglükeemia episoode koos kooma, krampide või neuroloogiliste häiretega võib ravida intramuskulaarse / nahaaluse glükagooni või kontsentreeritud intravenoosse glükoosiga. Vajalik võib olla pidev süsivesikute tarbimine ja jälgimine, kuna hüpoglükeemia võib ilmse kliinilise taastumise korral korduda. Hüpokaleemiat tuleb vastavalt korrigeerida.
Kirjeldus
Apidra® (insuliinglulisiini [rDNA päritolu] süst) on kiire toimega humaaninsuliini analoog, mida kasutatakse vere glükoosisisalduse alandamiseks. Gluliininsuliini toodetakse rekombinantse DNA tehnoloogia abil, kasutades mittepatogeenset Escherichia coli (K12) laboratoorset tüve. Insuliinglulisiin erineb humaaninsuliinist selle poolest, et aminohappe asparagiin positsioonis B3 asendatakse lüsiiniga ja positsioonis B29 olev lüsiin glutamiinhappega. Keemiliselt on glulisiininsuliin 3B-lüsiin-29B-glutamiinhappe-iniminsuliin, selle empiiriline valem on C258H384N64O78S6 ja molekulmass 5823 ning sellel on järgmine struktuurvalem:

Apidra on steriilne vesilahus, selge ja värvitu lahus. Iga Apidra milliliiter sisaldab 100 ühikut (3,49 mg) glulisiininsuliini, 3,15 mg metakresooli, 6 mg trometamiini, 5 mg naatriumkloriidi, 0,01 mg polüsorbaati 20 ja süstevett. Apidra pH on umbes 7,3. PH reguleeritakse soolhappe vesilahuste ja / või naatriumhüdroksiidi lisamisega.
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Glükoosi metabolismi reguleerimine on insuliinide ja insuliini analoogide, sealhulgas glulisiininsuliini esmane tegevus. Insuliinid alandavad vere glükoosisisaldust, stimuleerides perifeerset glükoosivarustust skeletilihastes ja rasvas ning pärssides maksa glükoositootmist. Insuliinid pärsivad lipolüüsi ja proteolüüsi ning soodustavad valkude sünteesi.
Apidra ja tavalise humaaninsuliini glükoosisisaldust vähendav toime on intravenoosse manustamise korral tasakaalustatud. Pärast nahaalust manustamist on Apidra toime kiirem ja tavalise humaaninsuliiniga võrreldes lühem. [Vt farmakodünaamika].
Farmakodünaamika
Tervete vabatahtlike ja diabeediga patsientidega tehtud uuringud näitasid, et Apidral on kiirem toime toime algus ja lühem toimeaeg kui tavalisel humaaninsuliinil subkutaanselt.
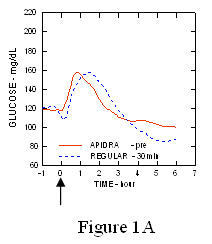
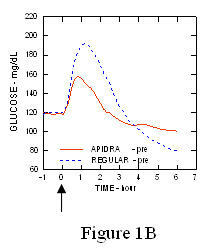
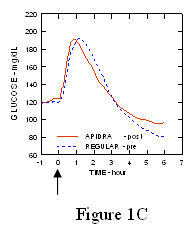
I tüüpi diabeediga (n = 20) patsientidega läbiviidud uuringus Apidra ja tavalist iniminsuliini hinnati erinevatel aegadel võrreldes tavalise toidukorraga annuses 0,15 Ühikud / kg. (Joonis 1.)
Maksimaalne vere glükoosisisaldus (Î ”GLUmax; lahutatud glükoosikontsentratsioon algtasemest) 2 minutit enne sööki süstitud Apidra puhul oli 65 mg / dL, võrreldes tavalise inimese 64 mg / dL 30 minutit enne sööki süstitud insuliini (vt joonis 1A) ja tavalise iniminsuliini süstimisel 84 mg / dL 2 minutit enne sööki (vt joonis 1) 1B). 15 minutit pärast söögi algust süstitud Apidra maksimaalne vere glükoosisisaldus oli 85 mg / dL võrreldes 84 mg / dL tavalise humaaninsuliini süstimisel 2 minutit enne sööki (vt joonis 5) 1C).
Joonis 1. Seerumi keskmine vere glükoosisisaldus, mis koguti kuni 6 tundi pärast Apidra ja tavalise humaaninsuliini ühekordset annust. Apidrat manustati 2 minutit (Apidra - pre) enne söögi algust, võrreldes tavalise humaaninsuliiniga, mida manustati 30 minutit (regulaarne - 30 min) enne söögi algust (joonis 1A) ja võrreldes tavalise humaaninsuliiniga (tavaline - eel), mida manustati 2 minutit enne sööki (joonis 1A) 1B). Apidrat manustati 15 minutit (Apidra - pärast) pärast söögi algust, võrreldes tavalise humaaninsuliiniga (tavaline - eel), mida manustati 2 minutit enne sööki (joonis 1C). X-teljel null (0) on 15-minutise söögikorra algus.
 |
 |
 |
 |
Randomiseeritud, avatud, kahesuunalises ristumisuuringus manustati intravenoosselt 16 tervet meessoost isikut Apidra või tavalise iniminsuliini infusioon soolalahusega, kiirusega 0,8 milligrammi ühikut / kg / min kahe kohta tundi. Apidra sama annuse või tavalise humaaninsuliini infusioon andis tasakaalukontsentratsiooni korral samaväärse glükoosisisalduse.
Farmakokineetika
Imendumine ja biosaadavus
Tervete vabatahtlike ja suhkurtõvega (1. või 2. tüüpi) patsientide farmakokineetilised profiilid näitasid, et insuliini glulisiini imendumine oli kiirem kui tavalise humaaninsuliini puhul.
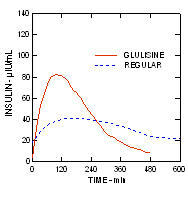
I tüüpi diabeediga (n = 20) patsientidega tehtud uuringus pärast nahaalust manustamist 0,15 ühikut / kg oli keskmine aeg maksimaalse kontsentratsioonini (Tmax) oli 60 minutit (vahemik 40 kuni 120 minutit) ja glükosiininsuliini maksimaalne kontsentratsioon (Cmax) oli 83 mikroühikut / ml (vahemikus 40 kuni 131 mikroühikut / ml). võrreldes tavalise inimese keskmise Tmax-iga 120 minutit (vahemik 60 kuni 239 minutit) ja Cmax-ga 50 mikroühikut / ml (vahemikus 35 kuni 71 mikroühikut / ml) insuliin. (Joonis 2)
Joonis 2. I tüüpi diabeediga patsientidel insuliinglulisiini ja tavalise humaaninsuliini farmakokineetilised profiilid pärast annust 0,15 ühikut / kg.

Glulisinsuliini ja tavalist humaaninsuliini manustati subkutaanselt annuses 0,2 ühikut / kg euglükeemiline klambri uuring II tüüpi diabeediga (n = 24) patsientidel ja kehamassiindeksiga (KMI) vahemikus 20 kuni 36 kg / m2. Keskmine aeg maksimaalse kontsentratsioonini (Tmax) oli 100 minutit (vahemik 40 kuni 120 minutit) ja keskmine maksimaalne kontsentratsioon (Cmax) oli 84 mikroühikut / ml (vahemikus 53 kuni 165 mikroühikut / ml). glulisiininsuliini puhul võrreldes tavalise humaaninsuliini keskmise Tmax-iga 240 minutit (vahemikus 80 kuni 360 minutit) ja keskmise Cmax-iga 41 mikroühikut / ml (vahemikus 33 kuni 61 mikroühikut / ml). (Joonis 3.)
Joonis 3. Insuliinglulisiini ja tavalise humaaninsuliini farmakokineetilised profiilid II tüüpi diabeediga patsientidel pärast subkutaanset annust 0,2 ühikut / kg.
Kui Apidrat süstiti subkutaanselt keha erinevatesse piirkondadesse, olid ajakontsentratsiooni profiilid sarnased. Insuliinglulisiini absoluutne biosaadavus pärast subkutaanset manustamist on umbes 70%, sõltumata süstepiirkonnast (kõht 73%, deltalihas 71%, reie 68%).
Tervete vabatahtlikega (n = 32) tehtud kliinilises uuringus oli insuliini glulisiini kogu biosaadavus nahaaluse naha korral sarnane süstige glulisiininsuliini ja NPH-insuliini (süstlasse segatud) ja eraldi samaaegselt subkutaanselt süstid. Pärast eelsegamist vähenes Apidra maksimaalne kontsentratsioon (Cmax) 27%; maksimaalse kontsentratsioonini jõudmise aega (Tmax) see siiski ei mõjutanud. Puuduvad andmed Apidra segamise kohta teiste insuliinipreparaatidega peale NPH-insuliini. [Vaata Kliinilised uuringud].
Levitamine ja kõrvaldamine
Insuliinglulisiini ja tavalise humaaninsuliini jaotumine ja elimineerimine pärast intravenoosset manustamist manustamine on sarnane jaotusruumalaga 13 ja 21 L ning poolestusajaga 13 ja 17 minutit, vastavalt. Pärast subkutaanset manustamist elimineeritakse glulisinsuliin kiiremini kui tavalisel humaaninsuliinil, selle poolväärtusaeg on 42 minutit võrreldes 86 minutiga.
Kliiniline farmakoloogia konkreetsetes populatsioonides
Lapsed
Apidra ja tavalise humaaninsuliini farmakokineetilisi ja farmakodünaamilisi omadusi hinnati a uuring viidi läbi 1–1-aastastel lastel (n = 10) ja 12–16-aastastel noorukitel (n = 10) diabeet. Apidra ja tavalise humaaninsuliini farmakokineetika ja farmakodünaamika suhteline erinevus need I tüüpi diabeediga patsiendid olid sarnased tervetel täiskasvanutel ja I tüüpi täiskasvanutel diabeet.
Rass
24 terve kaukaasialase ja jaapanlasega läbi viidud uuringus võrreldi farmakokineetikat ja farmakodünaamikat pärast insuliini glulisiini, lisproinsiini ja tavalise humaaninsuliini subkutaanset süstimist. Subkutaanse insuliinglulisiini süstimisega oli Jaapani isikutel suurem esialgne ekspositsioon (33%) AUC (0–1h) ja AUC (0-klambriline ots) suhte osas kui kaukaaslastel (21%), ehkki kogu kokkupuude oli sarnane. Sarnaseid leide oli ka lisproinsuliini ja tavalise humaaninsuliini kohta.
Rasvumine
Glulisinsuliini ja tavalist humaaninsuliini manustati subkutaanselt annuses 0,3 ühikut / kg a euglükeemiline klambri uuring rasvunud, mittediabeetilistel isikutel (n = 18) kehamassiindeksiga (KMI) vahemikus 30–40 kg / m2. Keskmine aeg maksimaalse kontsentratsioonini (Tmax) oli 85 minutit (vahemik 49 kuni 150 minutit) ja keskmine maksimaalne kontsentratsioon (Cmax) oli 192 mikroühikut / ml (vahemikus 98 kuni 380 mikroühikut / ml). glulisiininsuliini puhul võrreldes tavalise inimese keskmise Tmax-iga 150 minutit (vahemikus 90 kuni 240 minutit) ja keskmise Cmax-iga 86 mikroühikut / ml (vahemikus 43 kuni 175 mikroühikut / ml) insuliin.
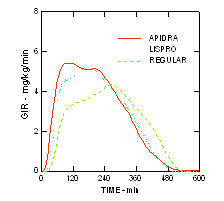
Apidra ja lisproinsuliini toime kiirem algus ja lühem toime kestus võrreldes tavalise humaaninsuliiniga püsis rasvunud mittediabeedilises populatsioonis (n = 18). (Joonis 4.)
Joonis 4. Glükoosi infusioonikiirus (GIR) euglükeemilise klambri uuringus pärast Apidra, insuliin lispro või tavalise humaaninsuliini subkutaanset süstimist 0,3 ühikut / kg rasvunud elanikkonna puhul.
Neerukahjustus
Iniminsuliiniga tehtud uuringud on näidanud neerupuudulikkusega patsientide tsirkuleeriva sisalduse suurenemist ringluses. Uuringus, mis viidi läbi 24 mittediabeetilisel isikul, kellel oli normaalne neerufunktsioon (ClCr> 80 ml / min), mõõdukas neerukahjustus (30–50 ml / min) ja raske neerukahjustus (hoiatused ja ettevaatusabinõud).
Maksakahjustus
Maksapuudulikkuse mõju Apidra farmakokineetikale ja farmakodünaamikale ei ole uuritud. Mõned iniminsuliiniga tehtud uuringud on näidanud maksapuudulikkusega patsientide tsirkuleeriva sisalduse suurenemist ringluses. [Vaata Hoiatused ja ettevaatusabinõud].
Sugu
Soo mõju Apidra farmakokineetikale ja farmakodünaamikale ei ole uuritud.
Rasedus
Raseduse mõju Apidra farmakokineetikale ja farmakodünaamikale ei ole uuritud.
Suitsetamine
Suitsetamise mõju Apidra farmakokineetikale ja farmakodünaamikale ei ole uuritud.
ülaosa
Mittekliiniline toksikoloogia
Kartsinogenees, mutagenees, viljakuse langus
Standardseid 2-aastaseid kantserogeensuse uuringuid loomadel ei ole läbi viidud. Sprague Dawley rottidel viidi läbi 12-kuuline korduvannuse toksilisuse uuring insuliinglulisiiniga subkutaansetes annustes 2,5, 5, 20 või 50 ühikut / kg kaks korda päevas (annus, mille tulemuseks on kokkupuude 1, 2, 8 ja 20-kordse inimese keskmise doosiga, lähtudes kehapindalast võrdlus).
Emastel rottidel, kellele manustati glulisiininsuliini, oli piimanäärme kasvajate esinemissagedus annusest mittesõltuv, võrreldes ravimata kontrollrühmaga. Piimanäärmetuumorite esinemissagedus insuliinglulisiini ja tavalise humaaninsuliini osas oli sarnane. Nende leidude olulisus inimesele pole teada. Insuliinglulisiin ei olnud järgmistes testides mutageenne: Amesi test, imetaja in vitro kromosoom aberratsiooni test V79 hiina hamstri rakkudes ja imetajate erütrotsüütide mikrotuuma test in vivo rotid.
Fertiilsusuuringutes isastel ja emastel rottidel subkutaansetes annustes kuni 10 ühikut / kg üks kord päevas (annus andis keskmise inimese kehapindala võrdlusel põhinev annus), ei ilmnenud selget kahjulikku mõju meeste ja naiste fertiilsusele ega loomade üldisele paljunemisvõimele täheldatud.
ülaosa
Kliinilised uuringud
Apidra ohutust ja efektiivsust uuriti 1. ja 2. tüüpi diabeediga täiskasvanud patsientidel (n = 1833) ning 1. tüüpi diabeediga lastel ja noorukitel (4–17 aastat) (n = 572). Nendes uuringutes oli esmane efektiivsuse parameeter glükeemiline kontroll, mida hinnati glükeeritud hemoglobiini abil (GHb märgiti HbA1c ekvivalendina).
1. tüüpi diabeet - täiskasvanud
I tüüpi diabeediga patsientidega viidi läbi 26-nädalane randomiseeritud avatud, aktiivse kontrollitud mitte-alaväärtuslikkuse uuring, et hinnata Apidra (n = 339) ohutus ja efektiivsus võrreldes lisproinsuliiniga (n = 333), kui seda manustati subkutaanselt 15 minuti jooksul enne sööki. Glargiinsuliini manustati üks kord päevas õhtul põhinsuliinina. Enne randomiseerimist oli neljanädalane sissetoomise periood insuliin lispro ja glargiininsuliiniga. Enamik patsiente olid kaukaasialased (97%). Viiskümmend kaheksa protsenti patsientidest olid mehed. Keskmine vanus oli 39 aastat (vahemik 18 kuni 74 aastat). Glükeemiline kontroll, ööpäevaste lühitoimeliste insuliini süstide arv ja Apidra ning lisproinsiini päevased koguannused olid kahes ravirühmas sarnased (tabel 6).
Tabel 6: 1. tüüpi diabeedi müelitus - täiskasvanud
| Ravi kestus Ravi koos: |
26 nädalat Insuliinglargiin |
|
|---|---|---|
| Apidra | Insuliin Lispro | |
| ||
| Glükeeritud hemoglobiin (GHb)* (%) | ||
| Patsientide arv | 331 | 322 |
| Algjoone keskmine | 7.6 | 7.6 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | -0.1 | -0.1 |
| Ravi erinevus: Apidra - insuliin Lispro | 0.0 | |
| Ravi erinevuse korral 95% CI | (-0.1; 0.1) | |
| Baasinsuliini annus (ühikut päevas) | ||
| Algjoone keskmine | 24 | 24 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | 0 | 2 |
| Lühitoimeline insuliini annus (ühikut päevas) | ||
| Algjoone keskmine | 30 | 31 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | -1 | -1 |
| Lühikese toimeajaga insuliini süstide keskmine arv päevas | 3 | 3 |
| Kehakaal (kg) | ||
| Algjoone keskmine | 73.9 | 74.1 |
| Keskmine muutus algtasemest | 0.6 | 0.3 |
2. tüüpi diabeet - täiskasvanud
Insuliiniga ravitud II tüüpi diabeediga patsientidel viidi läbi 26-nädalane randomiseeritud avatud, aktiivse kontrolliga mitte-alaväärtuslikkuse uuring, et hinnata Apidra (n = 435) 15 minutit enne sööki manustatud ohutus ja efektiivsus võrreldes tavalise humaaninsuliiniga (n = 441), mida manustati 30–45 minutit enne sööki sööki. NPH humaaninsuliini manustati kaks korda päevas baasinsuliinina. Kõik patsiendid osalesid neljanädalases sissejuhatavas perioodis tavalise humaaninsuliini ja NPH humaaninsuliiniga. 85 protsenti patsientidest olid kaukaasia ja 11% mustanahalised. Keskmine vanus oli 58 aastat (vahemikus 26 kuni 84 aastat). Keskmine kehamassiindeks (KMI) oli 34,6 kg / m2. Juhusliku valiku alusel võtsid 58% patsientidest suukaudset diabeedivastast ravimit. Nendele patsientidele juhendati jätkama suukaudse diabeediravimi kasutamist kogu uuringu vältel samas annuses. Enamik patsiente (79%) segasid lühikese toimeajaga insuliini NPH-humaaninsuliiniga vahetult enne süstimist. GHb langus algtasemest oli kahe ravirühma vahel sarnane (vt tabel 7). Päevase lühitoimelise insuliini süstide arvu või põhi- või lühitoimeliste insuliiniannuste osas Apidra ja tavaliste iniminsuliinigruppide vahel erinevusi ei täheldatud. (Vaata tabelit 7.)
Tabel 7: II tüüpi diabeet - täiskasvanud
| Ravi kestus | 26 nädalat | |
|---|---|---|
| Ravi koos: | NPH humaaninsuliin | |
| Apidra | Regulaarne iniminsuliin | |
| ||
| Glükeeritud hemoglobiin (GHb)* (%) | ||
| Patsientide arv | 404 | 403 |
| Algjoone keskmine | 7.6 | 7.5 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | -0.5 | -0.3 |
| Ravi erinevus: Apidra - regulaarne iniminsuliin | -0.2 | |
| Ravi erinevuse korral 95% CI | (-0.3; -0.1) | |
| Baasinsuliini annus (ühikut päevas) | ||
| Algjoone keskmine | 59 | 57 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | 6 | 6 |
| Lühitoimeline insuliini annus (ühikut päevas) | ||
| Algjoone keskmine | 32 | 31 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | 4 | 5 |
| Lühikese toimeajaga insuliini süstide keskmine arv päevas | 2 | 2 |
| Kehakaal (kg) | ||
| Algjoone keskmine | 100.5 | 99.2 |
| Keskmine muutus algtasemest | 1.8 | 2.0 |
1. tüüpi diabeet - täiskasvanud: manustamine enne ja pärast sööki
12-nädalase, randomiseeritud, avatud, aktiivselt kontrollitud, mitte alaväärsuse uuringu viidi läbi patsientidel, kellel oli I tüüpi diabeet, et hinnata Apidra ohutust ja efektiivsust erinevatel aegadel a sööki. Apidrat manustati subkutaanselt kas 15 minuti jooksul enne sööki (n = 286) või vahetult pärast sööki sööki (n = 296) ja tavalist humaaninsuliini (n = 278) manustati subkutaanselt 30 kuni 45 minutit enne sööki. Glargiinsuliini manustati üks kord päevas enne magamaminekut põhinsuliinina. Regulaarse humaaninsuliini ja glargiinsuliiniga oli 4-nädalane sissejuhatav periood, millele järgnes randomiseerimine. Enamik patsiente olid kaukaasialased (94%). Keskmine vanus oli 40 aastat (vahemik 18 kuni 73 aastat). Glükeemiline kontroll (vt tabel 8) oli võrreldav kõigi kolme raviskeemi puhul. Lühitoimeliste insuliinisüstide koguarvus päevas ei täheldatud raviga võrreldes mingeid muutusi. (Vt tabel 8.)
Tabel 8: Enne ja pärast sööki manustamine täiskasvanud 1. tüüpi suhkurtõve korral
| Ravi kestus Ravi koos: |
12 nädalat glargiiniinsuliin |
12 nädalat glargiiniinsuliin |
12 nädalat glargiiniinsuliin |
|---|---|---|---|
| Apidra eel sööki |
Apidra söögijärgne |
Regulaarne iniminsuliin | |
| |||
| Glükeeritud hemoglobiin (GHb)* (%) | |||
| Patsientide arv | 268 | 276 | 257 |
| Algjoone keskmine | 7.7 | 7.7 | 7.6 |
| Korrigeeritud keskmine muutus võrreldes algtasemega†| -0.3 | -0.1 | -0.1 |
| Baasinsuliini annus (ühikut päevas) | |||
| Algjoone keskmine | 29 | 29 | 28 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | 1 | 0 | 1 |
| Lühitoimeline insuliini annus (ühikut päevas) | |||
| Algjoone keskmine | 29 | 29 | 27 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | -1 | -1 | 2 |
| Lühikese toimeajaga insuliini süstide keskmine arv päevas | 3 | 3 | 3 |
| Kehakaal (kg) | |||
| Algjoone keskmine | 79.2 | 80.3 | 78.9 |
| Keskmine muutus algtasemest | 0.3 | -0.3 | 0.3 |
1. tüüpi diabeediga lapsed
26-nädalane randomiseeritud avatud aktiivne kontrollitud mitte-alaväärtuslikkuse uuring viidi läbi 1. tüüpi lastel ja noorukitel, üle 4-aastased suhkurtõbi, et hinnata Apidra (n = 277) ohutust ja efektiivsust võrreldes lisproinsuliiniga (n = 295), kui seda manustati subkutaanselt 15 minuti jooksul enne sööki. Patsiendid said ka glargiini insuliini (manustatakse üks kord päevas õhtul) või NPH insuliini (manustatakse üks kord hommikul ja üks kord õhtul). Enne randomiseerimist oli neljanädalane sissetoomise periood insuliin lispro ja insuliiniglargiini või NPH-ga. Enamik patsiente olid kaukaasialased (91%). Viiskümmend protsenti patsientidest olid mehed. Keskmine vanus oli 12,5 aastat (vahemikus 4–17 aastat). Keskmine KMI oli 20,6 kg / m2. Glükeemiline kontroll (vt tabel 9) oli kahe raviskeemi korral võrreldav.
Tabel 9: I tüüpi suhkurtõbe põdevatel lastel läbiviidud 26-nädalase uuringu tulemused
| Apidra | Lispro | |
|---|---|---|
| Patsientide arv | 271 | 291 |
| Basaalinsuliin | NPH või glargiinsuliin | NPH või glargiinsuliin |
| ||
| Glükeeritud hemoglobiin (GHb)* (%) | ||
| Algjoone keskmine | 8.2 | 8.2 |
| Korrigeeritud keskmine muutus võrreldes algtasemega | 0.1 | 0.2 |
| Ravi erinevus: Keskmine (usaldusvahemik 95%) | -0.1 (-0.2, 0.1) | |
| Baasinsuliini annus (ühikut / kg päevas) | ||
| Algjoone keskmine | 0.5 | 0.5 |
| Keskmine muutus algtasemest | 0.0 | 0.0 |
| Lühitoimeline insuliini annus (ühikut / kg päevas) | ||
| Algjoone keskmine | 0.5 | 0.5 |
| Keskmine muutus algtasemest | 0.0 | 0.0 |
| Lühikese toimeajaga insuliini süstide keskmine arv päevas | 3 | 3 |
| Algväärtus keskmine kehakaal (kg) | 51.5 | 50.8 |
| Keskmine kaalu muutus võrreldes algtasemega (kg) | 2.2 | 2.2 |
1. tüüpi diabeet - täiskasvanud: pidev subkutaanne insuliini infusioon
12-nädalane randomiseeritud aktiivne kontroll-uuring (Apidra versus aspartinsuliin), mis viidi läbi 1. tüüpi diabeediga täiskasvanutel (Apidra n = 29, aspartinsuliin n = 30) hindas Apidra kasutamist välise pideva subkutaanse insuliini korral pump. Kõik patsiendid olid kaukaaslased. Keskmine vanus oli 46 aastat (vahemik 21–73 aastat). Keskmine GHb tõusis algtasemest lõpp-punktini mõlemas ravirühmas (6,8% -lt 7,0% -ni Apidra puhul; aspartinsuliini puhul 7,1% kuni 7,2%).
ülaosa
Kuidas komplekteeritud / ladustamine ja käitlemine
Kuidas komplektis
| |
| Apidra 100 ühikut ml kohta (U-100) on saadaval järgmistes vormides: | |
| 10 ml viaalid | NDC 0088-2500-33 |
| 3 ml kassett süsteem*, pakendis 5 | NDC 0088-2500-52 |
| 3 ml SoloStar eeltäidetud pensüstelit, viies pakendis | NDC 0088-2502-05 |
Pliiatsinõelad ei kuulu pakendisse.
BD Ultra-Fine ™ pliiatsinõelu1, mida kasutatakse koos OptiClikiga, müüakse eraldi ning neid toodavad Becton Dickinson ja Company.
Solostar ühildub kõigi Becton Dickinson and Company, Ypsomed ja Owen Mumford pliiatsinõeltega.
Ladustamine
Ärge kasutage pärast kõlblikkusaega (vt pakendit ja pakendit).
Avamata viaal / kassetisüsteem / SoloStar
Avamata Apidra viaale, kolbampullisüsteeme ja SoloStar'i tuleb hoida külmkapis (2 ° C – 8 ° C). Kaitsta valguse eest. Apidrat ei tohiks hoida sügavkülmas ja sellel ei tohiks lasta külmuda. Visake ära, kui see on külmunud.
Avamata viaalid / kolbampullisüsteemid / SoloStar, mida ei säilitata külmkapis, tuleb ära kasutada 28 päeva jooksul.
Avatud (kasutusel) viaal:
Avatud viaalid, jahutatud või jahutamata, tuleb ära kasutada 28 päeva jooksul. Kui jahutamine pole võimalik, võib kasutatavat viaali hoida 28 päeva jooksul külmumiseta ja otsese kuumuse ja valguse eest külma, kuni temperatuur ei ületa 25 ° C.
Avatud (kasutuses) kassettsüsteem:
OptiClik®-i sisestatud (kasutuses) kassett-süsteemi EI tohi jahutada, vaid seda tuleks hoida temperatuuril alla 25 ° C otsese kuumuse ja valguse eest. Avatud (kasutuses olev) kassetisüsteem tuleb 28 päeva pärast ära visata. Ärge hoidke OptiClik® koos kassetisüsteemiga või ilma selleta igal ajal külmkapis.
Avatud (kasutusel) SoloStar eeltäidetud pensüstel:
Avatud (kasutuses) SoloStar EI tohi olla jahutatud, vaid seda tuleks hoida temperatuuril alla 25 ° C (otsese kuumuse ja valguse). Toatemperatuuril hoitud avatud (kasutusel) SoloStar tuleb 28 päeva pärast ära visata.
Infusioonikomplektid:
Infusioonikomplektid (reservuaarid, torud ja kateetrid) ja reservuaaris olev Apidra tuleb pärast 48-tunnist kasutamist või temperatuuril, mis ületab 37 ° C, hävitada.
Intravenoosne kasutamine:
Infusioonikotid, mis on valmistatud vastavalt punktile 3.4 ANNUSTAMINE JA HALDAMINE on toatemperatuuril 48 tundi stabiilsed.
Ettevalmistus ja käitlemine
Pärast intravenoosseks kasutamiseks mõeldud lahjendamist tuleb lahust enne manustamist visuaalselt kontrollida osakeste ja värvuse muutuse osas. Ärge kasutage lahust, kui see on muutunud häguseks või sisaldab osakesi; kasutage ainult siis, kui see on selge ja värvitu. Apidra ei ühildu dekstroosi ja Ringeri lahustega ning seetõttu ei saa seda nende lahusevedelikega kasutada. Apidra kasutamist koos teiste lahustega ei ole uuritud ja seetõttu ei soovitata.
Kolbampullisüsteem: kui OptiClik® (Apidra insuliini tarnimisseade) ei tööta, võib Apidra kolbampullisüsteemist tõmmata U-100 süstlasse ja süstida.
Apidra, glusiiniinsuliin, teave patsiendi kohta (lihtsas inglise keeles)
viimati värskendatud: 02/2009
Üksikasjalik teave diabeedi märkide, sümptomite, põhjuste, ravi kohta
Selles monograafias sisalduv teave ei hõlma kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet ega kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi: Sirvige kõiki diabeedi ravimeid



