Janumet diabeedi raviks
Brändinimi: Janumet
Üldnimetus: sitagliptiin ja metformiinvesinikkloriid
Sisu:
Näidustused ja kasutamine
Annustamine ja manustamine
Annustamisvormid ja tugevused
Vastunäidustused
Hoiatused ja ettevaatusabinõud
Kõrvaltoimed
Ravimite koostoimed
Kasutamine konkreetsetes populatsioonides
Üleannustamine
Kirjeldus
Farmakoloogia
Mittekliiniline toksikoloogia
Kliinilised uuringud
Kuidas komplektis
Patsientide nõustamise teave
Janumet, sitagliptiin ja metformiinvesinikkloriid, teave patsiendi kohta (lihtsas inglise keeles)
HOIATUS: LAKTIKAPIDOOS
Laktatsidoos on harv, kuid tõsine komplikatsioon, mis võib tekkida metformiini kuhjumise tõttu. Risk suureneb selliste seisundite korral nagu sepsis, dehüdratsioon, liigne alkoholitarbimine, maksapuudulikkus, neerukahjustus ja äge kongestiivne südamepuudulikkus.
Algus on sageli peen, millega kaasnevad ainult mittespetsiifilised sümptomid nagu halb enesetunne, müalgia, hingamishäired, suurenev unisus ja mittespetsiifiline kõhuhäda. Laboratoorsete kõrvalekallete hulka kuulub madal pH, suurenenud anioonide vahe ja kõrgenenud vere laktaadisisaldus.
Atsidoosi kahtluse korral Janumet1 tuleb katkestada ja patsient viivitamatult haiglasse viia. [Vaata Hoiatused ja ettevaatusabinõud]
Näidustused ja kasutamine
Janumet on näidustatud täiendusena dieedile ja treeningule glükeemilise kontrolli parandamiseks II tüüpi suhkurtõvega täiskasvanutel, kui ravi on sobiv nii sitagliptiini kui ka metformiiniga. [Vaata Kliinilised uuringud.]
Olulised kasutamispiirangud
Janumeti ei tohi kasutada 1. tüüpi diabeediga patsientidel ega diabeetilise ketoatsidoosi raviks, kuna see ei oleks sellises olukorras efektiivne.
Janumeti kasutamist kombinatsioonis insuliiniga ei ole uuritud.
ülaosa
Annustamine ja manustamine
Soovitatav annustamine
Janumet'iga antihüperglükeemilise ravi annus tuleb individuaalselt kohandada vastavalt patsiendi praegusele raviskeemile, efektiivsus ja talutavus, samal ajal kui see ei ületa sitagliptiini maksimaalset soovitatavat ööpäevast annust - 100 mg ja 2000 mg metformiin. Esialgne kombinatsioonravi või kombineeritud ravi jätkamine tuleks individualiseerida ja jätta tervishoiuteenuse osutaja otsustada.
Janumet'i tuleks metformiini põhjustatud seedetrakti (GI) kõrvaltoimete vähendamiseks manustada tavaliselt kaks korda päevas koos toiduga, järk-järgult suurendades annust.
Janumeti algannus peab põhinema patsiendi praegusel raviskeemil. Janumet'i tuleb manustada kaks korda päevas koos toiduga. Saadaval on järgmised annused:
50 mg sitagliptiini / 500 mg metformiinvesinikkloriidi
50 mg sitagliptiini / 1000 mg metformiinvesinikkloriidi.
Patsiendid, kelle toitumine ja füüsiline koormus üksi ei ole piisavad
Kui II tüüpi suhkurtõvega patsientide jaoks peetakse sobivaks ravi sitagliptiini ja metformiini sisaldava kombineeritud tabletiga ebapiisavalt kontrollitud ainult dieedi ja füüsilise koormusega, on soovitatav algannus 50 mg sitagliptiini / 500 mg metformiinvesinikkloriidi kaks korda iga päev. Patsientidel, kellel selle annuse glükeemiline tase on ebapiisav, võib tiitrida kuni 50 mg sitagliptiini / 1000 mg metformiinvesinikkloriidi kaks korda päevas.
Patsiendid, kellel metformiini monoteraapia ei olnud piisav
Kui ravi sitagliptiini ja metformiini sisaldava kombineeritud tabletiga peetakse sobivaks patsiendil, kelle ravi ainult metformiiniga on ebapiisav, on Janumeti soovitatav algannus peaks andma sitagliptiini annusena 50 mg kaks korda päevas (100 mg ööpäevane koguannus) ja metformiini annus on juba võetud. Patsientidele, kes võtavad 850 mg metformiini kaks korda päevas, on Janumeti soovitatav algannus 50 mg sitagliptiini / 1000 mg metformiinvesinikkloriidi kaks korda päevas.
Patsiendid, kelle sitagliptiini monoteraapia on ebapiisavalt kontrolli all
Kui ravi sitagliptiini ja metformiini sisaldava kombineeritud tabletiga peetakse patsiendi jaoks ebapiisavaks kui seda kontrollitakse ainult sitagliptiini kasutamisel, on Janumeti soovitatav algannus 50 mg sitagliptiini / 500 mg metformiinvesinikkloriidi kaks korda iga päev. Patsiente, kellel selle annuse kontroll on ebapiisav, võib tiitrida kuni 50 mg sitagliptiini / 1000 mg metformiinvesinikkloriidi kaks korda päevas. Patsiente, kes võtavad neerupuudulikkuse tõttu kohandatud sitagliptiini monoteraapiana, ei tohiks üle viia Janumeti kasutamisele [vt Vastunäidustused].
Patsiendid, kes kasutavad sitagliptiini ja metformiini koosmanustamist
Patsientidel, kes vahetavad sitagliptiini koos metformiiniga, võib Janumet'i alustada juba kasutatavate sitagliptiini ja metformiini annustega.
Patsiendid, kellel puudub piisav kontroll kahekordse kombineeritud ravi korral kahe järgneva hüperglükeemilise ainega: sitagliptiin, metformiin või sulfonüüluurea
Kui selles peetakse sobivaks ravi sitagliptiini ja metformiini sisaldava kombineeritud tabletiga Janumet'i tavaline algannus peaks sitagliptiini andma 50 mg kaks korda päevas (kokku 100 mg) päevane annus). Metformiini komponendi algannuse määramisel tuleb arvestada patsiendi glükeemilise kontrolli taset ja metformiini praegust annust (kui see on olemas). Metformiiniga seotud seedetrakti (GI) kõrvaltoimete vähendamiseks tuleks kaaluda annuse järkjärgulist suurendamist. Patsiendid, kes saavad praegu või alustavad sulfonüüluurea kasutamist, võivad hüpoglükeemia riski vähendamiseks vajada väiksemaid sulfonüüluurea annuseid. Hoiatused ja ettevaatusabinõud].
Janumeti ohutuse ja efektiivsuse spetsiaalset uurimist ei ole tehtud patsientide puhul, keda on varem ravitud teiste suukaudsete antihüperglükeemiliste ainetega ja kes on üle läinud Janumeti kasutamisele. Kõiki II tüüpi suhkurtõve ravis tehtavaid muudatusi tuleb teha ettevaatusega ja sobivat jälgimist, kuna võivad muutuda glükeemiline kontroll.
ülaosa
Annustamisvormid ja tugevused
- 50 mg / 500 mg tabletid on heleroosad, kapslikujulised õhukese polümeerikattega tabletid, mille ühele küljele on pressitud "575".
- 50 mg / 1000 mg tabletid on punased, kapslikujulised õhukese polümeerikattega tabletid, mille ühele küljele on pressitud "577".
ülaosa
Vastunäidustused
Janumet (sitagliptiin / metformiin HCl) on vastunäidustatud patsientidele, kellel on:
- Neeruhaigus või neerufunktsiooni häired, näiteks nagu soovitatakse seerumi kreatiniinisisaldusega â ‰ ¥ 1,5 mg / dl [meestel], ‰ mg 1,4 mg / dL [naistel] või ebanormaalsest kreatiniini kliirens, mis võib tuleneda ka sellistest seisunditest nagu südame-veresoonkonna kollaps (šokk), äge müokardiinfarkt ja septitseemia [vaata Hoiatused ja ettevaatusabinõud].
- Äge või krooniline metaboolne atsidoos, sealhulgas diabeetiline ketoatsidoos, koomaga või ilma.
- Anamneesis on esinenud tõsist ülitundlikkusreaktsiooni Janumeti või sitagliptiini (üks Janumeti koostisosi), näiteks anafülaksia või angioödeemi suhtes. [Vaata Hoiatused ja ettevaatusabinõud ja Kõrvaltoimed.]
Patsientidel, kellel tehakse intravaskulaarseid radioloogilisi uuringuid, tuleb Janumet'i kasutamine ajutiselt katkestada jodeeritud kontrastainete manustamist, kuna selliste toodete kasutamine võib põhjustada neerude ägedat muutust funktsioon [vt Hoiatused ja ettevaatusabinõud].
ülaosa
Hoiatused ja ettevaatusabinõud
Piimhappe atsidoos
Metformiinvesinikkloriid
Laktatsidoos on harv, kuid tõsine metaboolne tüsistus, mis võib tekkida metformiini kuhjumise tõttu Janumet-ravi ajal; kui see juhtub, on see surmav umbes 50% juhtudest. Laktatsidoos võib ilmneda ka seoses paljude patofüsioloogiliste seisunditega, sealhulgas suhkurtõvega, ning alati, kui esineb märkimisväärne kudede hüpoperfusioon ja hüpokseemia. Laktatsidoosi iseloomustab kõrgenenud vere laktaaditase (> 5 mmol / L), vere pH langus, elektrolüütide häired suurenenud anioonide vahega ja suurenenud laktaadi / püruvaadi suhe. Kui piimhappe atsidoosi põhjustajaks peetakse metformiini, leitakse tavaliselt metformiini sisaldus plasmas> 5 ¼ μg / ml.
Piimhappe atsidoosi esinemissagedus metformiinvesinikkloriidi saavatel patsientidel on väga madal (umbes 0,03 juhtu / 1000 patsiendiaasta kohta, umbes 0,015 surmaga lõppenud juhtu / 1000 juhtu) patsiendiaastad). Kliinilistes uuringutes metformiiniga kokku puutunud enam kui 20 000 patsiendiaasta jooksul ei olnud piimhappe atsidoosi kohta teateid. Teatatud juhtumid on esinenud peamiselt olulise neerupuudulikkusega diabeediga patsientidel, sealhulgas mõlemad neerupuudulikkus haigus ja neeru hüpoperfusioon, sageli mitmete samaaegsete meditsiiniliste / kirurgiliste probleemide ja mitmete samaaegsete haiguste korral ravimid. Kongestiivse südamepuudulikkusega patsiendid, kes vajavad farmakoloogilist ravi, eriti ebastabiilse või äge kongestiivne südamepuudulikkus, kellel on hüpoperfusiooni ja hüpokseemia oht, suureneb piimhappe risk atsidoos. Laktatsidoosi oht suureneb koos neerufunktsiooni häirete astme ja patsiendi vanusega. Seetõttu võib laktatsidoosi riski oluliselt vähendada metformiini kasutavate patsientide neerufunktsiooni regulaarne jälgimine ja metformiini minimaalse efektiivse annuse kasutamine. Eelkõige peab eakate raviga kaasnema neerufunktsiooni hoolikas jälgimine. Metformiinravi tohib alustada vaid 80-aastastel patsientidel, välja arvatud juhul, kui on mõõdetud kreatiniini kliirens näitab, et neerufunktsioon ei ole vähenenud, kuna need patsiendid on laktatsidoosi tekke suhtes vastuvõtlikumad. Lisaks tuleb metformiini kasutamisest viivitamatult loobuda mis tahes seisundi korral, mis on seotud hüpokseemia, dehüdratsiooni või sepsisega. Kuna kahjustatud maksafunktsioon võib märkimisväärselt piirata laktaadi eraldumise võimet, tuleks maksahaiguse kliiniliste või laboratoorsete nähtudega patsientidel metformiini üldiselt vältida. Metformiini kasutamisel tuleb patsiente hoiatada liigse alkoholitarbimise eest, kas akuutses või kroonilises vormis, kuna alkohol tugevdab metformiinvesinikkloriidi toimet laktaadi metabolismile. Lisaks tuleb metformiin ajutiselt katkestada enne mis tahes intravaskulaarset radiokontrast uuringut ja mis tahes kirurgilist protseduuri [vt Hoiatused ja ettevaatusabinõud].
Laktatsidoosi algus on sageli peen ja sellega kaasnevad ainult mittespetsiifilised sümptomid nagu halb enesetunne, müalgia, hingamishäired, suurenev unisus ja mittespetsiifiline kõhuhäda. Sellega võib kaasneda hüpotermia, hüpotensioon ja resistentsemad bradüarütmiad, millel on märgatavam atsidoos. Patsient ja patsiendi arst peavad olema teadlikud selliste sümptomite võimalikust olulisusest ning patsienti tuleb juhendada, et ta sellest arstile viivitamatult teataks [vt Hoiatused ja ettevaatusabinõud]. Metformiini kasutamine tuleks ära jätta, kuni olukord on selgunud. Kasulikud võivad olla seerumi elektrolüütide, ketoonide, veresuhkru ja vajaduse korral vere pH, laktaaditase ja isegi metformiini tase veres. Kui patsiendi seisund on metformiini mis tahes annuse korral stabiliseerunud, pole seedetrakti sümptomid, mis on ravi alguses tavalised, tõenäoliselt seotud ravimitega. Seedetrakti sümptomite hilisem ilmnemine võib olla tingitud laktatsidoosist või muust tõsisest haigusest.
Paastunud venoosse plasma laktaadi tase üle normi ülemise piiri, kuid alla 5 mmol / l metformiini võtvatel patsientidel ei tähenda tingimata eeldatavat piimhappe sisaldust atsidoos ja võib olla seletatav muude mehhanismidega, näiteks halvasti kontrollitud diabeet või rasvumine, jõuline füüsiline aktiivsus või proovide käsitlemise tehnilised probleemid [vaata Hoiatused ja ettevaatusabinõud].
Laktatsidoosi peaks kahtlustama metaboolset atsidoosi põdevatel diabeediga patsientidel, kellel puuduvad tõendid ketoatsidoosi (ketoonuria ja ketoonemia) kohta.
Laktatsidoos on meditsiiniline hädaolukord, mida tuleb ravida haiglas. Laktatsidoosiga patsiendil, kes võtab metformiini, tuleb ravim kohe katkestada ja viivitamatult rakendada üldisi toetavaid abinõusid. Kuna metformiinvesinikkloriid on dialüüsitav (kliirens hea hemodünaamika korral kuni 170 ml / min haigusseisundid), on atsidoosi korrigeerimiseks ja kuhjumise eemaldamiseks soovitatav kiire hemodialüüs metformiin. Sellise ravi tulemuseks on sageli sümptomite kiire taandumine ja taastumine [vt Vastunäidustused; Hoiatused ja ettevaatusabinõud].
Maksafunktsiooni kahjustus
Kuna maksafunktsiooni kahjustust on seostatud mõne laktatsidoosi juhtumiga, tuleks Janumetit üldiselt vältida maksahaiguse kliiniliste või laboratoorsete nähtude korral.
Neerufunktsiooni hindamine
On teada, et metformiin ja sitagliptiin erituvad peamiselt neerude kaudu. Neerufunktsiooni kahjustuse astmega suureneb metformiini kuhjumise ja laktatsidoosi oht. Seega ei tohiks Janumeti kasutada patsiendid, kelle seerumi kreatiniini tase ületab nende vanuse üle normi ülemise piiri. Eakatel patsientidel tuleb Janumet'i tiitrida hoolikalt, et määrata minimaalse annuse piisav glükeemiline toime, sest vananemine võib olla seotud neerufunktsiooni vähenemisega. [Vaata Hoiatused ja ettevaatusabinõud ja Kasutamine konkreetsetes populatsioonides.]
Enne Janumetiga ravi alustamist ja vähemalt kord aastas pärast seda tuleb neerufunktsiooni kontrollida ja kontrollida normaalsena. Patsientidel, kellel on oodata neerufunktsiooni häireid, eriti eakatel patsientidel, neer kui neerukahjustuse ilmnemisel tuleb Janumet'i kasutamist sagedamini hinnata kohal.
B-vitamiin12 Tasemed
29-nädalase kestusega kontrollitud kliinilistes uuringutes metformiiniga langes seerumi B-vitamiini varem normaalse taseme alla normi12 taset ilma kliiniliste ilminguteta täheldati umbes 7% patsientidest. Selline langus, mis võib olla tingitud häiretest B-ga12 imendumine B-st12- sisemine faktorite kompleks, on väga harva seotud aneemiaga ja näib olevat metformiini või B-vitamiini kasutamise katkestamisel kiiresti pöörduv12 täiendamine. Janumeti kasutavatel patsientidel on soovitatav mõõta hematoloogilisi parameetreid igal aastal ning kõiki ilmseid kõrvalekaldeid tuleks vastavalt uurida ja juhtida. [Vaata Kõrvaltoimed.]
Teatud isikud (need, kellel on ebapiisav B-vitamiin12 või kaltsiumi tarbimine või imendumine) näib olevat eelsoodumus B-vitamiini ebanormaalse arengu tekkeks12 taset. Nendel patsientidel rutiinne seerum B-vitamiini12 kasulikud võivad olla mõõtmised kahe kuni kolme aasta tagant.
Alkoholi tarbimine
Teadaolevalt tugevdab alkohol metformiini mõju laktaadi metabolismile. Seetõttu tuleb Janumeti kasutamise ajal patsiente hoiatada ägeda või kroonilise alkoholitarbimise eest.
Kirurgilised protseduurid
Janumeti kasutamine tuleb ajutiselt katkestada kõigi kirurgiliste protseduuride jaoks (välja arvatud väikesed protseduurid, mis ei ole seotud piiratud tarbimisega toidust ja vedelikest) ning seda ei tohiks uuesti alustada enne, kui patsiendi suukaudne tarbimine on uuesti alanud ja neerufunktsioon on hinnatud normaalne.
Varem kontrollitud 2. tüüpi diabeediga patsientide kliinilise seisundi muutus
II tüübi diabeediga patsient, kes on varem Janumeti abil hästi kontrolli all olnud, kellel tekivad laboratoorsed kõrvalekalded või kliinilised nähud haigust (eriti ebamäärast ja halvasti määratletud haigust) tuleb viivitamatult hinnata ketoatsidoosi või piimhappe esinemise suhtes atsidoos. Hindamine peaks hõlmama seerumi elektrolüütide ja ketoonide, vere glükoosisisalduse ja vajaduse korral vere pH, laktaadi, püruvaadi ja metformiini taset. Mõlemal kujul atsidoosimisel tuleb Janumet viivitamatult lõpetada ja alustada muid asjakohaseid parandusmeetmeid.
Kasutamine koos ravimitega, mis teadaolevalt põhjustavad hüpoglükeemiat
Sitagliptiin
Nagu teiste antihüperglükeemiliste ainete puhul, mida kasutatakse koos sulfonüüluureaga, on tüüpiline, kui sitagliptiini kasutati koos metformiini ja sulfonüüluurea, ravim, mis teadaolevalt põhjustab hüpoglükeemiat, suurenes hüpoglükeemia esinemissagedus platseeboga võrreldes kombinatsioonis metformiini ja sulfonüüluurea [vt Kõrvaltoimed]. Seetõttu võivad ka insuliini sekreteerivat ainet (nt sulfonüüluurea, meglitiniidi) saavad patsiendid vajada hüpoglükeemia riski vähendamiseks väiksemat annust insuliini sekreteerivat ainet [vt Annustamine ja manustamine].
Metformiinvesinikkloriid
Hüpoglükeemiat ei esine patsientidel, kes saavad tavalistes kasutustingimustes ainult metformiini, kuid see võib ilmneda puuduliku kaloraaži korral, kui pingutavat treeningut ei kompenseeri kalorisisalduse lisamine ega samaaegne kasutamine koos teiste glükoosisisaldust langetavate ainetega (näiteks sulfonüüluuread ja insuliin) või etanool. Eakad, nõrgenenud või alatoitunud patsiendid ning neerupealiste või hüpofüüsi puudulikkusega või alkoholimürgitusega patsiendid on eriti vastuvõtlikud hüpoglükeemilisele toimele. Hüpoglükeemiat võib eakatel ja β-adrenergilisi ravimeid tarvitavatel inimestel olla raske ära tunda.
Samaaegsed neerufunktsiooni või metformiini dispositsiooni mõjutavad ravimid
Samaaegsed ravimid, mis võivad mõjutada neerufunktsiooni või põhjustada olulisi hemodünaamilisi muutusi või võivad häirivad metformiini, näiteks katioonsete ravimite, mis elimineeritakse neerutuubulite sekretsiooni kaudu, dispositsiooni [vaata Ravimite koostoimed], tuleb kasutada ettevaatusega.
Radioloogilised uuringud intravaskulaarselt jodeeritud kontrastainetega
Intravaskulaarsed kontrastiuringud jooditud materjalidega (näiteks intravenoosne urogramm, intravenoosne kolangiograafia, angiograafia ja kompuutertomograafia (CT) koos intravaskulaarsete kontrastainetega) võib põhjustada neerufunktsiooni ägedaid muutusi ja metformiini saavatel patsientidel on seda seostatud laktatsidoosiga [vt Vastunäidustused]. Seetõttu tuleks patsientide puhul, kellel on plaanis selline uuring, Janumet'i manustamine ajutiselt katkestada protseduuri järgselt ning seda jätkatakse 48 tundi pärast protseduuri ja taastatakse alles pärast seda, kui neerufunktsiooni on uuesti hinnatud ja leitud ole normaalne.
Hüpoksilised seisundid
Kardiovaskulaarne kollaps (šokk) mis tahes põhjusel, äge kongestiivne südamepuudulikkus, äge müokardiinfarkt ja muid haigusi, mida iseloomustab hüpokseemia, on seostatud laktatsidoosiga ja need võivad põhjustada ka prerenaalset asoteemia. Kui sellised sündmused ilmnevad Janumeti ravi saavatel patsientidel, tuleb ravimi kasutamine kohe lõpetada.
Vere glükoosisisalduse kontrolli kaotamine
Kui ükskõik millise diabeedirežiimi korral stabiliseerunud patsient puutub kokku selliste stressidega nagu palavik, trauma, infektsioon või operatsioon, võib glükeemiline kontroll ajutiselt kaduda. Sellistel aegadel võib osutuda vajalikuks Janumeti kasutamine katkestada ja ajutiselt manustada insuliini. Janumet'i võib uuesti rakendada pärast ägeda episoodi lahenemist.
Ülitundlikkusreaktsioonid
Turustamisjärgselt on teatatud tõsistest ülitundlikkusreaktsioonidest sitagliptiiniga (Janumet'i üks komponent) ravitud patsientidel. Nende reaktsioonide hulka kuuluvad anafülaksia, angioödeem ja eksfoliatiivsed nahahaigused, sealhulgas Stevens-Johnsoni sündroom. Kuna nendest reaktsioonidest teatatakse vabatahtlikult ebakindla suurusega elanikkonnast, siis tavaliselt nende sagedust pole võimalik usaldusväärselt hinnata ega põhjuslikku seost uimastitega kokkupuutumisega kindlaks teha. Need reaktsioonid ilmnesid esimese 3 kuu jooksul pärast sitagliptiinravi alustamist, mõned juhtumid ilmnesid pärast esimest annust. Ülitundlikkusreaktsiooni kahtluse korral katkestage Janumet kasutamine, hinnake sündmuse muid võimalikke põhjuseid ja alustage diabeedi alternatiivset ravi. [Vaata Kõrvaltoimed.]
Makrovaskulaarsed tulemused
Janumeti või mõne muu diabeedivastase ravimiga ei ole kliinilisi uuringuid, mis tõestaksid veenvaid tõendeid makrovaskulaarse riski vähenemise kohta.
ülaosa
Kõrvaltoimed
Kliiniliste uuringute kogemus
Kuna kliinilisi uuringuid viiakse läbi väga erinevates tingimustes, täheldati a Seda ravimit ei saa otseselt võrrelda mõne teise ravimi kliiniliste uuringute määradega ja see ei pruugi kajastada 2006. aastal täheldatud määra harjutama.
Sitagliptiini ja metformiini samaaegne manustamine 2. tüüpi diabeediga patsientidel, kelle toitumine ja treening ei ole piisav
Tabelis 1 on kokku võetud kõige levinumad (¥ ¥) 5% patsientidest) 24 nädala jooksul teatatud kõrvaltoimed (sõltumata uurija hinnangust põhjuslikkusele) platseebo-kontrollitud faktoriaaluuring, milles sitagliptiini ja metformiini manustati samaaegselt II tüüpi diabeediga patsientidele, kelle toitumine oli ebapiisav ja võimlemist.
Tabel 1: Sitagliptiini ja metformiini koosmanustamisel II tüübi diabeediga patsientidele, kelle toitumine ja kehaline koormus on ebapiisavalt kontrollitud: kõrvaltoimed Teatatud (sõltumata uurija hinnangust põhjuslikkuse kohta) 5% -l kombineeritud ravi saavatest patsientidest (ja rohkem kui patsientidel, kes saavad ravi) Platseebo) *
| Patsientide arv (%) | ||||
Platseebo |
Sitagliptiin 100 mg QD |
Metformiin 500 mg / Metformiin 1000 mg kaks korda päevas†|
Sitagliptiin 50 mg kaks korda päevas Metformiin 500 mg / Metformiin 1000 mg kaks korda päevas†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Kõhulahtisus | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Ülemiste hingamisteede infektsioon | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Peavalu | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Sitagliptiini lisateraapia II tüüpi diabeediga patsientidel, kelle ravi metformiiniga üksi ei ole piisav
24-nädalases platseebokontrollitud uuringus, kus sitagliptiini manustati 100 mg üks kord päevas, lisades metformiini kaks korda päevas, ei esinenud Kõrvaltoimed, millest on teatatud sõltumata uurija hinnangust põhjuslikkusele 5% -l patsientidest ja sagedamini kui patsientidel, kellele manustati platseebo. Ravi katkestamine kliiniliste kõrvaltoimete tõttu oli sarnane platseeborühmaga (sitagliptiin ja metformiin, 1,9%; platseebo ja metformiin, 2,5%).
Hüpoglükeemia
Hüpoglükeemia kõrvaltoimed põhinesid kõigil hüpoglükeemia teadetel; samaaegset glükoosimõõtmist ei olnud vaja. Hüpoglükeemia eelnevalt kindlaksmääratud kõrvaltoimete üldine esinemissagedus II tüüpi diabeediga patsientidel, kelle toitumine ja füüsiline koormus ei olnud piisava kontrolli all, oli 0,6% platseebot saanud patsientidel, 0,6% patsientidest, kes said ainult sitagliptiini, 0,8% patsientidest, kes said ainult metformiini, ja 1,6% patsientidest, kellele manustati sitagliptiini kombinatsioonis metformiin. II tüüpi suhkurtõvega patsientidel, kelle ravi ainult metformiiniga on ebapiisav, on kahjulike ravimite üldine esinemissagedus hüpoglükeemia reaktsioonid olid 1,3% patsientidel, kellele lisati sitagliptiini, ja 2,1% patsientidel, kellele manustati lisa platseebo.
Seedetrakti kahjulikud reaktsioonid
Eelnevalt valitud seedetrakti kõrvaltoimete esinemissagedus sitagliptiini ja metformiiniga ravitud patsientidel oli sarnane patsientide puhul, keda raviti ainult metformiiniga. Vt tabel 2.
Tabel 2: Sitagliptiini ja metformiini saanud 2. tüüpi diabeediga patsientidel teatatud eelvalitud seedetrakti kõrvaltoimed (sõltumata uurija hinnangust põhjuslikkusele).
| Patsientide arv (%) | ||||||
| Sitagliptiini ja metformiini uuring ebapiisavalt kontrollitud patsientidel dieedi ja treeningu teemal |
Sitagliptiini lisandi uuring patsientidel, kelle kontroll metformiini üksi ei olnud piisav | |||||
Platseebo |
Sitagliptiin 100 mg QD |
Metformiin 500 mg / Metformiin 1000 mg kaks korda päevas* |
Sitagliptiin 50 mg kaks korda päevas Metformiin 500 mg / Metformiin 1000 mg kaks korda päevas* |
Platseebo ja metformiin â ‰. 1500 mg päevas |
100 mg sitagliptiini QD ja metformiin â ‰. 1500 mg päevas |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Kõhulahtisus | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Iiveldus | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Oksendamine | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Kõhuvalu†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptiin kombinatsioonis metformiini ja glimepiriidiga
24-nädalases platseebokontrollitud uuringus sitagliptiini 100 mg täiendava ravina II tüüpi diabeediga patsientidel, kelle metformiini ja glimepiriidi kontroll oli ebapiisav (sitagliptiin, N = 116; platseebo, N = 113), teatatud kõrvaltoimed, sõltumata uurija hinnangust põhjuslikkusele 5% -l patsientidest sitagliptiiniga ravitud ja sagedamini kui platseeboga ravitud patsientidel olid: hüpoglükeemia (sitagliptiin, 16,4%; platseebo, 0,9%) ja peavalu (6,9%, 2,7%).
Sitagliptiini ja metformiini kombinatsiooni kasutamisel ei täheldatud elutähtsate näitajate ega EKG (sh QTc intervalli) kliiniliselt olulisi muutusi.
Sitagliptiini monoteraapia kõige sagedasem kõrvaltoime, teatatud sõltumata uurijast põhjusliku seose hindamine oli 5% -l patsientidest ja sagedamini kui platseebot saanud patsientidel nasofarüngiit.
Kõige tavalisemad (> 5%) metformiinravi alustamisega seotud kõrvaltoimed on kõhulahtisus, iiveldus / oksendamine, puhitus, ebamugavustunne kõhus, seedehäired, asteenia ja peavalu.
Laborikatsed
Sitagliptiin
Laboratoorsete kõrvaltoimete esinemissagedus oli sarnane sitagliptiini ja metformiiniga ravitud patsientidel (7,6%) võrreldes platseebo ja metformiiniga ravitud patsientidega (8,7%). Enamikus, kuid mitte kõigis uuringutes on valgevereliblede arvu väike suurenemine (WBC erinevus umbes 200 rakku / mikroliitris vs platseebo; täheldati neutrofiilide väikese suurenemise tõttu keskmist algväärtust WBC (umbes 6600 rakku / mikroliitri kohta). Seda laboratoorsete parameetrite muutust ei peeta kliiniliselt oluliseks.
Metformiinvesinikkloriid
29-nädalase kestusega kontrollitud kliinilistes uuringutes metformiiniga langes seerumi B-vitamiini varem normaalse taseme alla normi12 taset ilma kliiniliste ilminguteta täheldati umbes 7% patsientidest. Selline langus, mis võib olla tingitud häiretest B-ga12 imendumine B-st12- sisemine faktorite kompleks, on väga harva seotud aneemiaga ja näib olevat metformiini või B-vitamiini kasutamise katkestamisel kiiresti pöörduv12 täiendamine. [Vaata Hoiatused ja ettevaatusabinõud.]
Turundusjärgne kogemus
Janumeti või Janitati ühe koostisosa sitagliptiini kasutamise järgsel kasutamisel on tuvastatud järgmised täiendavad kõrvaltoimed. Kuna nendest reaktsioonidest teatatakse vabatahtlikult ebakindla suurusega elanikkonnast, siis tavaliselt nende sagedust pole võimalik usaldusväärselt hinnata ega põhjuslikku seost uimastitega kokkupuutumisega kindlaks teha.
Ülitundlikkusreaktsioonide hulka kuuluvad anafülaksia, angioödeem, lööve, urtikaaria, naha vaskuliit ja eksfoliatiivsed nahahaigused, sealhulgas Stevens-Johnsoni sündroom [vt Hoiatused ja ettevaatusabinõud]; ülemiste hingamisteede infektsioon; maksaensüümide aktiivsuse tõus; pankreatiit.
ülaosa
Ravimite koostoimed
Katioonsed ravimid
Katioonsed ravimid (nt amiloriid, digoksiin, morfiin, prokaiinamiid, kinidiin, kiniin, ranitidiin, triamtereen, trimetoprim või vankomütsiin), mis on Neerutuubulite sekretsiooni kaudu elimineerituna on teoreetiliselt võimalik koostoime metformiiniga konkureerides ühises neerutuubulites süsteemid. Sellist koostoimet metformiini ja suukaudse tsimetidiini vahel on täheldatud tervetel tervetel vabatahtlikel nii metformiini-tsimetidiini ühe- kui ka mitmeannuselistes vabatahtlikes. ravimite koostoime uuringud, metformiini maksimaalse plasmakontsentratsiooni ja täisvere kontsentratsiooni tõus 60% ning plasma ja täisvere metformiini kontsentratsiooni tõus 40% AUC. Ühekordse annuse uuringus eliminatsiooni poolväärtusaeg ei muutunud. Metformiin ei mõjutanud tsimetidiini farmakokineetikat. Ehkki sellised koostoimed on endiselt teoreetilised (välja arvatud tsimetidiin), tuleb Janumet'i ja / või segavat ravimit soovitatakse patsientidele, kes võtavad katioonseid ravimeid, mis erituvad proksimaalse neerutuubulite kaudu süsteem.
Digoksiin
Kõvera alune pindala (AUC, 11%) ja ravimi keskmine kontsentratsioon (C) suurenesid pisutmax, 18%) digoksiini koos 100 mg sitagliptiini samaaegse manustamisega 10 päeva jooksul. Sellist suurenemist ei peeta tõenäoliselt kliiniliselt oluliseks. Digoksiin kui katioonne ravim võib konkureerida metformiiniga tavalistes neerutuubulites transpordisüsteemides, mõjutades seeläbi kas digoksiini, metformiini või mõlema kontsentratsiooni seerumis. Digoksiini saavaid patsiente tuleb vastavalt jälgida. Digoksiini või Janumeti annust ei soovitata muuta.
Glüburiid
Üheannuselises koostoimeuuringus II tüüpi diabeediga patsientidel ei põhjustanud metformiini ja glüburiidi koosmanustamine metformiini farmakokineetika ega farmakodünaamika muutusi. Glüburiidi AUC ja C langusmax täheldati, kuid olid väga varieeruvad. Selle uuringu üheannuseline olemus ning korrelatsiooni puudumine glüburiidi sisalduse ja farmakodünaamilise toime vahel veres muudavad selle koostoime kliinilise tähtsuse ebakindlaks.
Furosemiid
Tervetel inimestel läbi viidud üheannuselises metformiini-furosemiidi ravimite koostoimeuuring näitas, et koosmanustamine mõjutas mõlema ühendi farmakokineetilisi parameetreid. Furosemiid suurendas metformiini plasma ja vere C tasetmax 22% ja vere AUC 15%, ilma metformiini renaalse kliirensi oluliste muutusteta. Metformiiniga koosmanustamisel põhjustab Cmax furosemiidi AUC ja AUC olid vastavalt 31% ja 12% väiksemad kui eraldi manustamisel ja terminaalne poolväärtusaeg lühenes 32%, ilma furosemiidi neerudes olulisi muutusi muutmata kliirens. Metformiini ja furosemiidi koostoime kohta kroonilisel koosmanustamisel teave puudub.
Nifedipiin
Ühekordse annuse metformiin-nifedipiini ravimite koostoime uuring normaalsete tervete vabatahtlikega näitas, et nifedipiini koosmanustamine suurendas metformiini Cmax ja AUC vastavalt 20% ja 9% ning suurendasid uriiniga eritunud kogust. Tmax ja poolväärtusaeg ei muutunud. Näib, et nifedipiin suurendab metformiini imendumist. Metformiinil oli nifedipiinile minimaalne toime.
Metformiini kasutamine koos teiste ravimitega
Teatud ravimid põhjustavad tavaliselt hüperglükeemiat ja võivad viia glükeemilise kontrolli kaotamiseni. Nende ravimite hulka kuuluvad tiasiidid ja muud diureetikumid, kortikosteroidid, fenotiasiinid, kilpnäärme tooted, östrogeenid, suukaudsed kontratseptiivid, fenütoiin, nikotiinhape, sümpatomimeetikumid, kaltsiumikanalit blokeerivad ravimid ja isoniasiid. Kui selliseid ravimeid manustatakse Janumeti saavale patsiendile, tuleb patsienti hoolikalt jälgida, et säilitada piisav glükeemiline kontroll.
Tervetel vabatahtlikel ei mõjutanud metformiini ja propranolooli ning metformiini ja ibuprofeeni farmakokineetikat koosmanustamisel üheannuselistes koostoimeuuringutes.
Metformiin seostub plasmavalkudega ebaoluliselt ja seetõttu on vähem tõenäoline, et nad interakteeruvad tugevalt valkudega seotud ravimitega, näiteks salitsülaadid, sulfoonamiidid, klooramfenikool ja probenetsiid, võrreldes sulfonüülkarbamiididega, mis on ulatuslikult seotud seerumiga valgud.
ülaosa
Kasutamine konkreetsetes populatsioonides
Rasedus
B-kategooria rasedus:
Janumet
Janumeti või selle üksikute komponentide kohta rasedatel ei ole piisavalt ja hästi kontrollitud uuringuid; seetõttu ei ole Janumeti ohutus rasedatele teada. Janumeti tohib raseduse ajal kasutada ainult juhul, kui see on selgelt vajalik.
Merck & Co., Inc. peab registrit, et jälgida Janumetiga raseduse ajal kokku puutunud naiste raseduse tulemusi. Tervishoiuteenuse osutajaid julgustatakse teatama kõigist sünnieelsetest kokkupuudetest Janumetiga, helistades rasedusregistrisse telefonil (800) 986-8999.
Janumetis ei ole kombineeritud ravimitega loomkatseid tehtud, et hinnata mõju paljunemisele. Järgnevad andmed põhinevad sitagliptiini või metformiiniga eraldi läbi viidud uuringute tulemustel.
Sitagliptiin
Reproduktsiooniuuringud on läbi viidud rottide ja küülikutega. Sitagliptiini annused kuni 125 mg / kg (umbes 12-kordne inimese ekspositsioon inimese maksimaalse soovitatava annuse korral) ei kahjustanud viljakust ega lootele kahjulikku. Sitagliptiiniga rasedatel ei ole aga piisavaid ja hästi kontrollitud uuringuid.
Tiinetele emastele rottidele ja küülikutele 6. kuni 20. raseduspäevani (organogenees) manustatud sitagliptiin ei olnud teratogeenne suukaudsetes annustes kuni 250 mg / kg (rotid) ja 125 mg / kg (küülikud) või umbes 30 ja 20-kordne kokkupuude inimesega inimesele lubatud maksimaalse annuse (MRHD) korral 100 mg / päevas, lähtudes AUC-st võrdlused. Suuremad annused suurendasid järglastel ribi väärarengute esinemissagedust annuses 1000 mg / kg ehk umbes 100-kordne inimese kokkupuude MRHD-ga.
Emastele rottidele manustatud sitagliptiin alates 6. raseduspäevast kuni 21. imetamispäevani vähendas isaste ja emaste järglaste kehakaalu annuses 1000 mg / kg. Rottide järglastel ei täheldatud funktsionaalset ega käitumuslikku toksilisust.
Tiinetele rottidele manustatud sitagliptiini platsentaarne ülekandumine oli umbes 45% 2 tunni möödudes ja 80% 24 tunni möödudes pärast manustamist. Tiinetele küülikutele manustatud sitagliptiini platsentaarne ülekandumine oli umbes 66% 2 tunni möödudes ja 30% 24 tunni möödudes.
Metformiinvesinikkloriid
Annused kuni 600 mg / kg / päevas ei olnud metformiin rottidel ja küülikutel teratogeensed. See näitab kokkupuudet, mis on vastavalt inimese maksimaalsele soovitatavale 2000 mg annusele 2–2 ja 6-kordne, vastavalt rottide ja küülikute kehapindalade võrdlusel. Loote kontsentratsiooni määramine näitas metformiini osalist platsentaarbarjääri.
Imetavad emad
Janumeti kombineeritud komponentidega ei ole imetavate loomadega uuringuid läbi viidud. Üksikute komponentidega tehtud uuringutes erituvad nii sitagliptiin kui ka metformiin imetavate rottide piima. Ei ole teada, kas sitagliptiin eritub inimese rinnapiima. Kuna paljud ravimid erituvad inimese rinnapiima, tuleb Janumeti manustamisel imetavale naisele olla ettevaatlik.
Kasutamine lastel
Janumeti ohutus ja efektiivsus alla 18-aastastel lastel ei ole tõestatud.
Geriaatriline kasutamine
Janumet
Kuna sitagliptiin ja metformiin erituvad olulisel määral neerude kaudu ja kuna vananemist võib seostada neerufunktsiooni vähenemisega, tuleb Janumet'i kasutada vanuse suurenedes ettevaatusega. Annuse valimisel tuleb olla ettevaatlik ning see peaks põhinema neerufunktsiooni hoolikal ja regulaarsel jälgimisel. [Vaata Hoiatused ja ettevaatusabinõud; Kliiniline farmakoloogia.]
Sitagliptiin
Sitagliptiini II ja III faasi kliinilistes uuringutes osalenud patsientide koguarvust (N = 3884) oli 725 patsienti 65-aastased ja vanemad, samas kui 61 patsienti olid 75-aastased ja vanemad. 65-aastaste ja vanemate ning nooremate katsealuste vahel ei täheldatud üldisi erinevusi ohutuses ega efektiivsuses. Kuigi see ja muu kliiniline kogemus ei ole vastustes erinevusi tuvastanud eakate ja nooremate patsientide vahel ei saa mõnede vanemate inimeste suurem tundlikkus olla välistatud.
Metformiinvesinikkloriid
Metformiini kontrollitud kliinilised uuringud ei hõlmanud piisavalt palju eakaid patsiente, et teha kindlaks, kas nad reageerivad erinevalt nooremate patsientide hulgast, ehkki muude kliiniliste kogemuste põhjal ei ole eakate ja noorte ravivastuses erinevusi tuvastatud patsiendid. Metformiini tohib kasutada ainult normaalse neerufunktsiooniga patsientidel. Metformiini algannus ja säilitusannus peaksid vanemas eas patsientide puhul olema konservatiivsed, kuna neerufunktsioon võib selles populatsioonis halveneda. Annuse kohandamine peaks põhinema neerufunktsiooni hoolikal hindamisel. [Vaata Vastunäidustused; Hoiatused ja ettevaatusabinõud; ja Kliiniline farmakoloogia.]
ülaosa
Üleannustamine
Sitagliptiin
Tervete isikutega kontrollitud kliiniliste uuringute käigus manustati sitagliptiini ühekordsetes annustes kuni 800 mg. Ühes uuringus täheldati sitagliptiini annuses 800 mg QTc maksimaalset keskmist tõusu 8,0 ms, see on keskmine toime, mida ei peeta kliiniliselt oluliseks [vt Kliiniline farmakoloogia]. Üle 800 mg annuste kasutamisel inimestel kogemused puuduvad. I faasi mitmeannuselistes uuringutes ei täheldatud sitagliptiini kasutamisel annuses kuni 400 mg päevas kuni 28-päevase perioodi jooksul annusest sõltuvaid kliinilisi kõrvaltoimeid.
Üleannustamise korral on mõistlik kasutada tavalisi toetavaid abinõusid, näiteks eemaldada imendumata materjal seedetraktist. viige läbi kliiniline jälgimine (sealhulgas elektrokardiogrammi saamine) ja alustage toetavat ravi vastavalt patsiendi kliinilisele näidule staatus.
Sitagliptiin on tagasihoidlikult dialüüsitav. Kliinilistes uuringutes eemaldati 3–4-tunnise hemodialüüsi käigus umbes 13,5% annusest. Kui see on kliiniliselt sobiv, võib kaaluda pikaajalist hemodialüüsi. Ei ole teada, kas sitagliptiin on peritoneaaldialüüsi abil dialüüsitav.
Metformiinvesinikkloriid
On esinenud metformiinvesinikkloriidi üleannustamist, sealhulgas alla 50-grammiste koguste allaneelamise korral. Hüpoglükeemiat esines umbes 10% juhtudest, kuid põhjuslikku seost metformiinvesinikkloriidiga ei ole kindlaks tehtud. Laktatsidoosi on teatatud umbes 32% -l metformiini üleannustamise juhtudest [vt Hoiatused ja ettevaatusabinõud]. Metformiin on dialüüsitav heade hemodünaamiliste tingimuste korral kliirensiga kuni 170 ml / min. Seetõttu võib hemodialüüs olla kasulik akumuleerunud ravimi eemaldamiseks patsientidelt, kellel kahtlustatakse metformiini üleannustamist.
ülaosa
Kirjeldus
Janumeti (sitagliptiin / metformiin HCl) tabletid sisaldavad kahte suukaudset antihüperglükeemilist ravimit, mida kasutatakse II tüüpi diabeedi ravis: sitagliptiini ja metformiinvesinikkloriidi.
Sitagliptiin
Sitagliptiin on dipeptidüülpeptidaas-4 (DPP-4) ensüümi suukaudselt aktiivne inhibiitor. Sitagliptiin on Janumeti tablettides sitagliptiinfosfaatmonohüdraadi vormis. Sitagliptiinfosfaatmonohüdraati kirjeldatakse keemiliselt 7 - [(3R) - 3-amino-1-okso-4 - (2,4,5 - trifluorofenüül) butüül] - 5,6,7,8 - tetrahüdro-3 - (trifluorometüül) - 1,2,4 - triasolo [4,3-a] pürasiini fosfaadi (1: 1) monohüdraat empiirilise valemiga C16H15F6N5O-H3PO4-H2O ja molekulmass 523,32. Struktuurivalem on järgmine:
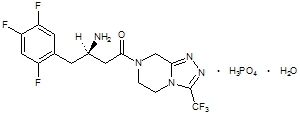
Sitagliptiinfosfaatmonohüdraat on valge kuni valkjas kristalne kristalne mittehügroskoopne pulber. See lahustub vees ja N, N-dimetüülformamiidis; vähe lahustub metanoolis; etanoolis, atsetoonis ja atsetonitriilis lahustub väga vähe; ja ei lahustu isopropanoolis ja isopropüülatsetaadis.
Metformiinvesinikkloriid
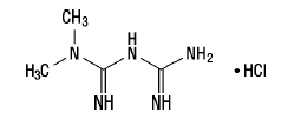
Metformiinvesinikkloriid (N, N-dimetüülimidodikarbonimidiiddiamiidvesinikkloriid) ei ole keemiliselt ega farmakoloogiliselt seotud ühegi teise suukaudsete antihüperglükeemiliste ainete klassiga. Metformiinvesinikkloriid on valge kuni valkjas kristalne ühend, mille molekulvalem on C4H11N5-HCl ja molekulmass 165,63. Metformiinvesinikkloriid on vees hästi lahustuv ning atsetoonis, eetris ja kloroformis praktiliselt lahustumatu. PKa metformiini väärtus on 12,4. Metformiinvesinikkloriidi 1% vesilahuse pH on 6,68. Struktuurivalem on järgmine:
Janumet
Janumet on saadaval suukaudseks manustamiseks tablettidena, mis sisaldavad 64,25 mg sitagliptiinfosfaatmonohüdraati ja metformiinvesinikkloriidi ekvivalenti kuni: 50 mg sitagliptiini vaba alusena ja 500 mg metformiinvesinikkloriidi (Janumet 50 mg / 500 mg) või 1000 mg metformiinvesinikkloriidi (Janumet 50 mg / 1000) mg). Iga Janumeti õhukese polümeerikattega tablett sisaldab järgmisi mitteaktiivseid koostisosi: mikrokristalne tselluloos, polüvinüülpürrolidoon, naatriumlaurüülsulfaat ja naatriumstearüülfumaraat. Lisaks sisaldab kilekate järgmisi mitteaktiivseid koostisosi: polüvinüülalkohol, polüetüleenglükool, talk, titaandioksiid, punane raudoksiid ja must raudoksiid.
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Janumet
Janumet ühendab kaks hüperglükeemilist ainet täiendava toimemehhanismiga, et parandada glükeemilise kontrolli paranemist II tüüpi diabeet: sitagliptiin, dipeptidüülpeptidaas-4 (DPP-4) inhibiitor ja metformiinvesinikkloriid, biguaniidi liige klass.
Sitagliptiin
Sitagliptiin on DPP-4 inhibiitor, mis arvatavasti avaldab oma toimet II tüüpi diabeediga patsientidele, aeglustades inkretiinhormoonide inaktiveerimist. Sitagliptiin suurendab aktiivsete intaktsete hormoonide kontsentratsiooni, suurendades ja pikendades nende hormoonide toimet. Inkretiinhormoonid, sealhulgas glükagoonilaadne peptiid-1 (GLP-1) ja glükoosist sõltuv insulinotroopne polüpeptiidi (GIP), vabastatakse soolestikust kogu päeva jooksul ja selle tase tõuseb vastuseks sööki. Ensüüm DPP-4 inaktiveerib need hormoonid kiiresti. Inkretiinid on osa endogeensest süsteemist, mis osaleb glükoosi homöostaasi füsioloogilises regulatsioonis. Kui vere glükoosikontsentratsioon on normaalne või kõrgenenud, suurendavad GLP-1 ja GIP insuliini sünteesi ja pankrease beetarakkudest vabanemist rakusiseste signaaliradade kaudu, mis hõlmavad tsüklilist AMP. Samuti vähendab GLP-1 glükagooni sekretsiooni pankrease alfarakkudest, põhjustades maksa glükoositootmise vähenemist. Suurendades ja pikendades aktiivset inkretiini taset, suurendab sitagliptiin insuliini vabanemist ja vähendab glükagooni taset vereringes glükoosist sõltuval viisil. Sitagliptiin demonstreerib selektiivsust DPP-4 suhtes ega inhibeeri DPP-8 ega DPP-9 aktiivsust in vitro kontsentratsioonidel, mis lähenevad terapeutiliste annuste kontsentratsioonidele.
Metformiinvesinikkloriid
Metformiin on hüperglükeemiline aine, mis parandab glükoositaluvust II tüüpi diabeediga patsientidel, alandades nii basaalset kui ka söögijärgset vere glükoosisisaldust. Selle farmakoloogilised toimemehhanismid erinevad teistest suukaudsete antihüperglükeemiliste ainete klassidest. Metformiin vähendab maksa glükoositootmist, vähendab glükoosi imendumist soolestikus ja parandab insuliini tundlikkust, suurendades perifeerse glükoosi omastamist ja kasutamist. Erinevalt sulfonüülkarbamiididest ei põhjusta metformiin hüpoglükeemiat II tüüpi diabeediga patsientidel ega normaalsetel isikutel (välja arvatud erijuhtudel [vt Hoiatused ja ettevaatusabinõud]) ja ei põhjusta hüperinsulinemiat. Metformiinravi korral jääb insuliini sekretsioon muutumatuks, samal ajal kui tühja kõhuga insuliini tase ja ööpäevane plasmainsuliini vastus võivad tegelikult väheneda.
12.2 Farmakodünaamika
Sitagliptiin
Üldine
II tüüpi diabeediga patsientidel pärssis sitagliptiini manustamine DPP-4 ensüümi aktiivsust 24 tunni jooksul. Pärast suukaudset glükoosisisaldust või sööki põhjustas see DPP-4 pärssimine aktiivse GLP-1 ja GIP sisalduse ringluses 2–3-kordselt, vähenenud glükagooni kontsentratsioon ja suurenenud reageerimine insuliini vabastamisele glükoosile, mille tulemuseks on kõrgem C-peptiid ja insuliin kontsentratsioonid. Insuliini tõusu koos glükagooni vähenemisega seostati madalama tühja kõhu glükoosikontsentratsiooni ja vähenenud glükoosiekskursiooniga pärast suukaudset glükoosisisaldust või sööki.
Sitagliptiini ja metformiinvesinikkloriidi samaaegne manustamine
Kahepäevases tervete isikutega tehtud uuringus tõstis sitagliptiin üksi aktiivse GLP-1 kontsentratsiooni, samas kui metformiin üksi suurendas aktiivse ja üldise GLP-1 kontsentratsiooni sama ulatuseni. Sitagliptiini ja metformiini koosmanustamisel oli aditiivne toime aktiivse GLP-1 kontsentratsioonile. Sitagliptiin, kuid mitte metformiin, suurendas aktiivse GIP kontsentratsiooni. On ebaselge, mida need leiud tähendavad glükeemilise kontrolli muutuste suhtes II tüüpi diabeediga patsientidel.
Tervete inimestega läbiviidud uuringutes ei vähendanud sitagliptiin veresuhkru taset ega põhjustanud hüpoglükeemiat.
Südame elektrofüsioloogia
Randomiseeritud, platseebokontrollitud ristumisuuringus manustati 79 tervele katsealusele ühekordse suukaudse annusena sitagliptiini 100 mg, sitagliptiini 800 mg (8-kordne soovitatav annus) ja platseebot. Soovitatava 100 mg annuse kasutamisel ei olnud plasma maksimaalse kontsentratsiooni korral või muul ajal uuringu ajal QTc-intervallile mingit mõju. Pärast 800 mg annust oli platseebo korrigeeritud QTc keskmise muutuse maksimaalne suurenemine algtasemest 3 tundi pärast manustamist 8,0 ms. Seda suurenemist ei peeta kliiniliselt oluliseks. 800 mg annuse kasutamisel olid sitagliptiini maksimaalsed plasmakontsentratsioonid umbes 11 korda kõrgemad kui 100 mg annuse järgsed maksimaalsed kontsentratsioonid.
II tüüpi diabeediga patsientidel, kellele manustati sitagliptiini 100 mg (N = 81) või sitagliptiini 200 mg (N = 63) päevas, eeldatava plasma maksimumi ajal saadud EKG andmete põhjal ei olnud QTc-intervallis olulisi muutusi kontsentratsioon.
Farmakokineetika
Janumet
Tervetel isikutel tehtud bioekvivalentsuse uuringu tulemused näitasid, et Janumet (sitagliptiin / metformin HCl) 50 mg / 500 mg ja 50 mg / 1000 mg kombinatsioonitabletid on bioekvivalentsed sitagliptiini vastavate annuste samaaegse manustamisega (JANUVIA™2) ja metformiinvesinikkloriidi üksikute tablettidena.
Imendumine
Sitagliptiin
Sitagliptiini absoluutne biosaadavus on umbes 87%. Suure rasvasisaldusega eine ja sitagliptiini samaaegne manustamine ei mõjutanud sitagliptiini farmakokineetikat.
Metformiinvesinikkloriid
Paastuolude korral manustatud metformiinvesinikkloriidi 500 mg tableti absoluutne biosaadavus on umbes 50–60%. Uuringud, milles kasutati metformiinvesinikkloriidi tablettide ühekordseid suukaudseid annuseid 500 mg kuni 1500 mg ja 850 mg kuni 2550 mg, näitasid, et annuste proportsionaalsuse puudumine suurenevate annustega, mis on tingitud pigem vähenenud imendumisest kui eliminatsiooni muutumisest. Toit vähendab metformiini imendumise ulatust ja pisut edasi, seda näitab umbes 40% madalama keskmise maksimaalse plasmakontsentratsiooni (Cmax), plasmakontsentratsiooni kõvera (AUC) alune pindala 25% madalam ja maksimaalse plasmakontsentratsiooni (Tmax) pärast ühe 850 mg metformiini tableti manustamist koos toiduga, võrreldes sama tableti tugevusega tühja kõhuga. Nende languste kliiniline tähtsus pole teada.
Levitamine
Sitagliptiin
Pärast sitagliptiini ühekordse 100 mg intravenoosse annuse manustamist tervetele isikutele on tasakaalukontsentratsiooni korral keskmine jaotusruumala umbes 198 liitrit. Plasmavalkudega pöörduvalt sitagliptiini osa on väike (38%).
Metformiinvesinikkloriid
Pärast 850 mg metformiinvesinikkloriidi tablettide ühekordse suukaudse annuse manustamist oli metformiini jaotusruumala (V / F) keskmiselt 654 ± 358 L. Metformiin on seondunud plasmavalkudega ebaoluliselt, vastupidiselt sulfonüüluureatele, mille valkudega on seotud enam kui 90%. Metformiin jaotub erütrotsüütideks, tõenäoliselt sõltuvalt ajast. Metformiinvesinikkloriidi tablettide tavapäraste kliiniliste annuste ja annustamisskeemide korral saavutatakse metformiini püsikontsentratsioon plasmas 24–48 tunni jooksul ja on tavaliselt
Ainevahetus
Sitagliptiin
Ligikaudu 79% sitagliptiinist eritub muutumatul kujul uriiniga, metabolismi eliminatsiooni tee on väike.
Pärast [14C] sitagliptiini suukaudne annus, umbes 16% radioaktiivsusest eritus sitagliptiini metaboliitidena. Jäljetasemel tuvastati kuus metaboliiti ja arvatakse, et need ei aita kaasa sitagliptiini plasma DPP-4 inhibeerivale toimele. In vitro uuringud näitasid, et sitagliptiini piiratud metabolismi eest vastutav peamine ensüüm oli CYP3A4 ja CYP2C8.
Metformiinvesinikkloriid
Intravenoossed üheannuselised uuringud normaalsetel isikutel näitasid, et metformiin eritub muutumatul kujul uriiniga ja ei toimu maksa metabolismi (inimestel ei ole metaboliite tuvastatud) ega sapiteede kaudu eritumine.
Eritumine
Sitagliptiin
Pärast suu kaudu manustamist14C] sitagliptiini annusest elimineerus tervetel isikutel ühe nädala jooksul pärast manustamist umbes 100% manustatud radioaktiivsusest roojaga (13%) või uriinis (87%). Näiline terminal t1/2 pärast sitagliptiini 100 mg suukaudse annuse manustamist oli umbes 12,4 tundi ja neerukliirens oli umbes 350 ml / min.
Sitagliptiin elimineeritakse peamiselt neerude kaudu ja hõlmab aktiivset tubulaarsekretsiooni. Sitagliptiin on inimese orgaaniliste anioonide transporteri-3 (hOAT-3) substraat, mis võib olla seotud sitagliptiini renaalse elimineerimisega. HOAT-3 kliiniline tähtsus sitagliptiini transportimisel ei ole tõestatud. Sitagliptiin on ka p-glükoproteiini substraat, mis võib olla seotud ka sitagliptiini renaalse eliminatsiooni vahendamisega. P-glükoproteiini inhibiitor tsüklosporiin ei vähendanud aga sitagliptiini renaalset kliirensit.
Metformiinvesinikkloriid
Neerude kliirens on umbes 3,5 korda suurem kui kreatiniini kliirens, mis näitab, et tubulaarsekretsioon on metformiini peamine eritumise viis. Pärast suukaudset manustamist elimineeritakse umbes 24% imendunud ravimist neerude kaudu esimese 24 tunni jooksul, plasma eliminatsiooni poolväärtusaeg on umbes 6,2 tundi. Veres on eliminatsiooni poolväärtusaeg umbes 17,6 tundi, mis viitab sellele, et erütrotsüütide mass võib olla jaotusruum.
Eripopulatsioonid
Neerupuudulikkus
Janumet
Janumeti ei tohi kasutada neerupuudulikkusega patsientidel [vt Vastunäidustused; Hoiatused ja ettevaatusabinõud].
Sitagliptiin
Mõõduka neerupuudulikkusega patsientidel täheldati sitagliptiini plasma AUC umbes 2-kordset suurenemist ja umbes 4-kordset raske neerupuudulikkusega patsientide, sealhulgas hemodialüüsi saavate ESRD-ga patsientide arvu suurenemist, võrreldes normaalse tervisliku kontrolliga katsealused.
Metformiinvesinikkloriid
Vähenenud neerufunktsiooniga patsientidel (mõõdetud kreatiniini kliirensi alusel) poolväärtusaeg plasmas ja veres metformiini sisaldus pikeneb ja neerukliirens väheneb proportsionaalselt kreatiniini langusega kliirens.
Maksapuudulikkus
Sitagliptiin
Mõõduka maksapuudulikkusega patsientidel (Child-Pugh skoor 7–9) on keskmine AUC ja Cmax Pärast sitagliptiini ühekordse 100 mg annuse manustamist suurenes sitagliptiini sisaldus vastavalt umbes 21% ja 13% võrreldes tervete kontrollitud kontrollidega. Neid erinevusi ei peeta kliiniliselt olulisteks.
Raske maksapuudulikkusega (Child-Pugh skoor> 9) patsientide kohta kliiniline kogemus puudub.
Metformiinvesinikkloriid
Maksapuudulikkusega patsientidel ei ole metformiini farmakokineetilisi uuringuid läbi viidud.
Sugu
Sitagliptiin
Suguel ei olnud komposiidil põhineva sitagliptiini farmakokineetikale kliiniliselt olulist mõju I faasi farmakokineetiliste andmete analüüs ning I ja II faasi populatsiooni farmakokineetiline analüüs andmed.
Metformiinvesinikkloriid
Soolise analüüsi järgi ei erinenud metformiini farmakokineetilised parameetrid normaalsetel ja II tüüpi diabeediga patsientidel oluliselt. Sarnaselt oli II tüüpi diabeediga patsientide kontrollitud kliinilistes uuringutes metformiini hüperglükeemiline toime meestel ja naistel võrreldav.
Geriaatriline
Sitagliptiin
Kui arvestada vanuse mõju neerufunktsioonile, siis vanusel üksi kliiniliselt ei olnud populatsiooni farmakokineetikal põhinev oluline mõju sitagliptiini farmakokineetikale analüüs. Eakatel (65 kuni 80-aastastel) oli sitagliptiini plasmakontsentratsioon umbes 19% suurem kui noorematel.
Metformiinvesinikkloriid
Tervete eakate katsealuste metformiini kontrollitud farmakokineetiliste uuringute piiratud andmed näitavad, et metformiini üldine plasmakliirens on vähenenud, poolväärtusaeg pikeneb ja Cmax on võrreldes tervete noorte katsealustega suurenenud. Nendest andmetest selgub, et metformiini farmakokineetika muutused vananemisega tulenevad peamiselt muutustest neerufunktsioonis (vt GLUKOFIA)3 teave retseptide kohta: KLIINILINE FARMAKOLOOGIA, Eripopulatsioonid, geriaatria).
Janumet-ravi ei tohiks alustada 80-aastastel patsientidel, välja arvatud juhul, kui kreatiniini kliirensi mõõtmine näitab, et neerufunktsioon ei ole vähenenud [vt Hoiatused ja ettevaatusabinõud].
Pediaatriline
Janumetiga ei ole lastel uuringuid läbi viidud.
Rass
Sitagliptiin
Rassil ei olnud liitanalüüsi põhjal kliiniliselt olulist mõju sitagliptiini farmakokineetikale olemasolevate farmakokineetiliste andmete, sealhulgas valge, hispaanlase, musta, aasia ja muu rassi esindajate kohta rühmad.
Metformiinvesinikkloriid
Rassi alusel metformiini farmakokineetiliste parameetrite uuringuid ei ole läbi viidud. Metformiini kontrollitud kliinilistes uuringutes II tüüpi diabeediga patsientidel oli hüperglükeemiline toime võrreldav valgetel (n = 249), mustadel (n = 51) ja hispaanlastel (n = 24).
Kehamassiindeks (KMI)
Sitagliptiin
Kehamassiindeksil ei olnud komposiidil põhineva sitagliptiini farmakokineetikale kliiniliselt olulist mõju I faasi farmakokineetiliste andmete analüüs ning I ja II faasi populatsiooni farmakokineetiline analüüs andmed.
Ravimite koostoimed
Sitagliptiin ja metformiinvesinikkloriid
Kaks korda päevas manustatud sitagliptiini (50 mg) ja metformiini (1000 mg) korduvate annuste manustamine oli sama ei muuda oluliselt sitagliptiini ega metformiini farmakokineetikat II tüüpi patsientidel diabeet.
Janumetiga ei ole farmakokineetilisi koostoimeuuringuid läbi viidud; sellised uuringud on siiski läbi viidud Janumeti üksikute komponentidega (sitagliptiin ja metformiinvesinikkloriid).
Sitagliptiin
Ravimi koostoime in vitro hindamine
Sitagliptiin ei ole CYP isosüümide CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 või 2B6 inhibiitor ega CYP3A4 indutseerija. Sitagliptiin on p-glükoproteiini substraat, kuid ei inhibeeri digoksiini p-glükoproteiini vahendatud transporti. Nendele tulemustele tuginedes arvatakse, et sitagliptiin ei põhjusta koostoimeid teiste ravimitega, mis neid teid kasutavad.
Sitagliptiin ei ole ulatuslikult seotud plasmavalkudega. Seetõttu on sitagliptiini kalduvus osaleda kliiniliselt olulistes ravimite ja ravimite koostoimetes, mida vahendab plasmavalkudega seondumise nihkumine, väga madal.
Ravimi koostoime hindamine in vivo
Sitagliptiini toime teistele ravimitele
Allpool kirjeldatud kliinilistes uuringutes ei muutnud sitagliptiin olulisel määral metformiini, glüburiidi, simvastatiini, rosiglitasooni, varfariini ega suukaudsete ravimite farmakokineetikat. rasestumisvastased vahendid, pakkudes in vivo tõendeid madala kalduvuse kohta ravimite koostoimeks CYP3A4, CYP2C8, CYP2C9 substraatide ja orgaaniliste katioonsete transporteritega (ÜMT).
Digoksiin: sitagliptiinil oli digoksiini farmakokineetikale minimaalne mõju. Pärast 0,25 mg digoksiini manustamist 10 päeva jooksul koos 100 mg sitagliptiiniga suurenes digoksiini plasma AUC 11% ja plasma Cmax 18%.
Sulfonüüluuread: CYP2C9 substraadi glüburiidi ühe annuse farmakokineetikat ei muudetud sitagliptiini korduvaid annuseid saavatel isikutel tähenduslikult. Kliiniliselt olulist koostoimet ei tohiks oodata teiste sulfonüüluureatega (nt glipisiid, tolbutamiid ja glimepiriid), mida nagu glüburiidi elimineerib peamiselt CYP2C9. Hoiatused ja ettevaatusabinõud].
Simvastatiin: simvastatiini, CYP3A4 substraadi, üheannuseline farmakokineetika ei muutunud oluliselt sitagliptiini mitmepäevaseid annuseid saavatel isikutel. Seetõttu ei ole sitagliptiin CYP3A4 vahendatud metabolismi inhibiitor.
Tiasolidiindioonid: Rosiglitasooni üheannuseline farmakokineetika ei muutunud isikutel olulisel määral mitme sitagliptiini päevaste annuste saamine, mis näitab, et sitagliptiin ei ole CYP2C8 vahendatud inhibiitor ainevahetus.
Varfariin: sitagliptiini mitu ööpäevast annust ei muutnud oluliselt farmakokineetikat, mida hinnati S (-) või R (+) varfariini enantiomeerid või farmakodünaamika (vastavalt protrombiini INR mõõtmisele) ühekordse varfariin. Kuna S (-) varfariini metaboliseerib peamiselt CYP2C9, toetavad need andmed ka järeldust, et sitagliptiin ei ole CYP2C9 inhibiitor.
Suukaudsed rasestumisvastased vahendid: sitagliptiiniga koosmanustamine ei mõjutanud oluliselt noretindrooni ega etinüülöstradiooli tasakaalukontsentratsiooni faasi farmakokineetikat.
Muude ravimite toime sitagliptiinile
Allpool kirjeldatud kliinilised andmed viitavad sellele, et sitagliptiin ei ole vastuvõtlik samaaegselt manustatavate ravimite kliiniliselt olulisele koostoimele.
Tsüklosporiin: viidi läbi uuring, et hinnata tsüklosporiini, tugeva p-glükoproteiini inhibiitori, mõju sitagliptiini farmakokineetikale. Sitagliptiini ühekordse 100 mg suukaudse annuse ja tsüklosporiini ühekordse 600 mg suukaudse annuse koosmanustamine suurendas AUC ja Cmax sitagliptiini sisaldus vastavalt umbes 29% ja 68%. Neid tagasihoidlikke sitagliptiini farmakokineetika muutusi ei peetud kliiniliselt olulisteks. Ka sitagliptiini renaalne kliirens ei muutunud oluliselt. Seetõttu ei eeldata olulist koostoimet teiste p-glükoproteiini inhibiitoritega.
Metformiinvesinikkloriid
[Vaata Ravimite koostoimed]
ülaosa
Mittekliiniline toksikoloogia
Kantserogenees, mutagenees, viljakuse langus
Janumet
Janumetis ei ole kombineeritud ravimitega läbi viidud loomkatseid kartsinogeneesi, mutageneesi või viljakuse languse hindamiseks. Järgnevad andmed põhinevad sitagliptiini ja metformiiniga eraldi läbi viidud uuringute tulemustel.
Sitagliptiin
Kaheaastane kartsinogeensuse uuring viidi läbi isastel ja emastel rottidel, kellele manustati sitagliptiini suukaudseid annuseid 50, 150 ja 500 mg / kg päevas. Meestel ja naistel oli sagedamini kombineeritud maksa adenoomi / kartsinoomi ja naistel maksa kartsinoomi esinemissagedus annuses 500 mg / kg. Selle annuse korral saavutatakse AUC võrdluste põhjal kokkupuude inimesega umbes 60-kordselt, kui täiskasvanu maksimaalne soovitatav annus on 100 mg päevas. Maksakasvajaid ei täheldatud annuses 150 mg / kg, mis on ligikaudu 20 korda suurem inimese kokkupuutest MRHD-ga. Kaheaastane kartsinogeensuse uuring viidi läbi isastel ja emastel hiirtel, kellele manustati sitagliptiini suukaudseid annuseid 50, 125, 250 ja 500 mg / kg päevas. Üheski elundis kuni 500 mg / kg kasvajate esinemissagedus ei suurenenud, mis on MRHD korral umbes 70-kordne inimese kokkupuude. Hiina hamstri munasarja (CHO) Ames'i bakteri mutageensuse katses ei olnud sitagliptiin mutageenne ega klastogeenne koos metaboolse aktiveerimisega või ilma selleta kromosoomaberratsiooni test, in vitro tsütogeneetika test CHO-s, roti hepatotsüütide DNA aluselise elueerimise test in vitro ja mikrotuuma in vivo test.
Rottide fertiilsusuuringutes suukaudsete sondiannustega 125, 250 ja 1000 mg / kg raviti isaseid 4 nädalat enne paaritumist, paaritumist kuni plaanilise lõpuni (kokku umbes 8 nädalat) ja naisi raviti 2 nädalat enne paaritumist tiinuse ajal 7. päev. 125 mg / kg kasutamisel ei täheldatud kahjulikku mõju fertiilsusele (AUC võrdluste põhjal umbes 12-kordne inimese kokkupuude MRHD-ga 100 mg / päevas). Suuremate annuste kasutamisel täheldati naistel nonoosist tingitud suurenenud resorptsiooni (umbes 25 ja 100-kordne inimese kokkupuude MRHD-ga AUC võrdluse põhjal).
Metformiinvesinikkloriid
Pikaajalisi kantserogeensuse uuringuid on tehtud rottide (annuse kestus 104 nädalat) ja hiirtega (annustamiskestus 91 nädalat) annustes kuni 900 mg / kg päevas ja kaasa arvatud 1500 mg / kg päevas, vastavalt. Need annused on kehapindala võrdluste põhjal umbes neli korda suuremad kui maksimaalne soovitatav inimese päevane annus 2000 mg. Nii isastel kui emastel hiirtel metformiiniga kantserogeensuse tõendeid ei leitud. Samamoodi ei täheldatud isastel rottidel metformiini kasutamisel kasvajate tekke potentsiaali. Emastel rottidel, keda raviti annusega 900 mg / kg, oli healoomuliste stromaalsete emaka polüüpide esinemissageduse suurenemine.
Järgmistes in vitro testides metformiini mutageensuse kohta mingeid tõendeid ei leitud: Ames'i test (S. typhimurium), geenimutatsiooni test (hiire lümfoomi rakud) või kromosoomaberratsioonide test (inimese lümfotsüüdid). Ka hiire in vivo mikrotuuma testi tulemused olid negatiivsed. Metformiin ei mõjutanud isaste ega emaste rottide viljakust, kui neid manustati annustes kuni 600 mg / kg päevas. mis on umbes kolm korda suurem inimese maksimaalsest soovitatavast ööpäevasest annusest, lähtudes kehapindalast võrdlused.
ülaosa
Kliinilised uuringud
Sitagliptiini ja metformiini koosmanustamist on uuritud II tüüpi diabeediga patsientidel, kelle toitumine ja füüsiline koormus ning glimepiriid kombinatsioonis ei olnud piisavad.
Janumetiga ei ole kliinilisi efektiivsuse uuringuid läbi viidud; siiski näidati Janumeti bioekvivalentsust koosmanustatud sitagliptiini ja metformiinvesinikkloriidi tablettidega.
Sitagliptiini ja metformiini samaaegne manustamine 2. tüüpi diabeediga patsientidel, kelle toitumine ja treening ei ole piisav
24-nädalases uuringus osales kokku 1091 patsienti, kellel oli 2. tüüpi diabeet ja kellel dieedi ja füüsilise koormuse korral oli glükeemiline kontroll ebapiisav. randomiseeritud, topeltpime, platseebokontrollitud faktoriaaluuring, mis oli kavandatud sitagliptiini ja metformiini efektiivsuse hindamiseks koosmanustamine. Hüperglükeemilist ainet (N = 541) saavad patsiendid läbisid dieedi, kehalise aktiivsuse ja ravimite väljapesemise perioodi kuni 12 nädalat. Pärast puhastusperioodi randomiseeriti ebapiisava glükeemilise kontrolliga patsiendid (A1C 7,5% kuni 11%) pärast kahenädalase ühe pimeda platseebo sisseviimisperioodi lõppu. Patsiendid, kes uuringu alguses ei kasutanud hüperglükeemilisi ravimeid (N = 550) ja kellel glükeemiline kontroll ei olnud piisav (A1C 7,5% kuni 11%) sisenes kohe kahenädalase ühekordse pimeda platseebo sissejuhatuse perioodi ja oli siis randomiseeritud. Ligikaudu võrdne arv patsiente randomiseeriti saama platseebot, 100 mg sitagliptiini üks kord päevas, 500 mg või 1000 mg metformiini kaks korda päevas või 50 mg sitagliptiini kaks korda päevas koos 500 mg või 1000 mg metformiiniga kaks korda päevas iga päev. Patsiente, kes ei suutnud uuringu ajal konkreetseid glükeemilisi eesmärke täita, raviti glüburiidiga (glibenklamiid).
Sitagliptiini ja metformiini koosmanustamine parandas märkimisväärselt A1C, FPG ja 2-tunnist PPG-d võrreldes platseebo, ainult metformiini ja ainult sitagliptiiniga (tabel 3, joonis 1). Keskmine Alc-väärtuse langus algtasemest oli keskmiselt suurem patsientidel, kellel AlCC algväärtus oli kõrgem. Patsientide puhul, kellel uuringu alguses ei olnud antihüperglükeemilist ainet, oli A1C keskmine langus algtasemest järgmine: sitagliptiin 100 mg üks kord päevas, -1,1%; metformiin 500 mg kaks korda päevas, -1,1%; metformiin 1000 mg kaks korda päevas, -1,2%; sitagliptiin 50 mg kaks korda päevas koos metformiiniga 500 mg kaks korda päevas, -1,6%; sitagliptiin 50 mg kaks korda päevas koos metformiiniga 1000 mg kaks korda päevas, -1,9%; ja platseebot saanud patsientidel -0,2%. Lipiidide mõju oli üldiselt neutraalne. Kehakaalu langus rühmades, kellele manustati sitagliptiini koos metformiiniga, oli sarnane rühmade rühmas, kellele manustati ainult metformiini või platseebot.
Tabel 3: Glükeemilised parameetrid lõppvisiidil (24-nädalane uuring) sitagliptiini ja metformiini kasutamisel üksi ja kombineeritult II tüüpi diabeediga patsientidel, kelle toitumine ja treening on ebapiisav.
Platseebo |
Sitagliptiin 100 mg QD |
Metformiin 500 mg kaks korda päevas |
Metformiin 1000 mg pakkumine |
Sitagliptiin 50 mg kaks korda päevas Metformiin 500 mg kaks korda päevas |
Sitagliptiin 50 mg kaks korda päevas Metformiin 1000 mg pakkumine |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Baasjoon (keskmine) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Muutus algtasemest (korrigeeritud keskmine†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Erinevus platseebost (korrigeeritud keskmine)†) (95% CI) |
-0.8c (-1.1, -0.6) |
-1.0c (-1.2, -0.8) |
-1.3c (-1.5, -1.1) |
-1.6c (-1.8, -1.3) |
-2.1c (-2.3, -1.8) |
|
| Patsiendid (%), kellel saavutatud A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Päästeravimeid saavad patsiendid | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Baasjoon (keskmine) | 196 | 201 | 205 | 197 | 204 | 197 |
| Muutus algtasemest (korrigeeritud keskmine†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Erinevus platseebost (korrigeeritud keskmine)†) (95% CI) |
-23c (-33, -14) |
-33c (-43, -24) |
-35c (-45, -26) |
-53c (-62, -43) |
-70c (-79, -60) |
|
| 2-tunnine PPG (mg / dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Baasjoon (keskmine) | 277 | 285 | 293 | 283 | 292 | 287 |
| Muutus algtasemest (korrigeeritud keskmine†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Erinevus platseebost (korrigeeritud keskmine)†) (95% CI) |
-52c (-67, -37) |
-54c (-69, -39) |
-78c (-93, -63) |
-93c (-107, -78) |
-117c (-131, -102) |

Joonis 1: A1C keskmine muutus algtasemest (%) 24 nädala jooksul koos Sitagliptiini ja üksi metformiiniga ning kombineeritult II tüüpi diabeediga patsientidel, kelle toitumine ja treening pole piisavalt kontrolli all
Lisaks hõlmas see uuring patsiente (N = 117), kellel oli raskem hüperglükeemia (A1C> 11% või veri) glükoos> 280 mg / dL), keda raviti kaks korda päevas 50 mg sitagliptiiniga ja metformiiniga 1000 mg. Selles patsientide rühmas oli keskmine A1C algväärtus 11,2%, keskmine FPG oli 314 mg / dL ja keskmine 2-tunnine PPG oli 441 mg / dL. 24 nädala pärast täheldati keskmist langust algtasemest -2,9% A1C, -127 mg / dL FPG ja -208 mg / dL 2-tunnise PPG korral.
Esialgne kombinatsioonravi või kombineeritud ravi jätkamine peaks olema individuaalne ja see peaks jääma tervishoiuteenuse osutaja otsustada.
Sitagliptiini lisateraapia II tüüpi diabeediga patsientidel, kelle ravi metformiiniga üksi ei ole piisav
24-nädalases randomiseeritud topeltpimedas platseebokontrolliga uuringus osales 701 II tüüpi diabeediga patsienti, et hinnata sitagliptiini efektiivsust kombinatsioonis metformiiniga. Patsiendid, kes juba said metformiini (N = 431) annuses vähemalt 1500 mg päevas, randomiseeriti pärast kahenädalase ühekordse pimeda platseebo sisseviimisperioodi lõppu. Patsiendid, kes saavad metformiini ja mõnda muud hüperglükeemilist ainet (N = 229), ja patsiendid, kes ei saa mingeid antihüperglükeemilisi ravimeid (ravi lõpetamine vähemalt 8 nädalat, N = 41) randomiseeriti pärast umbes 10-nädalast sisseastumisperioodi metformiiniga (annuses vähemalt 1500 mg päevas) monoteraapia. Patsiendid jaotati randomiseeritult 100 mg sitagliptiini või platseebo lisamisega üks kord päevas. Patsiente, kes ei suutnud uuringute ajal konkreetseid glükeemilisi eesmärke täita, raviti pioglitasooniga.
Kombinatsioonis metformiiniga parandas sitagliptiin märkimisväärselt A1C, FPG ja 2-tunnist PPG-d võrreldes platseeboga metformiiniga (tabel 4). Päästvat glükeemilist ravi kasutati 5% -l 100 mg sitagliptiiniga ravitud patsientidest ja 14% -l platseeboga ravitud patsientidest. Mõlemas ravirühmas täheldati sarnast kehakaalu langust.
Tabel 4: Sitagliptiini glükeemilised parameetrid lõppvisiidil (24-nädalane uuring) metformiiniga kombineeritud lisaravis *
| Sitagliptiin 100 mg QD + Metformiin |
Platseebo + Metformiin |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Baasjoon (keskmine) | 8.0 | 8.0 |
| Muutus algtasemest (korrigeeritud keskmine†) | -0.7 | -0.0 |
| Erinevus platseebost + metformiinist (korrigeeritud keskmine†) (95% CI) |
-0.7c (-0.8, -0.5) |
|
| Patsiendid (%), kellel saavutatud A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Baasjoon (keskmine) | 170 | 174 |
| Muutus algtasemest (korrigeeritud keskmine†) | -17 | 9 |
| Erinevus platseebost + metformiinist (korrigeeritud keskmine†) (95% CI) |
-25c (-31, -20) |
|
| 2-tunnine PPG (mg / dL) | N = 387 | N = 182 |
| Baasjoon (keskmine) | 275 | 272 |
| Muutus algtasemest (korrigeeritud keskmine†) | -62 | -11 |
| Erinevus platseebost + metformiinist (korrigeeritud keskmine†) (95% CI) |
-51c (-61, -41) |
Sitagliptiini lisaravi II tüüpi diabeediga patsientidel, kelle metformiini ja glimepiriidi kombinatsioon ei ole piisavalt kontrollitud
24-nädalases randomiseeritud topeltpimedas uuringus osales kokku 441 II tüüpi diabeediga patsienti. platseebo-kontrollitud uuring, mille eesmärk oli hinnata sitagliptiini efektiivsust koos glimepiriidiga, koos või ilma metformiinita. Patsiendid alustasid raviperioodi ainult glimepiriidiga (¥ mg 4 mg päevas) või glimepiriidiga kombinatsioonis metformiiniga (¥ ¥ ¥ 1500 mg päevas). Pärast annuse tiitrimist ja kuni 16-nädalast stabiilse sisseastumisperioodi ning kahenädalast platseebo sisseviimisperioodi glükeemiline kontroll (A1C 7,5% kuni 10,5%) randomiseeriti kas 100 mg sitagliptiini või platseebo lisamisele, manustatuna üks kord iga päev. Patsiente, kes ei suutnud uuringute ajal konkreetseid glükeemilisi eesmärke täita, raviti pioglitasooniga.
Patsientidel, kes said sitagliptiini koos metformiini ja glimepiriidiga, oli A1C ja FPG sisaldus märkimisväärselt paranenud võrreldes patsientidega, kes said platseebo koos metformiini ja glimepiriidiga (tabel 5), keskmine langus algtasemest platseeboga võrreldes oli A1C -0,9% ja FPG -21 mg / dL. Päästeravi kasutati 8% -l patsientidest, keda raviti sitagliptiiniga 100 mg, ja 29% -l patsientidest, keda raviti täiendava platseeboga. Täiendava sitagliptiiniga ravitud patsientidel suurenes kehakaal keskmiselt 1,1 kg vs. täiendav platseebo (+0,4 kg vs. -0,7 kg). Lisaks põhjustas sitagliptiini lisamine hüpoglükeemia esinemissageduse suurenemise võrreldes platseebo lisandiga. [Vaata Hoiatused ja ettevaatusabinõud; Kõrvaltoimed.]
Tabel 5: Sitagliptiini glükeemilised parameetrid lõppvisiidil (24-nädalane uuring) koos metformiini ja glimepiriidiga *
| 100 mg sitagliptiini + Metformiin ja glimepiriid |
Platseebo + Metformiin ja glimepiriid |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Baasjoon (keskmine) | 8.3 | 8.3 |
| Muutus algtasemest (korrigeeritud keskmine†) | -0.6 | 0.3 |
| Erinevus platseebost (korrigeeritud keskmine)†) (95% CI) | -0.9c (-1.1, -0.7) |
|
| Patsiendid (%), kellel saavutatud A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Baasjoon (keskmine) | 179 | 179 |
| Muutus algtasemest (korrigeeritud keskmine†) | -8 | 13 |
| Erinevus platseebost (korrigeeritud keskmine)†) (95% CI) | -21c (-32, -10) |
Sitagliptiini lisateraapia vs. Glipisiidi lisateraapia II tüüpi diabeediga patsientidel, kelle metformiin on ebapiisavalt kontrolli all
Sitagliptiini efektiivsust hinnati 52-nädalases topeltpimedas glipisiidiga kontrollitud mitte-alaealise uuringus II tüüpi diabeediga patsientidel. Ravi mittesaavad patsiendid või muud antihüperglükeemilised ained said ravi kestuseks kuni 12 nädalat monoteraapiana metformiiniga (annus â ¥ mg 1500 mg päevas), mis hõlmas ka muude ravimite kui metformiini väljapesemist, kui kohaldatav. Pärast sisseastumisperioodi randomiseeriti need, kelle glükeemiline tase oli ebapiisav (A1C 6,5% kuni 10%), 1: 1, lisades sitagliptiini 100 mg üks kord päevas või glipisiidi 52 nädala jooksul. Glipisiidi saanud patsientidele määrati algannus 5 mg / päevas ja seejärel tiitriti järgmise 18 nädala jooksul valikuliselt maksimaalse annuseni 20 mg / päevas, mis on vajalik glükeemilise kontrolli optimeerimiseks. Seejärel tuli glipisiidi annust hoida muutumatuna, välja arvatud hüpoglükeemia vältimiseks vajalik tiitrimine. Glipisiidi keskmine annus pärast tiitrimisperioodi oli 10 mg.
52 nädala pärast olid sitagliptiini ja glipisiidi ravikavatsuse analüüsis sarnased keskmised A1C langused algtasemest (tabel 6). Need tulemused olid kooskõlas iga protokolli analüüsiga (joonis 2). Järeldus sitagliptiini ja glipisiidi võrdväärsuse kohta võib olla piiratud patsientidega, kellel on algtase A1C on võrreldav uuringus osalenutega (üle 70% patsientidest oli algväärtus AlC <8% ja üle 90% patsientidest <9%).
Tabel 6: Glükeemilised parameetrid 52-nädalases uuringus, milles võrreldi sitagliptiini ja glipisiidi kui lisateraapiat patsientidel, kelle metformiin on ebapiisavalt kontrollitud (ravitav populatsioon) *
| 100 mg sitagliptiini + Metformiin |
Glipisiid + Metformiin |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Baasjoon (keskmine) | 7.7 | 7.6 |
| Muutus algtasemest (korrigeeritud keskmine†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Baasjoon (keskmine) | 166 | 164 |
| Muutus algtasemest (korrigeeritud keskmine†) | -8 | -8 |
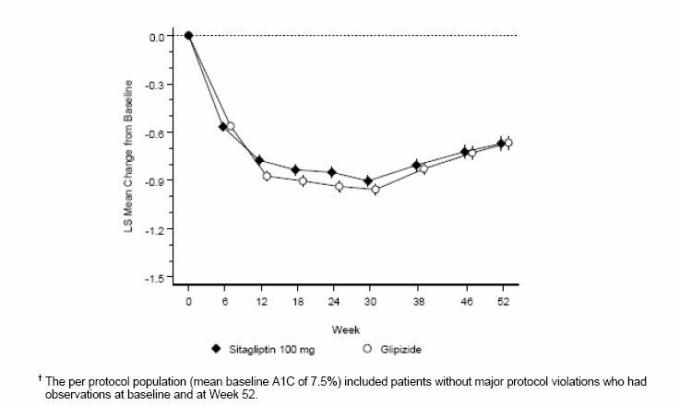
Joonis 2: A1C keskmine muutus algtasemest (%) üle 52 nädala uuringus, milles võrreldi sitagliptiini ja Glipisiid täiendava ravina patsientidel, kelle metformiin on ebapiisavalt kontrollitud (ühe elanikkonna kohta protokollis) â€
Hüpoglükeemia esinemissagedus sitagliptiini rühmas (4,9%) oli oluliselt (p <0,001) madalam kui glipisiidi rühmas (32,0%). Sitagliptiiniga ravitud patsientidel ilmnes kehamassi keskmine langus algväärtusest märkimisväärselt, võrreldes glipisiidi saanud patsientide olulise kaalutõusuga (–1,5 kg vs. +1,1 kg).
ülaosa
Kuidas komplektis
Nr 6747 - tabletid Janumet, 50 mg / 500 mg, on heleroosad, kapslikujulised õhukese polümeerikattega tabletid, mille ühele küljele on pressitud "575". Neid tarnitakse järgmiselt:
NDC 0006-0575-61 60 ühiku pudelit
NDC 0006-0575-62 180 ühiku pudeleid
NDC 0006-0575-52 ühikannusega blisterpakendid 50 kaupa
NDC 0006-0575-82 puistepudelid 1000-ga.
Nr 6749 - tabletid Janumet, 50 mg / 1000 mg, on punased, kapslikujulised õhukese polümeerikattega tabletid, mille ühele küljele on pressitud "577". Neid tarnitakse järgmiselt:
NDC 0006-0577-61 60 ühiku pudelit
NDC 0006-0577-62 180 ühiku pudeleid
NDC 0006-0577-52 ühikannusega blisterpakendid 50 kaupa
NDC 0006-0577-82 puistepudelid 1000-st.
Hoida temperatuuril 20-25 ° C (68-77 ° F), lubatud on temperatuurid kuni 15-30 ° C (59-86 ° F).
ülaosa
Patsientide nõustamise teave
Juhised
Patsiente tuleb teavitada Janumeti võimalikest riskidest ja eelistest ning alternatiivsetest raviviisidest. Neid tuleks teavitada ka toitumisjuhenditest kinnipidamise, regulaarse kehalise aktiivsuse, perioodilise vere võtmise olulisusest glükoosisisalduse jälgimine ja A1C testimine, hüpoglükeemia ja hüperglükeemia tuvastamine ja haldamine ning suhkurtõve hindamine tüsistused. Stressiperioodidel, nagu palavik, trauma, infektsioon või kirurgia, võivad ravivajadused muutuda ja patsientidel tuleb soovitada pöörduda viivitamatult arsti poole.
Piimhappe atsidoosi riskid, mis tulenevad metformiini komponendist, selle sümptomitest ja seisunditest, mis soodustavad selle arengut, nagu on märgitud Hoiatused ja ettevaatusabinõud, tuleks patsientidele selgitada. Patsientidel tuleb soovitada Janumeti kasutamine koheselt katkestada ja kui seletamatu hüperventilatsioon, müalgia, halb enesetunne, ebaharilik unisus, pearinglus, aeglane või ebaregulaarne südametegevus, külmatunne (eriti jäsemetes) või muud mittespetsiifilised sümptomid tekkida. Seedetrakti sümptomid on metformiinravi alustamisel tavalised ja võivad ilmneda Janumeti ravi alustamisel; patsiendid peaksid siiski pöörduma arsti poole, kui neil ilmnevad seletamatud sümptomid. Ehkki pärast stabiliseerumist ilmnevad seedetrakti sümptomid ei ole tõenäoliselt seotud ravimitega, on selline sümptomite esinemist tuleks hinnata, et teha kindlaks, kas see võib olla tingitud laktatsidoosist või muust tõsisest haigus.
Janumeti kasutamise ajal tuleb patsiente juhendada nii akuutse kui ka kroonilise alkoholitarbimise suhtes.
Patsiente tuleb Janumetiga ravi ajal teavitada neerufunktsiooni ja hematoloogiliste parameetrite regulaarsest testimisest.
Patsiente tuleb teavitada sellest, et sitagliptiini, mis on üks Janumet'i koostisosi, turustamisjärgsel kasutamisel on teatatud allergilistest reaktsioonidest. Kui ilmnevad allergiliste reaktsioonide sümptomid (sealhulgas lööve, nõgestõbi ja näo, huulte, keele ja kurgu turse, mis võivad tekkida) põhjustada hingamis- või neelamisraskusi), peavad patsiendid Janumeti kasutamise lõpetama ja pöörduma arsti poole viivitamatult.
Arstid peaksid oma patsientidele juhendama, et nad loeksid enne Janumeti ravi alustamist läbi patsiendi infolehe ja lugeksid seda iga kord, kui retsepti uuendatakse. Patsiente tuleb juhendada informeerima oma arsti või apteekrit, kui neil ilmneb mõni ebatavaline sümptom või kui mõni teadaolev sümptom püsib või süveneb.
Laborikatsed
Kõigi diabeediravi ravivastust tuleb jälgida vere glükoosisisalduse ja A1C sisalduse perioodiliste mõõtmiste abil eesmärgiga seda taset normivahemiku lähedale langetada. A1C on eriti kasulik pikaajalise glükeemilise kontrolli hindamiseks.
Hematoloogiliste parameetrite (nt hemoglobiini / hematokriti ja punase vere) esialgne ja perioodiline jälgimine rakkude indeksid) ja neerufunktsiooni (seerumi kreatiniin) tuleks teostada vähemalt kord aastas. Kuigi metformiinravi ajal on harva esinenud megaloblastilist aneemiat, tuleb selle kahtluse korral välistada B12-vitamiini vaegus.
Jaotatud:
MERCK & CO., Whitehouse Station, NJ 08889, USA
9794108
USA patent nr: 6 699 871
1 MERCK & CO., Inc. registreeritud kaubamärk, Whitehouse Station, New Jersey 08889 USA
2 MERCK & CO., Inc. kaubamärk, Whitehouse Station, New Jersey 08889 USA
3GLUCOPHAGE® on Merck Sante S.A.S-i registreeritud kaubamärk, mis on Merck KGaA sidusettevõte Darmstadtis, Saksamaal.
Litsentseeritud ettevõttele Bristol-Myers Squibb Company.
Autoriõigused © 2007, 2008 MERCK & CO., Inc.
Kõik õigused kaitstud
FDA poolt heaks kiidetud patsiendi märgistamine
Patsiendi teave
Janumet® (JAN-te-kohtusite)
(sitagliptiin / metformiin HCl)
Tabletid
Enne kui hakkate seda kasutama ja lugege iga kord uuesti, siis lugege läbi Janumet1ga kaasas olev patsiendiinfo. Võib olla uut teavet. See infoleht ei asenda arstiga teie tervislikust seisundist või ravist rääkimist.
Mis on kõige olulisem teave, mida ma peaksin Janumeti kohta teadma?
Metformiinvesinikkloriid, üks Janumeti koostisosi, võib põhjustada haruldast, kuid tõsist kõrvaltoimet, mida nimetatakse laktatsidoosiks (piimhappe kogunemine veres) ja mis võib põhjustada surma. Laktatsidoos on meditsiiniline hädaolukord ja seda tuleb ravida haiglas.
Lõpetage Janumeti võtmine ja helistage kohe oma arstile, kui teil tekib mõni järgmistest piimhappe atsidoosi sümptomitest:
- Te tunnete end väga nõrgana ja väsinuna.
- Teil on ebatavaline (mitte tavaline) lihasvalu.
- Teil on hingamisraskusi.
- Teil on seletamatud mao- või sooleprobleemid koos iivelduse ja oksendamise või kõhulahtisusega.
- Tunned külma, eriti kätes ja jalgades.
- Teil on peapööritus või peapööritus.
- Teil on aeglane või ebaregulaarne südametegevus.
Laktatsidoosi saamise tõenäosus on suurem, kui:
- teil on probleeme neerudega.
- teil on probleeme maksaga.
- teil on südame paispuudulikkus, mis nõuab ravi ravimitega.
- jooma palju alkoholi (väga sageli või lühiajalist "liigset" joomist).
- dehüdreerunud (kaotab suure hulga kehavedelikke). See võib juhtuda, kui olete palaviku, oksendamise või kõhulahtisuse käes. Dehüdratsioon võib tekkida ka siis, kui higistate aktiivsuse või treenimisega palju ega joo piisavalt vedelikke.
- teil on teatud röntgentestid süstitavate värvainete või kontrastainetega.
- teil on operatsioon.
- teil on südameatakk, raske infektsioon või insult.
- olete 80-aastased või vanemad ja teie neerufunktsiooni pole kontrollitud.
Mis on Janumet?
Janumeti tabletid sisaldavad kahte retseptiravimit, sitagliptiini (JANUVIA ™ 2) ja metformiini. Janumet'i saab kasutada koos dieedi ja füüsilise koormusega, et alandada II tüüpi diabeediga täiskasvanud patsientide veresuhkrut. Arst teeb kindlaks, kas Janumet on teie jaoks sobiv, ja määrab teile parima viisi diabeedi ravi alustamiseks ja jätkamiseks.
Janumet:
- aitab parandada insuliini taset pärast sööki.
- aitab kehal paremini reageerida insuliinile, mida see looduslikult valmistab.
- vähendab keha toodetava suhkru kogust.
- tõenäoliselt ei põhjusta madalat veresuhkru taset (hüpoglükeemiat), kui seda võetakse ise kõrge veresuhkru raviks.
Janumeti kasutamist alla 18-aastastel lastel ei ole uuritud.
Janumeti ei ole uuritud insuliiniga - ravimiga, mis teadaolevalt põhjustab madalat veresuhkru taset.
Kes ei peaks Janumeti võtma?
Ärge võtke Janumeti, kui:
- teil on 1. tüüpi diabeet.
- teil on teatud neeruprobleeme.
- teil on seisundid, mida nimetatakse metaboolseks atsidoosiks või diabeetiliseks ketoatsidoosiks (suurenenud ketoonide sisaldus veres või uriinis).
- teil on olnud allergiline reaktsioon Janumeti või sitagliptiini (JANUVIA), mis on Janumeti üks koostisosi, suhtes.
- kui saate röntgeniprotseduuriks värvainete või kontrastainete süsti, tuleb Janumet lühiajaliselt peatada. Rääkige oma arstiga, millal Janumeti kasutamine lõpetada ja millal uuesti alustada. Vt "Mis on kõige olulisem teave, mida ma peaksin Janumeti kohta teadma?"
Mida peaksin arstile ütlema enne Janumetiga ravi alustamist ja selle ajal?
Janumet ei pruugi teile sobida. Rääkige oma arstile kõigist teie haigusseisunditest, sealhulgas järgmistest juhtudest:
- teil on probleeme neerudega.
- teil on probleeme maksaga.
- teil on olnud allergiline reaktsioon Janumeti või sitagliptiini (JANUVIA), mis on Janumeti üks koostisosi, suhtes.
- teil on südameprobleeme, sealhulgas kongestiivne südamepuudulikkus.
- on vanemad kui 80 aastat. Üle 80-aastased patsiendid tohivad Janumeti kasutada ainult siis, kui nende neerufunktsiooni on kontrollitud ja see on normaalne.
- jooma palju alkoholi (kogu aeg või lühiajalise "liigse joomisega").
- olete rase või plaanite rasestuda. Ei ole teada, kas Janumet kahjustab teie sündimata last. Kui olete rase, rääkige oma arstiga parimast viisist veresuhkru kontrollimiseks raseduse ajal. Kui kasutate Janumeti raseduse ajal, rääkige oma arstiga, kuidas saate Janumeti registris olla. Rasedusregistri tasuta telefoninumber on 1-800-986-8999.
- kui toidate last rinnaga või plaanite seda imetada. Ei ole teada, kas Janumet eritub teie rinnapiima. Janumet'i võtmise ajal pidage nõu oma arstiga, milline on parim viis lapse toitmiseks.
Rääkige oma arstile kõigist võetud ravimitest, sealhulgas retsepti- ja retseptita ravimitest, vitamiinidest ja taimsetest toidulisanditest. Janumet võib mõjutada teiste ravimite toimimist ja mõned ravimid võivad mõjutada Janumet'i toimimist.
Teage ravimeid, mida te võtate. Hoidke oma ravimite loetelu ja näidake seda oma arstile ja apteekrile, kui saate uut ravimit. Enne mõne uue ravimi kasutamist pidage nõu oma arstiga.
Kuidas ma peaksin Janumeti võtma?
- Arst ütleb teile, kui palju Janumeti tablette võtta ja kui sageli peate neid võtma. Võtke Janumeti täpselt nii, nagu arst on teile rääkinud.
- Võimalik, et teie arst peab suurendama teie annust, et kontrollida veresuhkru taset.
- Arst võib teile välja kirjutada Janumeti koos sulfonüüluureaga (veel üks ravim veresuhkru alandamiseks). Vt "Millised on Janumeti võimalikud kõrvaltoimed?" teave madala veresuhkru riski suurenemise kohta.
- Võtke Janumetit söögikordade ajal, et vähendada maoärrituse tõenäosust.
- Jätkake Janumeti kasutamist nii kaua, kui arst teile soovitab.
- Kui te võtate Janumeti liiga palju, helistage kohe oma arstile või mürgistuskontrolli keskusesse.
- Kui teil jääb mõni annus võtmata, võtke see koos toiduga niipea, kui see teile meelde tuleb. Kui te ei mäleta, kuni on käes aeg järgmise annuse saamiseks, jätke unustatud annus vahele ja minge tagasi tavalise ajakava juurde. Ärge võtke kahte Janumeti annust korraga.
- Võib-olla peate Janumeti kasutamise lühikeseks ajaks katkestama. Helistage juhistele arstilt, kui:
- on dehüdreeritud (kaotanud liiga palju kehavedelikku). Dehüdratsioon võib tekkida, kui teil on tugev oksendamine, kõhulahtisus või palavik või kui te joote tavalisest palju vähem vedelikku.
- plaanite operatsiooni.
- saavad röntgenprotseduuriks värvaine või kontrastaine süsti.
Vt "Mis on kõige olulisem teave, mida ma peaksin Janumeti kohta teadma?" ja "Kes ei peaks Janumeti võtma?"
- Kui teie keha on teatud tüüpi stressi all, näiteks palavik, trauma (näiteks autoõnnetus), infektsioon või operatsioon, võib vajalik suhkruhaiguse ravimikogus muutuda. Rääkige oma arstile kohe, kui teil on mõni neist seisunditest, ja järgige arsti juhiseid.
- Jälgige veresuhkru taset, nagu arst seda soovitab.
- Janumeti kasutamise ajal pidage kinni ettenähtud toitumis- ja treeningprogrammist.
- Rääkige oma arstiga, kuidas ennetada, ära tunda ja hallata madalat veresuhkrut (hüpoglükeemiat), kõrget veresuhkrut (hüperglükeemiat) ja diabeedi tüsistusi.
- Arst jälgib teie suhkruhaigust regulaarsete vereanalüüsidega, sealhulgas teie veresuhkru taseme ja hemoglobiini A1C sisalduse osas.
- Arst teeb vereanalüüse, et kontrollida teie neerufunktsiooni enne Janumet-ravi ja selle ajal.
Millised on Janumeti võimalikud kõrvaltoimed?
Janumet võib põhjustada tõsiseid kõrvaltoimeid. Vt "Mis on kõige olulisem teave, mida ma peaksin Janumeti kohta teadma?"
Janumeti võtmisel esinevad tavalised kõrvaltoimed:
- kinnine või nohu ja kurguvalu
- ülemiste hingamisteede infektsioon
- kõhulahtisus
- iiveldus ja oksendamine
- gaas, ebamugavustunne maos, seedehäired
- nõrkus
- peavalu
Janumeti võtmine koos toiduga võib aidata vähendada metformiini tavalisi kõrvaltoimeid maos, mis ilmnevad tavaliselt ravi alguses. Kui teil on ebaharilikke või ootamatuid kõhuprobleeme, pidage nõu oma arstiga. Mao probleemid, mis tekivad ravi ajal hiljem, võivad olla märk millestki tõsisemast.
Teatud diabeediravimid, näiteks sulfonüüluuread ja meglitiniidid, võivad põhjustada madala veresuhkru taset (hüpoglükeemia). Janumeti kasutamisel koos nende ravimitega võib teil olla liiga madal veresuhkur. Arst võib teile välja kirjutada sulfonüüluurea või meglitiniidi väiksemate annuste. Rääkige oma arstile, kui teil on probleeme madala veresuhkru tasemega.
Janumeti või sitagliptiini kasutamisel on teatatud järgmistest täiendavatest kõrvaltoimetest:
- Janumeti või sitagliptiiniga, mis on üks Janumeti ravimitest, võib esineda tõsiseid allergilisi reaktsioone. Tõsise allergilise reaktsiooni sümptomiteks võivad olla lööve, nõgestõbi ja näo, huulte, keele ja kurgu turse, hingamis- või neelamisraskused. Kui teil on allergiline reaktsioon, lõpetage Janumeti võtmine ja helistage kohe oma arstile. Arst võib teile välja kirjutada ravimid allergilise reaktsiooni raviks ja muud ravimit teie diabeedi raviks.
- Kõrgenenud maksaensüümid.
- Kõhunäärme põletik.
Need pole kõik Janumeti võimalikud kõrvaltoimed. Lisateavet küsige oma arstilt.
Rääkige oma arstile, kui teil on mõni kõrvaltoime, mis häirib, on ebatavaline või ei kao kuhugi.
Kuidas peaksin Janumeti säilitama?
Hoidke Janumet toatemperatuuril (20-25 ° C) 68-77 ° F.
Hoidke Janumet ja kõik ravimid lastele kättesaamatus kohas.
Üldine teave Janumeti kasutamise kohta
Mõnikord kirjutatakse ravimeid selliste haigusseisundite jaoks, mida ei ole patsiendi infolehtedes nimetatud. Ärge kasutage Janumeti haigusseisundite jaoks, mille jaoks see pole ette nähtud. Ärge andke Janumeti teistele inimestele, isegi kui neil on samad sümptomid nagu teil. See võib neid kahjustada.
See infoleht võtab kokku kõige olulisema teabe Janumeti kohta. Kui soovite lisateavet, pidage nõu oma arstiga. Janumeti kohta saate tervishoiutöötajatele mõeldud teavet küsida oma arstilt või apteekrilt. Lisateabe saamiseks helistage 1-800-622-4477.
Millised on Janumeti koostisosad?
Toimeained: sitagliptiin ja metformiinvesinikkloriid.
Mitteaktiivsed koostisosad: mikrokristalne tselluloos, polüvinüülpürrolidoon, naatriumlaurüülsulfaat ja naatriumstearüülfumaraat. Tableti kilekate sisaldab järgmisi mitteaktiivseid koostisosi: polüvinüülalkohol, polüetüleenglükool, talk, titaandioksiid, punane raudoksiid ja must raudoksiid.
Mis on II tüüpi diabeet?
II tüüpi diabeet on seisund, kus teie keha ei valmista piisavalt insuliini ja teie keha toodetav insuliin ei tööta nii hästi kui peaks. Teie keha võib ka liiga palju suhkrut teha. Kui see juhtub, koguneb veres suhkur (glükoos). See võib põhjustada tõsiseid meditsiinilisi probleeme.
Diabeedi ravi peamine eesmärk on alandada veresuhkru taset normaalsele tasemele. Veresuhkru taseme alandamine ja kontroll võib aidata ära hoida või edasi lükata diabeedi tüsistusi, nagu südameprobleemid, neeruprobleemid, pimedus ja amputatsioon.
Kõrge veresuhkru taset saab vähendada dieedi ja füüsilise koormuse ning vajadusel ka teatud ravimite abil.
Välja antud märtsis 2009
Jaotatud:
MERCK & CO., Whitehouse Station, NJ 08889, USA
Viimati värskendatud: 03/09
Janumet, sitagliptiin ja metformiinvesinikkloriid, teave patsiendi kohta (lihtsas inglise keeles)
Üksikasjalik teave diabeedi märkide, sümptomite, põhjuste, ravi kohta
Selles monograafias sisalduv teave ei hõlma kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet ega kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi: Sirvige kõiki diabeediravimeid



