Onglyza diabeedi raviks
Kaubamärk: Onglyza
Üldnimi: saksagliptiin
Annustamisvorm: õhukese polümeerikattega tablett
Sisu:
Näidustused ja kasutamine
Annustamine ja manustamine
Annustamisvormid ja tugevused
Vastunäidustused
Hoiatused ja ettevaatusabinõud
Kõrvaltoimed
Ravimite koostoimed
Kasutamine konkreetsetes populatsioonides
Üleannustamine
Kirjeldus
Farmakoloogia
Mittekliiniline toksikoloogia
Kliinilised uuringud
Kuidas komplektis
Onglyza patsientide teave (lihtsas inglise keeles)
Näidustused ja kasutamine
Monoteraapia ja kombineeritud teraapia
Onglyza on näidustatud dieedi ja treeningu lisana, et parandada II tüüpi suhkurtõvega täiskasvanute glükeemilist kontrolli. [Vaata Kliinilised uuringud].
Olulised kasutamispiirangud
Onglyzat ei tohiks kasutada I tüüpi suhkurtõve või diabeetilise ketoatsidoosi raviks, kuna see ei oleks sellises olukorras efektiivne.
Onglyza kasutamist koos insuliiniga ei ole uuritud.
ülaosa
Annustamine ja manustamine
Soovitatav annustamine
Onglyza soovitatav annus on 2,5 mg või 5 mg üks kord päevas sõltumata söögikordadest.
Neerukahjustusega patsiendid
Kerge neerukahjustusega (kreatiniini kliirens [CrCl]> 50 ml / min) patsientidel ei soovitata Onglyza annust kohandada.
Mõõduka või raske neerukahjustusega patsientidel on Onglyza annus 2,5 mg üks kord päevas või lõppstaadiumis neeruhaigusega (ESRD), mis vajab hemodialüüsi (kreatiniini kliirens [CrCl] - 50 ml / min). Onglyza tuleb manustada pärast hemodialüüsi. Onglyzat ei ole peritoneaaldialüüsi saavatel patsientidel uuritud.
Kuna Onglyza annus peaks neerufunktsiooni põhjal olema piiratud 2,5 mg-ga, on soovitatav enne Onglyza-ravi alustamist ja perioodiliselt pärast seda neerufunktsiooni hinnata. Neerufunktsiooni saab hinnata seerumi kreatiniini põhjal, kasutades Cockcroft-Gault valemit või Dieedi muutmist neeruhaiguse valemi järgi. [Vaata Kliiniline farmakoloogia, Farmakokineetika.]
Tugevad CYP3A4 / 5 inhibiitorid
Onglyza annus on 2,5 mg üks kord päevas, kui seda manustatakse koos tugevate tsütokroom P450 3A4 / 5 (CYP3A4 / 5) inhibiitoritega (nt. ketokonasool, atasanaviir, klaritromütsiin, indinaviir, itrakonasool, nefasodoon, nelfinaviir, ritonaviir, sakvinaviir ja telitromütsiin). [Vaata Ravimite koostoimed, CYP3A4 / 5 ensüümide ja Kliiniline farmakoloogia, Farmakokineetika.]
ülaosa
Annustamisvormid ja tugevused
- Onglyza (saksagliptiin) 5 mg tabletid on roosad, kaksikkumerad, ümmargused õhukese polümeerikattega tabletid, mille ühele küljele on trükitud "5" ja tagaküljele "4215", sinise tindiga.
- Onglyza (saksagliptiin) 2,5 mg tabletid on kahvatukollase kuni helekollase värvusega, kaksikkumerad, ümmargused, õhukese polümeerikattega tabletid, mille ühele küljele on trükitud "2,5" ja tagaküljele "4214", sinise tindiga.
ülaosa
Vastunäidustused
Puudub.
ülaosa
Hoiatused ja ettevaatusabinõud
Kasutamine koos ravimitega, mis teadaolevalt põhjustavad hüpoglükeemiat
Insuliini sekretsiooni põhjustajad, näiteks sulfonüüluuread, põhjustavad hüpoglükeemiat. Seetõttu võib hügoglükeemia riski vähendamiseks, kui seda kasutatakse koos Onglyza'ga, osutuda vajalikuks väiksem insuliinisekreteerimise annus. [Vaata Kõrvaltoimed, Kliiniliste uuringute kogemus.]
Makrovaskulaarsed tulemused
Kliinilisi uuringuid pole tehtud, mis kinnitaksid veenvaid tõendeid makrovaskulaarse riski vähenemise kohta Onglyza või mõne muu diabeedivastase ravimiga.
ülaosa
Kõrvaltoimed
Kliiniliste uuringute kogemus
Kuna kliinilisi uuringuid viiakse läbi väga erinevates tingimustes, täheldati a. Kliinilistes uuringutes täheldatud kõrvaltoimete määra Seda ravimit ei saa otseselt võrrelda mõne teise ravimi kliiniliste uuringute määradega ja see ei pruugi kajastada 2006. aastal täheldatud määra harjutama.
Monoteraapia ja täiendav kombineeritud teraapia
Kahes 24-nädalases platseebokontrollitud monoteraapia uuringus raviti patsiente Onglyza 2,5 mg päevas, Onglyza 5 mg päevas ja platseeboga. Samuti viidi läbi kolm 24-nädalast, platseebokontrollitud, täiendava kombinatsioonravi uuringut: üks metformiiniga, üks tiasolidiindiooniga (pioglitasoon või rosiglitasoon) ja üks glüburiidiga. Nendes kolmes uuringus randomiseeriti patsiendid lisaravile Onglyza 2,5 mg ööpäevas, Onglyza 5 mg päevas või platseeboga. 10 mg saksagliptiinravi haarati ühte monoteraapia uuringusse ja metformiiniga täiendavasse kombinatsiooniuuringusse.
Kahe monoteraapia uuringu 24-nädalaliste andmete (sõltumata glükeemilisest päästmisest) etteantud koondatud analüüsis, metformiini uuringu lisamisel, tiasolidiindiooni (TZD) uuringul, ja lisaks glüburiidi uuringule oli kõrvaltoimete üldine esinemissagedus patsientidel, keda raviti Onglyza 2,5 mg ja 5 mg Onglyza, platseeboga (72,0% ja 72,2% versus 70,6%, vastavalt). Kõrvaltoimete tõttu katkestati ravi vastavalt 2,2%, 3,3% ja 1,8% -l patsientidest, kes said vastavalt 2,5 mg Onglyza, 5 mg Onglyza ja platseebot. Kõige tavalisemad kõrvaltoimed (täheldatud vähemalt kahel patsiendil, keda raviti Onglyza 2,5 mg-ga, või vähemalt kahel patsiendil, keda raviti Onglyza-ga 5 mg), mis seostati ravi enneaegse katkestamisega, hõlmas lümfopeeniat (vastavalt 0,1% ja 0,5% versus 0%), löövet (0,2% ja 0,3% versus 0,3%), vere kreatiniini sisaldus suurenes (0,3% ja 0% versus 0%) ja vere kreatiinfosfokinaasi sisaldus (0,1% ja 0,2% võrreldes 0%). Selles ühendatud analüüsis esinenud kõrvaltoimed (sõltumata uurija hinnangust põhjuslikkusele) 2006 5% -l Onglyza 5 mg-ga ravitud patsientidest ja sagedamini kui platseeboga ravitud patsientidest on Tabel 1.
Tabel 1: Kõrvaltoimed (sõltumata uurija hinnangust põhjuslikkusele) platseebo-kontrollitud uuringutes * Teatatud 5% -l ja 5 mg Onglyzaga ravitud patsientidest ja sagedamini kui patsientidel, keda raviti Platseebo
| Patsientide arv (%) | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Platseebo N = 799 |
|
| * 5 platseebokontrolliga uuringut hõlmavad kahte monoteraapia uuringut ja ühte täiendava kombinatsioonravi uuringut, millel on järgmised omadused: metformiin, tiasolidiindioon või glüburiid. Tabelis on toodud 24-nädalased andmed sõltumata glükeemilisest päästmisest. | ||
| Ülemiste hingamisteede infektsioon | 68 (7.7) | 61 (7.6) |
| Kuseteede infektsioon | 60 (6.8) | 49 (6.1) |
| Peavalu | 57 (6.5) | 47 (5.9) |
2,5 mg Onglyzaga ravitud patsientidel oli peavalu (6,5%) ainus kõrvaltoime, mille esinemissagedus oli ~ 5% ja sagedamini kui platseeboga ravitud patsientidel.
Selles koondatud analüüsis sisaldasid kõrvaltoimed, mis esinesid 2% -l patsientidest, keda raviti Onglyza 2,5 mg või Onglyza 5 mg, ja –1% sagedamini, võrreldes platseeboga: sinusiit (vastavalt 2,9% ja 2,6% versus 1,6%), kõhuvalu (2,4% ja 1,7% versus 0,5%), gastroenteriit (1,9% ja 2,3% versus 0,9%) ja oksendamine (2,2% ja 2,3% versus 1,3%) ).
TZD-uuringule lisandudes oli perifeerse ödeemi esinemissagedus suurem Onglyza 5 mg kasutamisel võrreldes platseeboga (vastavalt 8,1% ja 4,3%). Perifeerse ödeemi esinemissagedus Onglyza 2,5 mg kasutamisel oli 3,1%. Ükski perifeerse turse teatatud kõrvaltoimetest ei põhjustanud uuringuravi katkestamist. Perifeerse ödeemi esinemissagedus Onglyza 2,5 mg ja 5 mg Onglyza kasutamisel võrreldes platseeboga oli 3,6% ja 2% versus 3% monoteraapiana, 2,1% ja 2,1% versus 2,2% metformiinile lisaravina ja 2,4% ja 1,2% versus 2,2% täiendava teraapiana glüburiid.
Luumurdude esinemissagedus oli vastavalt 1,0 ja 0,6 100 patsiendiaasta kohta Onglyza (2,5 mg, 5 mg ja 10 mg ühendatud analüüs) ja platseebo puhul. Onglyza-ravi saanud patsientide luumurdude esinemissagedus aja jooksul ei suurenenud. Põhjuslikkust ei ole kindlaks tehtud ja mittekliinilised uuringud ei ole näidanud saksagliptiini kahjulikku toimet luule.
Kliinilises programmis täheldati trombotsütopeenia juhtu, mis oli kooskõlas idiopaatilise trombotsütopeenilise purpuriga. Selle sündmuse seos Onglyzaga pole teada.
Metformiiniga manustatud Onglyzaga seotud kõrvaltoimed II tüüpi diabeediga varem ravi mittesaanud patsientidel
Tabelis 2 on esitatud kõrvaltoimed (sõltumata uurija hinnangust põhjuslikkusele) 5% -l patsientidest osalemine täiendavas 24-nädalases aktiivselt kontrollitud uuringus samaaegselt manustatud Onglyza ja metformiiniga, kes ei olnud varem ravi saanud patsiendid.
Tabel 2: Esialgne ravi onglüza ja metformiiniga kombinatsioonravi mittesaanud patsientidel: teatatud kõrvaltoimetest (sõltumata uurija hinnangust) põhjuslikkusest) - 5% -l patsientidest, keda raviti Onglyza 5 mg pluss metformiiniga (ja sagedamini kui patsientidel, keda raviti metformiiniga) Üksi)
| Patsientide arv (%) | ||
|---|---|---|
| Onglyza 5 mg + metformiin * N = 320 |
Metformiin * N = 328 |
|
| * Metformiini alustati algannusega 500 mg päevas ja tiitriti maksimaalselt 2000 mg päevas. | ||
| Peavalu | 24 (7.5) | 17 (5.2) |
| Nasofarüngiit | 22 (6.9) | 13 (4.0) |
Hüpoglükeemia
Hüpoglükeemia kõrvaltoimed põhinesid kõigil hüpoglükeemia teadetel; samaaegset glükoosimõõtmist ei olnud vaja. Glüburiidi lisauuringus oli teatatud hüpoglükeemia üldine esinemissagedus suurem Onglyza 2,5 mg ja 5 mg Onglyza (13,3% ja 14,6%) võrreldes platseeboga (10,1%). Selle uuringu kinnitatud hüpoglükeemia esinemissagedus, mida määratletakse kui hüpoglükeemia sümptomeid, millega kaasneb a sõrmeotste glükoosisisaldus â ‰ ¤ 50 mg / dL oli 2,4% ja 0,8% Onglyza 2,5 mg ja Onglyza 5 mg ja 0,7% platseebo. Monoteraapiana manustatud Onglyza 2,5 mg ja 5 mg Onglyza hüpoglükeemia esinemissagedus võrreldes platseeboga oli 4,0% ja 5,6% Metformiinile lisaraviks vastavalt 4,1%, 7,8% ja 5,8% ja 5% ning 4,1% ja 2,7% versus 3,8% täiendava ravina TZD. Teatatud hüpoglükeemia esinemissagedus oli 3,4% patsientidel, kes ei olnud varem ravi saanud Onglyza 5 mg ja metformiini, ning 4,0% patsientidest, kes said ainult metformiini.
Ülitundlikkusreaktsioonid
Ülitundlikkusega seotud sündmused, näiteks urtikaaria ja näoödeem viienda uuringu koondatud analüüsis kuni 24. nädalani täheldati 1,5%, 1,5% ja 0,4% patsientidest, kes said 2,5 mg Onglyza, 5 mg Onglyza ja platseebot, vastavalt. Ükski neist juhtudest ei vajanud Onglyza-ravi saanud patsientidel haiglaravi või uurijad olid nende sõnul eluohtlikud. Üks ühendatud saksagliptiiniga ravitud patsient katkestas üldise urtikaaria ja näoturse tõttu.
Elulised märgid
Onglyzaga ravitud patsientidel ei ole kliiniliselt olulisi eluliste tunnuste muutusi täheldatud.
Laborikatsed
Absoluutne lümfotsüütide arv
Onglyza kasutamisel ilmnes annusest sõltuv lümfotsüütide absoluutarvu keskmine langus. Algtasemest lümfotsüütide absoluutarvu keskmiselt umbes 2200 rakku / mikroliitri kohta väheneb keskmiselt umbes 100 ja 120 rakku / mikroL Viie platseebokontrollitud kliinilise kliinilise uuringu koondanalüüsis täheldati 24. nädalal vastavalt 5 mg ja 10 mg Onglyza platseeboga võrreldes uuringud. Sarnaseid toimeid täheldati ka siis, kui Onglyza 5 mg manustati algselt koos metformiiniga, võrreldes ainult metformiiniga. Onglyza 2,5 mg kasutamisel platseeboga võrreldes erinevusi ei täheldatud. Patsientide osakaal, kelle lümfotsüütide arv oli 750 rakku / mikroliitris, oli vastavalt 2,5%, 1,5%, 1,4% ja 0,4% saksagliptiini 2,5 mg, 5 mg, 10 mg ja platseeborühmas. Enamikul patsientidest ei täheldatud Onglyza korduval kasutamisel kordumist, kuigi mõnedel patsientidel esines Onglyza manustamise katkestamisel korduv langus. Lümfotsüütide arvu langust ei seostatud kliiniliselt oluliste kõrvaltoimetega.
Lümfotsüütide arvu vähenemise kliiniline tähtsus platseebo suhtes ei ole teada. Kui see on kliiniliselt näidustatud, näiteks ebahariliku või pikaajalise infektsiooni korral, tuleb mõõta lümfotsüütide arvu. Onglyza mõju lümfotsüütide arvule lümfotsüütide kõrvalekalletega patsientidel (nt inimese immuunpuudulikkuse viirus) pole teada.
Trombotsüüdid
Kuues topeltpimedas kontrollitud kliinilises ohutuse ja efektiivsuse uuringus ei näidanud Onglyza kliiniliselt olulist ega järjepidevat toimet trombotsüütide arvule.
ülaosa
Ravimite koostoimed
CYP3A4 / 5 ensüümide indutseerijad
Rifampin vähendas saksagliptiini ekspositsiooni märkimisväärselt, aktiivse metaboliidi 5-hüdroksüsaksagliptiini ajakontsentratsiooni kõvera (AUC) pindala ei muutunud. Rifampiin ei mõjutanud plasma dipeptidüülpeptidaas-4 (DPP4) aktiivsuse pärssimist 24-tunnise annuse intervalliga. Seetõttu ei ole Onglyza annuse kohandamine soovitatav. [Vaata Kliiniline farmakoloogia, Farmakokineetika.]
CYP3A4 / 5 ensüümide inhibiitorid
Mõõdukad CYP3A4 / 5 inhibiitorid
Diltiaseem suurendas saksagliptiini ekspositsiooni. Sama mõõduka CYP3A4 / 5 esinemise korral on oodata saksagliptiini plasmakontsentratsiooni sarnast tõusu. inhibiitorid (nt amprenaviir, aprepitant, erütromütsiin, flukonasool, fosamprenaviir, greibimahl ja verapamiil); siiski ei soovitata Onglyza annust kohandada. [Vaata Kliiniline farmakoloogia, Farmakokineetika.]
CYP3A4 / 5 tugevad inhibiitorid
Ketokonasool suurendas saksagliptiini ekspositsiooni märkimisväärselt. Sarnaselt olulist saksagliptiini plasmakontsentratsiooni tõusu on oodata ka teiste tugevate CYP3A4 / 5 inhibiitorite korral. (nt atasanaviir, klaritromütsiin, indinaviir, itrakonasool, nefasodoon, nelfinaviir, ritonaviir, sakvinaviir ja telitromütsiin). Tugeva CYP3A4 / 5 inhibiitoriga manustamisel tuleb Onglyza annus piirata 2,5 mg-ni. [Vaata Annustamine ja manustamine, Tugevad CYP3A4 / 5 inhibiitorid ja Kliiniline farmakoloogia, Farmakokineetika.]
ülaosa
Kasutamine konkreetsetes populatsioonides
Rasedus
B-kategooria rasedus
Rasedatel ei ole piisavalt ja hästi kontrollitud uuringuid. Kuna loomade paljunemisuuringud ei ennusta alati inimese reaktsiooni, tuleks Onglyzat, nagu ka muid diabeediravimeid, kasutada raseduse ajal ainult juhul, kui see on selgelt vajalik.
Saksagliptiin ei olnud ühegi testitud annuse korral teratogeenne tiinetele rottidele ja küülikutele organogeneesi perioodidel manustamisel. Vaagna mittetäielik luustumine, mis on arengu hilinemise vorm, ilmnes rottidel annuses 240 mg / kg ehk umbes 1503 ja 66-kordne kokkupuude inimese saksagliptiini ja aktiivse metaboliidiga, maksimaalse inimesele soovitatava annuse (MRHD) korral 5 mg. Ema mürgisust ja loote kehakaalu vähenemist täheldati saksagliptiini ja aktiivse metaboliidi MRHD-ga võrreldes 7986 ja 328-kordse inimese kokkupuute korral. Küülikute väiksemad luustiku variatsioonid ilmnesid emasloomale toksilises annuses 200 mg / kg ehk umbes 1432 ja 992 korda suurem kui MRHD. Rottidele manustatuna koos metformiiniga ei olnud saksagliptiin teratogeenne ega embrüo surmaga kokkupuutel, mis olid saksagliptiini MRHD-st 21 korda suuremad. Metformiini ja suurema saksagliptiini annuse (109 korda suurem kui saksagliptiin MRHD) kombinatsiooni manustamist seostati craniorachischisis (harv neuraaltoru defekt, mida iseloomustab kolju ja selgroo mittetäielik sulgemine) kahel lootel üksik tamm. Metformiini kontsentratsioonid olid igas kombinatsioonis 4 korda suuremad kui inimese annus 2000 mg päevas.
Emastele rottidele 6. raseduspäevast kuni 20. imetamispäevani manustatud saksagliptiin vähendas isaste ja isaste kehamassi emased järglased ainult emasloomale toksilistes annustes (kokkupuude ≥ 1629 ja 53 korda saksagliptiin ja selle aktiivne metaboliit MRHD). Rottide järglastel, kellele manustati saksagliptiini ükskõik millises annuses, ei täheldatud funktsionaalset ega käitumuslikku toksilisust.
Pärast annustamist tiinetele rottidele läbib saksagliptiin platsenta lootele.
Imetavad emad
Saksagliptiin eritub imetavate rottide piima umbes 1: 1 suhtega plasmakontsentratsioonidega. Ei ole teada, kas saksagliptiin eritub inimese rinnapiima. Kuna paljud ravimid erituvad inimese rinnapiima, tuleb Onglyza manustamisel imetavale naisele olla ettevaatlik.
Kasutamine lastel
Onglyza ohutust ja efektiivsust lastel ei ole kindlaks tehtud.
Geriaatriline kasutamine
Kuues topeltpimedas kontrollitud kliinilises ohutuse ja efektiivsuse uuringus Onglyzaga oli 4148 randomiseeritud patsiendist 634 (15,3%) 65-aastased ja vanemad ning 59 (1,4%) patsiendid olid 75-aastased ja vanemad. 65-aastaste ja nooremate patsientide vahel ei täheldatud üldisi erinevusi ohutuses ega efektiivsuses. Kuigi see kliiniline kogemus ei ole tuvastanud erinevusi eakate ja nooremate patsientide ravivastuses, ei saa välistada mõnede vanemate inimeste suuremat tundlikkust.
Saksagliptiin ja selle aktiivne metaboliit elimineeritakse osaliselt neerude kaudu. Kuna eakatel patsientidel on tõenäolisem neerufunktsiooni langus, tuleb eakate patsientide annuste valimisel neerufunktsiooni põhjal olla ettevaatlik. [Vaata Annustamine ja manustamine, Neerukahjustusega ja Kliiniline farmakoloogia, Farmakokineetika.]
ülaosa
Üleannustamine
Kontrollitud kliinilises uuringus, üks kord päevas, suu kaudu manustatav Onglyza tervetel isikutel annustes kuni 400 mg päevas 2 nädala jooksul (80-kordne MRHD) ei olnud annusest sõltuvaid kliinilisi kõrvaltoimeid ega kliiniliselt olulist mõju QTc-intervallile ega südamele määra.
Üleannustamise korral tuleb alustada patsiendi kliinilise seisundi järgi sobivat toetavat ravi. Saksagliptiin ja selle aktiivne metaboliit eemaldatakse hemodialüüsi teel (23% annusest 4 tunni jooksul).
ülaosa
Kirjeldus
Saksagliptiin on ensüümi DPP4 suukaudselt aktiivne inhibiitor.
Saksagliptiinmonohüdraati kirjeldatakse keemiliselt järgmiselt: (1S, 3S, 5S) -2 - [(2S) -2-amino-2- (3-hüdroksütritsüklo [3.3.1.13,7] dets-1-üül) atsetüül] -2-asabitsüklo [3.1.0] heksaan-3-karbonitriil, monohüdraat või (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino-2 - (3-hüdroksüdamantaan-1-üül) atsetüül] - 2 - asabitsüklo [3.1.0] heksaan - 3 - karbonitriil hüdraat. Empiiriline valem on C18H25N3O2-H2O ja molekulmass on 333,43. Struktuurivalem on järgmine:
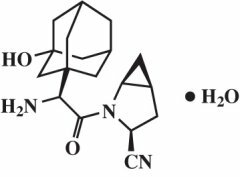
Saksagliptiinmonohüdraat on valge kuni helekollane või helepruun mittehügroskoopne kristalne pulber. See on vees halvasti lahustuv temperatuuril 24 ° C ± 3 ° C, vähelahustuv etüülatsetaadis ja lahustub metanoolis, etanoolis, isopropüülalkoholis, atsetonitriilis, atsetoonis ja polüetüleenglükool 400 (PEG 400).
Üks suukaudseks kasutamiseks mõeldud Onglyza õhukese polümeerikattega tablett sisaldab 2,79 mg sahhagliptiinvesinikkloriidi (veevaba), mis vastab 2,5 mg saksagliptiinile või 5,58 mg saksagliptiinile. vesinikkloriid (veevaba), mis vastab 5 mg saksagliptiinile ja järgmistele mitteaktiivsetele koostisosadele: laktoosmonohüdraat, mikrokristalne tselluloos, kroskarmelloosnaatrium ja magneesiumstearaat. Lisaks sisaldab kilekate järgmisi mitteaktiivseid koostisosi: polüvinüülalkohol, polüetüleenglükool, titaandioksiid, talk ja raudoksiidid.
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Inkretiinhormoonide, näiteks glükagoonilaadse peptiidi-1 (GLP-1) ja glükoosist sõltuvate hormoonide suurenenud kontsentratsioon insulinotroopne polüpeptiid (GIP) vabaneb vereringes peensoolest vastusena sellele söögikorrad. Need hormoonid põhjustavad insuliini vabanemist pankrease beetarakkudest glükoosist sõltuval viisil, kuid ensüüm dipeptidüülpeptidaas-4 (DPP4) inaktiveerib need mõne minuti jooksul. Samuti vähendab GLP-1 glükagooni sekretsiooni pankrease alfarakkudest, vähendades maksa glükoositootmist. II tüüpi diabeediga patsientidel väheneb GLP-1 kontsentratsioon, kuid insuliini vastus GLP-1-le säilib. Saksagliptiin on konkureeriv DPP4 inhibiitor, mis aeglustab inkretiinhormoonide inaktiveerimist, suurendades seeläbi nende vereringet kontsentratsioonid ning tühja kõhu ja söögijärgse glükoosikontsentratsiooni vähendamine glükoosist sõltuval viisil II tüüpi diabeediga patsientidel mellitus.
Farmakodünaamika
II tüüpi suhkurtõvega patsientidel pärsib Onglyza manustamine DPP4 ensüümi aktiivsust 24 tunni jooksul. Pärast suukaudset glükoosisisaldust või sööki põhjustas see DPP4 pärssimine aktiivse aktiivsuse taseme ringluses 2–3-kordset suurenemist GLP-1 ja GIP, vähenenud glükagooni kontsentratsioon ja suurenenud glükoosist sõltuv insuliini sekretsioon pankrease beetarakkudest. Insuliini tõus ja glükagooni vähenemine olid seotud madalama tühja kõhu glükoosikontsentratsiooni ja vähenenud glükoosiekskursiooniga pärast suukaudset glükoosisisaldust või sööki.
Südame elektrofüsioloogia
Randomiseeritud, topeltpimedas, platseebokontrollitud, 4-suunalises ristsuunalises aktiivses võrdlusuuringus, kus kasutati moksifloksatsiini 40 tervel isikul, Onglyza'ga ei seostatud QTc-intervalli või südame löögisageduse kliiniliselt olulist pikenemist ööpäevaste annuste korral kuni 40 mg (8 korda suurem kui MRHD).
Farmakokineetika
Saksagliptiini ja selle aktiivse metaboliidi 5-hüdroksüsaksagliptiini farmakokineetika oli tervetel isikutel ja II tüüpi suhkurtõvega patsientidel sarnane. Cmax Saksagliptiini ja selle aktiivse metaboliidi AUC ja AUC väärtused suurenesid proportsionaalselt annuste vahemikus 2,5 kuni 400 mg. Pärast 5 mg saksagliptiini ühekordse suukaudse annuse manustamist tervetele isikutele olid saksagliptiini ja selle aktiivse metaboliidi keskmised AUC väärtused vastavalt 78 ng-h / ml ja 214 ng-h / ml. Vastav plasma Cmax väärtused olid vastavalt 24 ng / ml ja 47 ng / ml. AUC ja C keskmine varieeruvus (% CV)max nii saksagliptiini kui ka selle aktiivse metaboliidi sisaldus oli alla 25%.
Korduval üks kord päevas manustamisel suvalise annuse korral ei täheldatud saksagliptiini ega selle aktiivse metaboliidi märkimisväärset kuhjumist. Saksagliptiini ja selle aktiivse metaboliidi kliirensil 14 päeva jooksul kord päevas manustamisel saksagliptiini annustes vahemikus 2,5 kuni 400 mg ei täheldatud annusest ja ajast sõltuvust.
Imendumine
Keskmine aeg maksimaalse kontsentratsioonini (Tmax) pärast 5 mg üks kord ööpäevas manustamist oli 2 tundi saksagliptiini ja 4 tundi selle aktiivse metaboliidi jaoks. Manustamine koos rasvasisaldusega toiduga suurendas T-sisaldustmax saksagliptiini sisaldus umbes 20 minutit tühja kõhuga võrreldes. Söögikorra ajal saksagliptiini AUC suurenes 27%, võrreldes tühja kõhuga. Onglyza't võib manustada koos toiduga või ilma.
Levitamine
Saksagliptiini ja selle aktiivse metaboliidi in vitro seondumine valkudega on ebaoluline. Seetõttu ei tohiks eeldada, et vere valgu taseme muutused erinevates haigusseisundites (nt neeru- või maksapuudulikkus) muudaksid saksagliptiini dispositsiooni.
Ainevahetus
Saksosagliptiini metabolismi vahendab peamiselt tsütokroom P450 3A4 / 5 (CYP3A4 / 5). Saksagliptiini peamine metaboliit on samuti DPP4 inhibiitor, mis on pool sama tugev kui saksagliptiin. Seetõttu muudavad tugevad CYP3A4 / 5 inhibiitorid ja indutseerijad saksagliptiini ja selle aktiivse metaboliidi farmakokineetikat. [Vaata Ravimite koostoimed.]
Eritumine
Saksagliptiin elimineeritakse nii neerude kui maksa kaudu. Pärast ühekordset 50 mg annust 14C-saksagliptiin, 24%, 36% ja 75% annusest eritus uriiniga vastavalt saksagliptiinina, selle aktiivse metaboliidina ja kogu radioaktiivsusega. Saksagliptiini keskmine renaalne kliirens (~ 230 ml / min) oli suurem kui keskmine hinnanguline glomerulaarfiltratsiooni kiirus (~ 120 ml / min), mis viitab aktiivsele neerude eritumisele. Kokku 22% manustatud radioaktiivsusest eritus väljaheitega, mis moodustas sapis sisalduva saksagliptiini annuse osa, mis eritus sapiga ja / või imendumata ravimiga seedetraktist. Pärast ühekordse 5 mg Onglyza suukaudse annuse manustamist tervetele isikutele oli plasma keskmine poolväärtusaeg (t1/2) saksagliptiini ja selle aktiivse metaboliidi sisaldus oli vastavalt 2,5 ja 3,1 tundi.
Konkreetsed populatsioonid
Neerukahjustus
Saksagliptiini (10 mg annus) farmakokineetikat hinnati üheannuselises avatud uuringus erineva raskusastmega kroonilise neerukahjustusega isikud (N = 8 rühma kohta), võrreldes normaalse neerukahjustusega inimestega funktsiooni. Uuringus osales neerukahjustusega patsiente, kes olid kreatiniini kliirensi põhjal klassifitseeritud kergeks (> 50 kuni â ¤ 80) ml / min), mõõdukas (30 kuni –50 μl / min) ja raske (<30 ml / min) ning lõppstaadiumis neeruhaigusega patsiendid hemodialüüs. Kreatiniini kliirensit hinnati seerumi kreatiniinist Cockcroft-Gault valemi põhjal:
CrCl = [140 vanus (aastates)] kaal (kg) {0,85 naispatsientide jaoks}
[72 creat seerumi kreatiniini (mg / dL)]
Neerukahjustuse määr C-d ei mõjutanudmax saksagliptiin või selle aktiivne metaboliit. Kerge neerukahjustusega isikutel olid saksagliptiini ja selle aktiivse metaboliidi AUC väärtused vastavalt 20% ja 70% kõrgemad kui normaalse neerufunktsiooniga inimestel. Kuna selle ulatuse suurenemist ei peeta kliiniliselt oluliseks, ei ole kerge neerukahjustusega patsientidel soovitatav annust kohandada. Mõõduka või raske neerukahjustusega isikutel saksagliptiini ja selle aktiivse AUC väärtused metaboliidid olid vastavalt 2,1 ja 4,5 korda kõrgemad kui normaalse neeruga isikutel AUC funktsiooni. Saksagliptiini ja selle aktiivse metaboliidi plasmakontsentratsiooni saavutamiseks sarnaselt normaalse neerufunktsiooniga patsientidele on soovitatav annus on 2,5 mg üks kord päevas mõõduka ja raske neerukahjustusega patsientidel, samuti lõppstaadiumis vajava neeruhaigusega patsientidel hemodialüüs. Saksagliptiin eemaldatakse hemodialüüsi teel.
Maksakahjustus
Maksakahjustusega isikutel (Child-Pugh klassid A, B ja C), keskmine Cmax Pärast saksagliptiini ühekordse 10 mg annuse manustamist olid saksagliptiini AUC ja AUC vastavalt 8% ja 77% kõrgemad kui tervete kontrollitud kontrollidega. Vastav Cmax Aktiivse metaboliidi AUC ja AUC olid vastavalt 59% ja 33% madalamad võrreldes tervete kontrollitud kontrollidega. Neid erinevusi ei peeta kliiniliselt olulisteks. Maksakahjustusega patsientidel ei soovitata annust kohandada.
Kehamassiindeks
Annuse kohandamist ei soovitata lähtuda kehamassiindeksist (KMI), mida ei peetud oluliseks saksagliptiini või selle aktiivse metaboliidi ilmse kliirensi muutused populatsiooni farmakokineetikas analüüs.
Sugu
Soost lähtuvalt ei soovitata annust kohandada. Saksaliptiini farmakokineetikas meeste ja naiste vahel erinevusi ei täheldatud. Võrreldes meestega oli naistel aktiivse metaboliidi ekspositsiooni väärtus umbes 25% kõrgem kui meestel, kuid tõenäoliselt pole sellel erinevusel kliinilist tähtsust. Populatsiooni farmakokineetilises analüüsis ei tuvastatud sugu saksagliptiini ja selle aktiivse metaboliidi ilmse kliirensi oluliseks muutujaks.
Geriaatriline
Ainult vanuse põhjal ei soovitata annust kohandada. Eakatel (65–80-aastastel) oli geomeetriline keskmine C 23% ja 59% kõrgemmax Saksagliptiini AUC ja geomeetrilise keskmise AUC väärtused vastavalt noorte katsealuste (18–40-aastased) puhul. Eakate ja noorte katsealuste metaboliitide farmakokineetika erinevused kajastasid üldiselt saksagliptiini farmakokineetika erinevusi. Saksagliptiini ja aktiivse metaboliidi farmakokineetika erinevus noortel ja eakatel Katsealused on tõenäoliselt tingitud mitmest tegurist, sealhulgas neerufunktsiooni langusest ja metaboolsest võimekusest koos vanuse suurenemine. Populatsiooni farmakokineetilises analüüsis ei tuvastatud vanust saksagliptiini ja selle aktiivse metaboliidi kliirensi olulise muutujana
Pediaatriline
Saksasagliptiini farmakokineetikat iseloomustavaid uuringuid lastel ei ole läbi viidud.
Rass ja rahvus
Rassi alusel ei soovitata annust kohandada. Populatsiooni farmakokineetilises analüüsis võrreldi saksagliptiini ja selle toimeaine farmakokineetikat metaboliit 309 Kaukaasia subjektil, kellel oli 105 mittekaukaasialast (koosneb kuuest rassist) rühmad). Nende kahe populatsiooni vahel saksagliptiini ja selle aktiivse metaboliidi farmakokineetikas olulisi erinevusi ei tuvastatud.
Ravimite ja ravimite koostoimed
Ravimi koostoime in vitro hindamine
Saksagliptiini metabolismi vahendab peamiselt CYP3A4 / 5.
In vitro uuringutes ei pärssinud saksagliptiin ja selle aktiivne metaboliit CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 ega 3A4 ega indutseerinud CYP1A2, 2B6, 2C9 ega 3A4. Seetõttu ei tohiks saksagliptiin eeldada, et need ensüümid metaboliseerivad samaaegselt manustatavate ravimite metaboolset kliirensit. Saksagliptiin on P-glükoproteiini (P-gp) substraat, kuid ei ole oluline P-gp inhibiitor ega indutseerija.
Saksagliptiini ja selle aktiivse metaboliidi in vitro seondumine valkudega on ebaoluline. Seega ei avaldaks valkudega seondumine olulist mõju saksagliptiini või teiste ravimite farmakokineetikale.
Ravimi koostoime hindamine in vivo
Saksagliptiini mõju teistele ravimitele
Tervetel isikutel, nagu allpool kirjeldatud, läbi viidud uuringutes ei muutnud saksagliptiin oluliselt metformiini, glüburiidi, pioglitasooni, digoksiini, simvastatiini, diltiaseemi või ketokonasooli farmakokineetikat.
Metformiin: saksagliptiini (100 mg) ja metformiini (1000 mg), mis on hOCT-2 substraat, ühekordne manustamine ei muutnud tervetel isikutel metformiini farmakokineetikat. Seetõttu ei ole Onglyza hOCT-2 vahendatud transpordi inhibiitor.
Glüburiid: CYP2C9 substraadi saksagliptiini (10 mg) ja glüburiidi (5 mg) ühekordse annuse manustamine suurendas plasma Cmax glüburiidi 16%; glüburiidi AUC ei muutunud. Seetõttu ei pärssi Onglyza olulisel määral CYP2C9 vahendatud metabolismi.
Pioglitasoon: saksagliptiini (10 mg) ja pioglitasooni (45 mg), mis on CYP2C8 substraat, korduvate üks kord päevas manustatavate ravimite samaaegne manustamine suurendas plasma Cmax pioglitasooni sisaldus 14%; pioglitasooni AUC ei muutunud.
Digoksiin: saksagliptiini (10 mg) ja digoksiini (0,25 mg), mis on P-gp substraat, korduv üks kord päevas manustamine ei muutnud digoksiini farmakokineetikat. Seetõttu ei ole Onglyza P-gp-vahendatud transpordi inhibiitor ega indutseerija.
Simvastatiin: saksagliptiini (10 mg) ja simvastatiini (40 mg), mis on CYP3A4 / 5 substraat, korduv üks kord päevas manustamine ei muutnud simvastatiini farmakokineetikat. Seetõttu ei ole Onglyza CYP3A4 / 5 vahendatud metabolismi inhibiitor ega indutseerija.
Diltiaseem: CYP3A4 / 5 mõõduka inhibiitori saksagliptiini (10 mg) ja diltiaseemi (püsivalt püsivalt toimiv 360 mg ravimvorm) üks kord päevas manustamine suurendas plasma Cmax diltiaseemi sisaldus 16%; diltiaseemi AUC ei muutunud.
Ketokonasool: saksagliptiini (100 mg) ühekordse annuse ja ketokonasooli korduva annuse (200 mg iga 12 tunni järel) manustamine koos tasakaalukontsentratsioon), mis on tugev CYP3A4 / 5 ja P-gp inhibiitor, vähendas ketokonasooli plasmakontsentratsiooni Cmax ja AUC 16% ja 13%, vastavalt.
Muude ravimite toime saksagliptiinile
Metformiin: saksagliptiini (100 mg) ja metformiini (1000 mg), mis on hOCT-2 substraat, ühekordne manustamine vähendas Cmax saksagliptiini sisaldus 21%; AUC aga ei muutunud.
Glüburiid: CYP2C9 substraadi saksagliptiini (10 mg) ja glüburiidi (5 mg) ühekordse annuse manustamine suurendas Cmax saksagliptiini sisaldus 8%; saksagliptiini AUC ei muutunud.
Pioglitasoon: saksagliptiini (10 mg) ja pioglitasooni korduvate üks kord päevas manustatavate ravimite samaaegne manustamine (45 mg), CYP2C8 (peamine) ja CYP3A4 (väiksem) substraat ei muutnud ravimi farmakokineetikat. saksagliptiin.
Digoksiin: saksagliptiini (10 mg) ja digoksiini (0,25 mg) korduv manustamine koos P-gp substraadiga üks kord päevas ei muutnud saksagliptiini farmakokineetikat.
Simvastatiin: saksagliptiini (10 mg) ja simvastatiini (40 mg), mis on CYP3A4 / 5 substraat, ühekordne korduv manustamine suurendas Cmax saksagliptiini sisaldus 21%; saksagliptiini AUC ei muutunud.
Diltiaseem: Mõõdukas CYP3A4 / 5 inhibiitori saksagliptiini (10 mg) ja diltiaseemi (püsivas seisundis 360 mg pikaajaline ravimvorm) samaaegne manustamine suurendas Cmax saksagliptiin 63% ja AUC 2,1 korda. Seda seostati vastava C langusegamax ja aktiivse metaboliidi AUC vastavalt 44% ja 36%.
Ketokonasool: saksagliptiini (100 mg) ja ketokonasooli (200 mg iga 12 tunni järel püsikontsentratsiooni faasis), mis on tugev CYP3A4 / 5 ja P-gp inhibiitor, samaaegne manustamine suurendas Cmax saksagliptiini puhul 62% ja AUC 2,5 korda. Seda seostati vastava C langusegamax ja aktiivse metaboliidi AUC vastavalt 95% ja 91%.
Ühes teises uuringus suurendas saksagliptiini (20 mg) ja ketokonasooli (200 mg iga 12 tunni järel püsikontsentratsiooni korral) ühekordse annuse samaaegne manustaminemax Saksagliptiini AUC ja AUC vastavalt 2,4 ja 3,7 korda. Seda seostati vastava C langusegamax ja aktiivse metaboliidi AUC vastavalt 96% ja 90%.
Rifampiin: saksagliptiini (5 mg) ja rifampiini (600 mg QD püsikontsentratsiooni korral) ühekordse annuse manustamine vähendas Cmax saksagliptiini AUC ja AUC vastavalt 53% ja 76%, vastavalt C tõusmax (39%), kuid aktiivse metaboliidi plasma AUC ei muutu märkimisväärselt.
Omeprasool: saksagliptiini (10 mg) ja omeprasooli (40 mg), CYP2C19, korduvate üks kord päevas manustatavate ravimite samaaegne manustamine (peamine) ja CYP3A4 substraat, CYP2C19 inhibiitor ja MRP-3 indutseerija, ei muutnud ravimi farmakokineetikat. saksagliptiin.
Alumiiniumhüdroksiid + magneesiumhüdroksiid + simetikoon: saksagliptiini (10 mg) ja vedelik, mis sisaldas alumiiniumhüdroksiidi (2400 mg), magneesiumhüdroksiidi (2400 mg) ja simetikooni (240 mg), vähendas Cmax saksagliptiin 26%; saksagliptiini AUC ei muutunud.
Famotidiin: saksagliptiini (10 mg) ühekordse annuse manustamine 3 tundi pärast hOTT-1, hOCT-2 ja hOCT-3 inhibiitori famotidiini (40 mg) ühekordset annust, suurendas Cmax saksagliptiini sisaldus 14%; saksagliptiini AUC ei muutunud.
ülaosa
Mittekliiniline toksikoloogia
Kantserogenees, mutagenees, viljakuse langus
Saksagliptiin ei indutseerinud kasvajaid ei hiirtel (50, 250 ja 600 mg / kg) ega rottidel (25, 75, 150 ja 300 mg / kg) kõrgeimate hinnatud annuste korral. Suurimad hiirtel hinnatud annused olid ekvivalentsed umbes 870 (isased) ja 1165 (emased) kordade korral, kui inimese kokkupuude inimese MRHD-ga oli 5 mg / päevas. Rottidel oli kokkupuude umbes 355 (isased) ja 2217 (emased) korda suurem kui MRHD.
In vitro Ames'i bakterianalüüs, in vitro tsütogeneetika test, in vitro tsütogeneetika test, saksagliptiin ei olnud mutageenne ega klastogeenne lümfotsüüdid, in vivo suukaudse mikrotuuma test rottidel, in vivo oraalse DNA parandamise uuring rottidel ja oraalne in vivo / in vitro tsütogeneetika uuring roti perifeerses veres lümfotsüüdid. Aktiivne metaboliit ei olnud in vitro Ames'i bakterianalüüsis mutageenne.
Rottide fertiilsusuuringus raviti isaseid suu kaudu manustatavate annustega 2 nädalat enne paaritamist, paaritamise ajal ja kuni katkestamine (kokku umbes 4 nädalat) ja naisi raviti suukaudsete sondiannustega 2 nädalat enne tiinuse paaritumist 7. päev. Ligikaudu 603 (meestel) ja 776 (naistel) korduva MRHDga kokkupuute korral ei täheldatud kahjulikku mõju fertiilsusele. Suuremad annused, mis tekitasid emasloomale toksilisuse, suurendasid ka loote resorptsiooni (umbes 2069 ja 6138 korda suurem kui MRHD). Täiendavat mõju estrilisele tsüklite toimumisele, viljakusele, ovulatsioonile ja implanteerimisele täheldati MRHD umbes 6138-kordselt.
Loomade toksikoloogia
Saksagliptiin põhjustas kahjulikke nahamuutusi cynomolgus ahvide jäsemetes (kärnad ja / või saba, numbrite, munandikotti ja / või ninahaavandid). Nahakahjustused olid pöörduvad MRHD-st 20-kordselt, kuid mõnel juhul olid need kõrgema ekspositsiooni korral pöördumatud ja nekrotiseerivad. 5 mg MRHD-ga sarnase (1 kuni 3-kordse) kokkupuute korral ei täheldatud naha kahjulikke muutusi. Saksakipiptiini kliinilistes uuringutes ei ole ahvide nahakahjustustega kliiniliselt seotud.
ülaosa
Kliinilised uuringud
Onglyzat on uuritud monoteraapiana ning kombinatsioonis metformiini, glüburiidi ja tiasolidiindioonraviga (pioglitasoon ja rosiglitasoon). Onglyza kasutamist koos insuliiniga ei ole uuritud.
Kuues topeltpimedas kontrollitud kliinilises uuringus, mis viidi läbi Onglyza ohutuse ja glükeemilise tõhususe hindamiseks, randomiseeriti kokku 4148 II tüüpi suhkurtõvega patsienti. Nendes uuringutes raviti Onglyzaga kokku 3021 patsienti. Nendes uuringutes oli keskmine vanus 54 aastat ja 71% patsientidest olid kaukaaslased, 16% aasialased, 4% mustanahalised ja 9% teistest rassirühmadest. Täiendavad 423 patsienti, sealhulgas 315, kes said Onglyzat, osalesid platseebo-kontrollitud, annusevahemikuga uuringus, mille kestus oli 6 kuni 12 nädalat.
Nendes kuues topeltpimedas uuringus hinnati Onglyza annustes 2,5 mg ja 5 mg üks kord päevas. Nendest uuringutest kolmes hinnati ka saksagliptiini annust 10 mg päevas. 10 mg saksagliptiini ööpäevane annus ei andnud suuremat efektiivsust kui 5 mg ööpäevane annus. Ravi Onglyzaga kõigis annustes põhjustas kliiniliselt olulist ja statistiliselt olulist hemoglobiini A1c (A1C) paranemist, tühja kõhuga plasma glükoos (FPG) ja 2-tunnine söögijärgne glükoos (PPG) pärast standardset suukaudset glükoositaluvuse testi (OGTT), võrreldes kontroll. A1C langust täheldati alarühmade lõikes, sealhulgas sugu, vanus, rass ja BMI algväärtus.
Onglyza'ga ei seostatud platseeboga võrreldes olulisi kehakaalu või tühja kõhu seerumi lipiidide muutusi algtasemest.
Monoteraapia
Kokku 766 II tüüpi diabeediga patsienti, kelle toitumine ja füüsiline koormus ei olnud piisav (A1C - 7–10%) osales kahes 24-nädalases topeltpimedas, platseebokontrollitud uuringus, milles hinnati Onglyza efektiivsust ja ohutust monoteraapia.
Esimeses uuringus jaotati 401 patsienti kahenädalase ühe pimeda dieedi, treeningu ja platseebo sissejuhatava perioodi järel 2,5 mg, 5 mg või 10 mg Onglyza või platseebo rühmas. Patsiente, kes ei suutnud uuringu ajal konkreetseid glükeemilisi eesmärke täita, raviti päästeraviga metformiiniga, millele lisati platseebo või Onglyza. Efektiivsust hinnati päästmist vajavate patsientide viimasel mõõtmisel enne päästeravi. Onglyza annuse tiitrimine ei olnud lubatud.
Ravi Onglyza 2,5 mg ja 5 mg ööpäevas andis platseeboga võrreldes märkimisväärset paranemist A1C, FPG ja PPG (tabel 3). Patsientide protsent, kes katkestasid glükeemilise kontrolli puudumise tõttu või kes päästeti vastavalt ettekirjutusele glükeemiline kriteerium oli Onglyza 2,5 mg ravirühmas 16%, Onglyza 5 mg ravirühmas 20% ja 26% platseeborühm.
Tabel 3: glükeemilised parameetrid 24. nädalal platseebokontrollitud Onglyza monoteraapia uuringus II tüüpi diabeediga patsientidel *
| Efektiivsuse parameeter | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Platseebo N = 95 |
|---|---|---|---|
| * Ravi kavatsev populatsioon, kes kasutab päästmist vajavate patsientide uuringus viimast vaatlust või viimast vaatlust enne metformiiniga päästeravi. | |||
| †Alumiste väärtustega kohandatud väikseim ruutude keskmine väärtus. | |||
| c p-väärtus <0,0001 võrreldes platseeboga | |||
| § p-väärtus <0,05 võrreldes platseeboga | |||
| ¶ Onglyza 2,5 mg annuse 2-tunnise PPG olulisust ei testitud. | |||
| Hemoglobiini A1C (%) | N = 100 | N = 103 | N = 92 |
| Baasjoon (keskmine) | 7.9 | 8.0 | 7.9 |
| Muutus algtasemest (korrigeeritud keskmine†) | −0.4 | −0.5 | +0.2 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −0.6c | −0.6c | |
| 95% usaldusvahemik | (−0.9, −0.3) | (−0.9, −0.4) | |
| Protsent patsientidest, kes saavutasid A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Tühja kõhuga plasma glükoos (mg / dL) | N = 101 | N = 105 | N = 92 |
| Baasjoon (keskmine) | 178 | 171 | 172 |
| Muutus algtasemest (korrigeeritud keskmine†) | −15 | −9 | +6 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −21 § | −15 § | |
| 95% usaldusvahemik | (−31, −10) | (−25, −4) | |
| 2-tunnine söögijärgne glükoos (mg / dL) | N = 78 | N = 84 | N = 71 |
| Baasjoon (keskmine) | 279 | 278 | 283 |
| Muutus algtasemest (korrigeeritud keskmine†) | −45 | −43 | −6 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −39 ¶ | −37 § | |
| 95% usaldusvahemik | (−61, −16) | (−59, −15) |
Onglyza annustamisskeemide hindamiseks viidi läbi teine 24-nädalane monoteraapia uuring. Ebapiisavalt kontrollitud diabeediga patsiendid, kes ei olnud ravi saanud (A1C - 7–10%), läbisid kahenädalase ühekordse pimeda dieedi, treeningu ja platseebo sissejuhatava perioodi. Kokku 365 patsienti randomiseeriti 2,5 mg-ni igal hommikul, 5 mg-ni igal hommikul, 2,5 mg-ni võimaliku tiitrimisega kuni 5 mg-ni igal hommikul või 5 mg-ni igal õhtul Onglyza või platseeboga. Patsiente, kes ei saavutanud uuringu ajal konkreetseid glükeemilisi eesmärke, raviti metformiiniga, mis lisati platseebole või Onglyzale; randomiseeritud patsientide arv ravigrupi kohta oli vahemikus 71-74.
Ravi Onglyza 5 mg igal hommikul või 5 mg igal õhtul parandas märkimisväärselt A1C-d võrreldes platseeboga (vastavalt platseebo korrigeeritud keskmine vähenemine vastavalt 0,4% ja 0,3%). Ravi Onglyza 2,5 mg-ga igal hommikul parandas ka A1C-d märkimisväärselt võrreldes platseeboga (platseeboga korrigeeritud keskmine langus –0,4%).
Kombineeritud ravi
Täiendav kombineeritud ravi metformiiniga
Selles 24-nädalases randomiseeritud topeltpimedas platseebo-kontrollitud uuringus osales 743 II tüüpi diabeediga patsienti Onglyza efektiivsus ja ohutus kombinatsioonis metformiiniga patsientidel, kelle glükeemiline kontroll on ebapiisav (A1C â ¥% 7% ja 10 ¤ 10%) metformiiniga üksi. Registreerimiseks kvalifitseerumiseks pidid patsiendid saama vähemalt 8 nädala jooksul stabiilset metformiini annust (1500-2550 mg päevas).
Patsiendid, kes vastasid kõlblikkuskriteeriumidele, lülitati sissejuhatusesse ühe pimeda, kahenädalase dieedi ja treeninguga periood, mille jooksul patsiendid said metformiini uuringueelses annuses, kuni 2500 mg ööpäevas, kogu selle perioodi vältel Uuring. Pärast sissejuhatavat perioodi randomiseeriti kõlblikud patsiendid lisaks praegusele avatud metformiini annusele juhuslikult 2,5 mg, 5 mg või 10 mg Onglyza'le või platseebole. Patsiente, kes ei suutnud uuringu ajal konkreetseid glükeemilisi eesmärke täita, raviti pioglitasooniga päästeravi abil, millele lisati olemasolevaid uuringuravimeid. Onglyza ja metformiini annuste tiitrimine ei olnud lubatud.
Onglyza 2,5 mg ja 5 mg lisamine meformiinile andis A1C, FPG ja PPG olulist paranemist võrreldes platseebo lisamisega metformiinile (tabel 4). A1C keskmised muutused algtasemest aja jooksul ja lõpp-punktis on näidatud joonisel 1. Patsientide osakaal, kes katkestasid glükeemilise kontrolli puudumise tõttu või kes päästeti ettenähtud glükeemiliste kriteeriumide täitmise tõttu, oli 15% Onglyza 2,5 mg lisamisel metformiinirühmale, 13% Onglyza 5 mg lisamisel metformiini rühmas ja 27% platseebo lisandil metformiinile Grupp.
Tabel 4: glükeemilised parameetrid 24. nädalal platseebokontrollitud Onglyza-uuringus metformiiniga täiendava kombinatsioonravina *
| Efektiivsuse parameeter | Onglyza 2,5 mg + Metformiin N = 192 |
Onglyza 5 mg + Metformiin N = 191 |
Platseebo + Metformiin N = 179 |
|---|---|---|---|
| * Ravi kavatsev elanikkond, kasutades viimast uuringu vaatlust või viimast vaatlust enne pioglitasooni päästeravi patsientidel, kes vajavad päästmist. | |||
| †Alumiste väärtustega kohandatud väikseim ruutude keskmine väärtus. | |||
| c p-väärtus <0,0001 võrreldes platseebo + metformiiniga | |||
| § p-väärtus <0,05 võrreldes platseebo + metformiiniga | |||
| Hemoglobiini A1C (%) | N = 186 | N = 186 | N = 175 |
| Baasjoon (keskmine) | 8.1 | 8.1 | 8.1 |
| Muutus algtasemest (korrigeeritud keskmine†) | −0.6 | −0.7 | +0.1 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −0.7c | −0.8c | |
| 95% usaldusvahemik | (−0.9, −0.5) | (−1.0, −0.6) | |
| Protsent patsientidest, kes saavutasid A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Tühja kõhuga plasma glükoos (mg / dL) | N = 188 | N = 187 | N = 176 |
| Baasjoon (keskmine) | 174 | 179 | 175 |
| Muutus algtasemest (korrigeeritud keskmine†) | −14 | −22 | +1 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −16 § | −23 § | |
| 95% usaldusvahemik | (−23, −9) | (−30, −16) | |
| 2-tunnine söögijärgne glükoos (mg / dL) | N = 155 | N = 155 | N = 135 |
| Baasjoon (keskmine) | 294 | 296 | 295 |
| Muutus algtasemest (korrigeeritud keskmine†) | −62 | −58 | −18 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −44 § | −40 § | |
| 95% usaldusvahemik | (−60, −27) | (−56, −24) |
Joonis 1: Keskmine muutus algtasemest A1C-s platseebokontrollitud Onglyza-uuringus metformiiniga täiendava kombinatsioonravina *
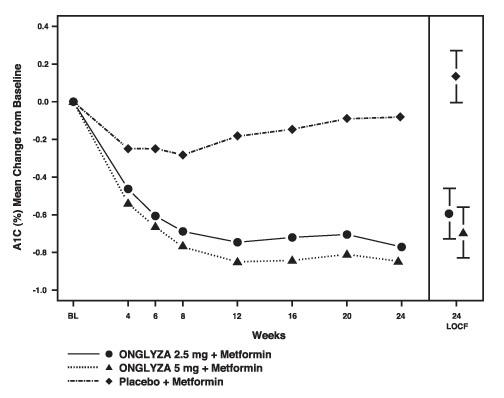
* Hõlmab patsiente, kelle väärtus on algtase ja 24. nädal.
24. nädal (LOCF) hõlmab ravi kavatsetavat elanikkonda, kasutades viimast uuringu vaatlust enne pioglitasooni päästeravi patsientidel, kes vajavad päästmist. Keskmine muutus algtasemest korrigeeritakse algväärtusega.
Täiendav kombinatsioonravi tiasolidiindiooniga
Selles 24-nädalases randomiseeritud topeltpimedas platseebo-kontrollitud uuringus osales 565 II tüüpi diabeediga patsienti Onglyza efektiivsus ja ohutus kombinatsioonis tiasolidiindiooniga (TZD) patsientidel, kelle glükeemiline tase on ebapiisav (A1C - 7% kuni 10,5%) Ainuüksi TZD. Registreerimiseks kvalifitseerumiseks pidid patsiendid saama stabiilset pioglitasooni annust (30–45 mg üks kord päevas). või rosiglitasoon (4 mg üks kord päevas või 8 mg kas üks kord päevas või kaheks jagatud 4 mg annuseks) vähemalt 12 nädalat.
Patsiendid, kes vastasid kõlblikkuskriteeriumidele, kaasati ühe pimeda kahenädalase dieedi ja treeningu juurde platseebo sissejuhatav periood, mille jooksul patsiendid said TZD uuringueelses annuses kogu raviperioodi vältel Uuring. Pärast sissejuhatavat perioodi randomiseeriti kõlblikud patsiendid lisaks nende praegusele TZD annusele 2,5 mg või 5 mg Onglyza või platseebot. Patsiente, kes ei suutnud uuringu ajal konkreetseid glükeemilisi eesmärke täita, raviti metformiiniga, millele lisati olemasolevad uuringuravimid. Onglyza või TZD annuse tiitrimine ei olnud uuringu ajal lubatud. TZD režiimi muutmine rosiglitasoonist pioglitasooniks täpsustatud, samaväärsetes terapeutilistes annustes lubati uurija äranägemisel, kui seda peetakse meditsiiniliselt sobivaks.
Onglyza 2,5 mg ja 5 mg lisamine TZD-le andis A1C, FPG ja PPG olulist paranemist võrreldes TZD platseebo lisamisega (tabel 5). Nende patsientide osakaal, kes katkestasid glükeemilise kontrolli puudumise tõttu või kes päästeti ettenähtud glükeemiliste kriteeriumide täitmise tõttu oli 10% Onglyza 2,5 mg lisamisel TZD rühmale, 6% Onglyza 5 mg lisamisel TZD rühmale ja 10% platseebo lisandil TZD rühmale Grupp.
Tabel 5: glükeemilised parameetrid 24. nädalal platseebokontrollitud uuringus Onglyza kasutamisel koos tiasolidiindiooniga kombineeritud raviga *
| Efektiivsuse parameeter | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Platseebo + TZD N = 184 |
|---|---|---|---|
| * Ravi kavatsev populatsioon, kes kasutab päästmist vajavate patsientide uuringus viimast vaatlust või viimast vaatlust enne metformiiniga päästeravi. | |||
| †Alumiste väärtustega kohandatud väikseim ruutude keskmine väärtus. | |||
| c p-väärtus <0,0001 võrreldes platseebo + TZD-ga | |||
| § p-väärtus <0,05 võrreldes platseebo + TZD-ga | |||
| Hemoglobiini A1C (%) | N = 192 | N = 183 | N = 180 |
| Baasjoon (keskmine) | 8.3 | 8.4 | 8.2 |
| Muutus algtasemest (korrigeeritud keskmine†) | −0.7 | −0.9 | −0.3 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −0.4 § | −0.6c | |
| 95% usaldusvahemik | (−0.6, −0.2) | (−0.8, −0.4) | |
| Protsent patsientidest, kes saavutasid A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Tühja kõhuga plasma glükoos (mg / dL) | N = 193 | N = 185 | N = 181 |
| Baasjoon (keskmine) | 163 | 160 | 162 |
| Muutus algtasemest (korrigeeritud keskmine†) | −14 | −17 | −3 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −12 § | −15 § | |
| 95% usaldusvahemik | (−20, −3) | (−23, −6) | |
| 2-tunnine söögijärgne glükoos (mg / dL) | N = 156 | N = 134 | N = 127 |
| Baasjoon (keskmine) | 296 | 303 | 291 |
| Muutus algtasemest (korrigeeritud keskmine†) | −55 | −65 | −15 |
| Erinevus platseebost (korrigeeritud keskmine)†) | −40 § | −50 § | |
| 95% usaldusvahemik | (−56, −24) | (−66, −34) |
Täiendav kombinatsioonravi glüburiidiga
Selles 24-nädalases randomiseeritud topeltpimedas platseebo-kontrollitud uuringus osales 768 II tüüpi diabeediga patsienti, et hinnata efektiivsust ja ohutust Onglyza manustamine kombinatsioonis sulfonüüluureaga (SU) patsientidel, kelle registreerimisel glükeemiline tase on ebapiisav (A1C - 7,5% kuni 10%) SU submaksimaalsel annusel üksi. Registreerimiseks kvalifitseerumiseks pidid patsiendid olema vähemalt 2 kuud submaksimaalses SU annuses. Selles uuringus võrreldi Onglyza kombinatsioonis fikseeritud keskmise vaheannusega SU tiitrimisega kõrgema SU annuseni.
Patsiendid, kes vastasid kõlblikkuskriteeriumidele, kaasati ühe pimeda, 4-nädalase dieedi ja treeningu sissejuhatavasse perioodi ning paigutati 7,5 mg glüburiidi üks kord päevas. Pärast sissejuhatavat perioodi randomiseeriti abikõlblikud patsiendid, kelle A1C oli vahemikus 7–10%, kas 2,5 mg või 5 mg Onglyza lisamist 7,5 mg glüburiidile või platseebole pluss 10 mg ööpäevase koguannusega glüburiid. Platseebot saanud patsiendid võisid glüburiidi tiitrida koguannuseni 15 mg päevas. Glüburiidi tiitrimine ei olnud lubatud patsientidel, kes said Onglyza 2,5 mg või 5 mg. Glüburiidi võib tiitrida ükskõik millises ravirühmas üks kord 24-nädalase uuringuperioodi jooksul hüpoglükeemia tõttu, nagu uurija vajalikuks pidas. Umbes 92% platseebo ja glüburiidi rühma patsientidest suurendati uuringu esimese 4 nädala jooksul lõpliku ööpäevase koguannuseni 15 mg. Patsiente, kes ei suutnud uuringu ajal konkreetseid glükeemilisi eesmärke täita, raviti metformiiniga, millele lisati olemasolevad uuringuravimid. Uuringu ajal ei olnud Onglyza annuse tiitrimine lubatud.
Kombineeritult glüburiidiga andsid 2,5 mg ja 5 mg Onglyza märkimisväärselt paremat A1C, FPG ja PPG sisaldust, võrreldes platseebo pluss tiitritud glüburiidirühmaga (tabel 6). Patsientide osakaal, kes katkestasid glükeemilise kontrolli puudumise tõttu või kes päästeti ettenähtud glükeemiliste kriteeriumide täitmise tõttu, oli 18% Onglyza 2,5 mg lisand glüburiidi rühmas, 17% Onglyza 5 mg lisandis glüburiidi rühmas ja 30% platseebo pluss tiitritud glüburiid Grupp.
Tabel 6: glükeemilised parameetrid 24. nädalal platseebokontrollitud uuringus Onglyza kui täiendav kombineeritud ravi glüburiidiga *
| Efektiivsuse parameeter | Onglyza 2,5 mg + Glüburiid 7,5 mg N = 248 |
Onglyza 5 mg + Glüburiid 7,5 mg N = 253 |
Platseebo + Üles tiitritud glüburiid N = 267 |
|---|---|---|---|
| * Ravi kavatsev populatsioon, kes kasutab päästmist vajavate patsientide uuringus viimast vaatlust või viimast vaatlust enne metformiiniga päästeravi. | |||
| †Alumiste väärtustega kohandatud väikseim ruutude keskmine väärtus. | |||
| c p-väärtus <0,0001 võrreldes platseebo + üles tiitritud glüburiidiga | |||
| § p-väärtus <0,05 võrreldes platseebo + üles tiitritud glüburiidiga | |||
| Hemoglobiini A1C (%) | N = 246 | N = 250 | N = 264 |
| Baasjoon (keskmine) | 8.4 | 8.5 | 8.4 |
| Muutus algtasemest (korrigeeritud keskmine†) | −0.5 | −0.6 | +0.1 |
| Erinevus ülestiitritud glüburiidist (korrigeeritud keskmine†) | −0.6c | −0.7c | |
| 95% usaldusvahemik | (−0.8, −0.5) | (−0.9, −0.6) | |
| Protsent patsientidest, kes saavutasid A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Tühja kõhuga plasma glükoos (mg / dL) | N = 247 | N = 252 | N = 265 |
| Baasjoon (keskmine) | 170 | 175 | 174 |
| Muutus algtasemest (korrigeeritud keskmine†) | −7 | −10 | +1 |
| Erinevus ülestiitritud glüburiidist (korrigeeritud keskmine†) | −8 § | −10 § | |
| 95% usaldusvahemik | (−14, −1) | (−17, −4) | |
| 2-tunnine söögijärgne glükoos (mg / dL) | N = 195 | N = 202 | N = 206 |
| Baasjoon (keskmine) | 309 | 315 | 323 |
| Muutus algtasemest (korrigeeritud keskmine†) | −31 | −34 | +8 |
| Erinevus ülestiitritud glüburiidist (korrigeeritud keskmine†) | −38 § | −42 § | |
| 95% usaldusvahemik | (−50, −27) | (−53, −31) |
Samaaegne ravi metformiiniga varem ravi mitte saanud patsientidel
Selles 24-nädalases randomiseeritud topeltpimedas platseebokontrolliga uuringus osales kokku 1306 II tüüpi suhkurtõvega varem ravi mitte saanud patsienti. hinnake metformiiniga koosmanustatud Onglyza efektiivsust ja ohutust patsientidel, kelle glükeemiline kontroll on ebapiisav (A1C - 8% –12%) dieedil ja treenimisel üksi. Sellesse uuringusse kaasamiseks pidid patsiendid olema ravivabad.
Patsiendid, kes vastasid kõlblikkuskriteeriumidele, kaasati ühe pimeda, 1-nädalase dieedi ja treeningu platseebo sissejuhatavasse perioodi. Patsiendid randomiseeriti ühte neljast ravigrupist: Onglyza 5 mg + metformiin 500 mg, saksagliptiin 10 mg + metformiin 500 mg, saksagliptiin 10 mg + platseebo või metformiin 500 mg + platseebo. Onglyza't manustati üks kord päevas. Kolmes metformiini kasutanud ravirühmas tiitriti metformiini annust igal nädalal 500 mg päevas, vastavalt tolerantsile, maksimaalselt 2000 mg päevas vastavalt FPG-le. Patsiente, kes ei suutnud uuringute ajal konkreetseid glükeemilisi eesmärke täita, raviti lisaravina pioglitasooni päästmisega.
Onglyza 5 mg pluss metformiiniga koosmanustamine parandas märkimisväärselt A1C, FPG ja PPG sisaldust platseebo ja metformiiniga võrreldes (tabel 7).
Tabel 7: Glükeemilised parameetrid 24. nädalal platseebokontrollitud uuringus, milles käsitleti Onglyza manustamist koos metformiiniga varem ravi mitte saanud patsientidel
| Efektiivsuse parameeter | Onglyza 5 mg + Metformiin N = 320 |
Platseebo + Metformiin N = 328 |
|---|---|---|
| * Ravi kavatsev elanikkond, kasutades viimast uuringu vaatlust või viimast vaatlust enne pioglitasooni päästeravi patsientidel, kes vajavad päästmist. | ||
| †Alumiste väärtustega kohandatud väikseim ruutude keskmine väärtus. | ||
| c p-väärtus <0,0001 võrreldes platseebo + metformiiniga | ||
| § p-väärtus <0,05 võrreldes platseebo + metformiiniga | ||
| Hemoglobiini A1C (%) | N = 306 | N = 313 |
| Baasjoon (keskmine) | 9.4 | 9.4 |
| Muutus algtasemest (korrigeeritud keskmine†) | −2.5 | −2.0 |
| Erinevus platseebost + metformiinist (korrigeeritud keskmine†) | −0.5c | |
| 95% usaldusvahemik | (−0.7, −0.4) | |
| Protsent patsientidest, kes saavutasid A1C <7% | 60% §(185/307) | 41% (129/314) |
| Tühja kõhuga plasma glükoos (mg / dL) | N = 315 | N = 320 |
| Baasjoon (keskmine) | 199 | 199 |
| Muutus algtasemest (korrigeeritud keskmine†) | −60 | −47 |
| Erinevus platseebost + metformiinist (korrigeeritud keskmine†) | −13 § | |
| 95% usaldusvahemik | (−19, −6) | |
| 2-tunnine söögijärgne glükoos (mg / dL) | N = 146 | N = 141 |
| Baasjoon (keskmine) | 340 | 355 |
| Muutus algtasemest (korrigeeritud keskmine†) | −138 | −97 |
| Erinevus platseebost + metformiinist (korrigeeritud keskmine†) | −41 § | |
| 95% usaldusvahemik | (−57, −25) |
ülaosa
Kuidas komplektis
Onglyza ™ (saksagliptiin) tablettidel on märgistused mõlemal küljel ning need on saadaval tabelis 8 loetletud tugevuse ja pakendina.
| Tahvelarvuti Tugevus |
Kilega kaetud tablett Värv / kuju |
Tahvelarvuti Märgistused |
Pakendi suurus | NDC kood |
|---|---|---|---|---|
| 5 mg | roosa kaksikkumer, ümmargune |
"5" ühel küljel ja "4215" tagaküljel, sinise tindiga | Pudelid 30-st Pudelid 90-st Pudelid 500 kohta Blister 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | kahvatukollane kuni helekollane kaksikkumer, ümmargune |
"2,5" ühel küljel ja "4214" tagaküljel, sinise tindiga | Pudelid 30-st Pudelid 90-st |
0003-4214-11 0003-4214-21 |
Ladustamine ja käitlemine
Hoida temperatuuril 20–25 ° C (68–77 ° F); ekskursioonid on lubatud temperatuurini 15 ° -30 ° C (59 ° -86 ° F) [vaata USP kontrollitud ruumi temperatuuri].
ülaosa
Viimati värskendatud: 07/09
E. R. Squibb & Sons, L.L.C.
Onglyza patsientide teave
Üksikasjalik teave diabeedi märkide, sümptomite, põhjuste, ravi kohta
Selles monograafias sisalduv teave ei ole mõeldud hõlmama kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet või kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi: Sirvige kõiki diabeediravimeid



