Nuvigil: liigne unisusravi (täielik teave ravimi väljakirjutamise kohta)
Brändinimi: Nuvigil
Üldnimi: armodafiniil
Nuvigil® (armodafiniili) tabletid [C-IV]
Armodafiniil on ärkvelolekut soodustav ravim, mis on saadaval Nuvigilina uneapnoe, narkolepsia või vahetustega töö unehäirete raviks. Kasutamine, annustamine, kõrvaltoimed.
Sisu:
Kirjeldus
Kliiniline farmakoloogia
Kliinilistes uuringutes
Näidustused ja kasutamine
Vastunäidustused
Hoiatused
Ettevaatusabinõud
Kõrvaltoimed
Uimastite kuritarvitamine ja sõltuvus
Üleannustamine
Annustamine ja manustamine
Kuidas komplektis
Nuvigili patsiendi infoleht (lihtsas inglise keeles)
Kirjeldus
NUVIGIL® (armodafiniil) on ärkvelolekut soodustav aine suukaudseks manustamiseks. Armodafiniil on modafiniili R-enantiomeer, mis on R- ja S-enantiomeeride segu. Armodafiniili keemiline nimetus on 2 - [(R) - (difenüülmetüül) sulfinüül] atseetamiid. Molekulvalem on C15H15EI2S ja molekulmass on 273,35.
Keemiline struktuur on:
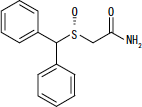
Armodafiniil on valge kuni valkjas kristalne pulber, mis on vees väga halvasti lahustuv, atsetoonis vähe lahustuv ja metanoolis lahustuv. NUVIGIL tabletid sisaldavad 50, 150 või 250 mg armodafiniili ja järgmisi mitteaktiivseid koostisosi: kroskarmelloos naatrium, laktoosmonohüdraat, magneesiumstearaat, mikrokristalne tselluloos, povidoon ja eelželatineeritud tärklis.
ülaosa
Kliiniline farmakoloogia
Toimemehhanism ja farmakoloogia
Täpsed mehhanismid, mille kaudu armodafiniil (R-enantiomeer) või modafiniil (R- ja S-enantiomeeride segu) ärkvelolekut soodustavad, pole teada. Nii armodafiniilil kui ka modafiniilil on mittekliinilistes loomkatsetes ja in vitro uuringutes testitud ulatuses sarnased farmakoloogilised omadused.
jätka lugu allpool
Farmakoloogiliselt olulistes kontsentratsioonides ei seo armodafiniil mitut retseptorit ja ensüümi ega pärssi neid une / ärkveloleku regulatsioon, sealhulgas serotoniini, dopamiini, adenosiini, galaniini, melatoniini, melanokortiini, oreksiin-1, orfaniini, PACAP või bensodiasepiinid või GABA, serotoniini, norepinefriini ja koliini või fosfodiesteraasi VI, COMT, GABA transaminaasi ja türosiini transporterid hüdroksülaas. Modafiniil ei inhibeeri MAO-B ega fosfodiesteraaside II-IV aktiivsust.
Modafiniili indutseeritud ärkvelolekut võib nõrgendada ± 1-adrenergilise retseptori antagonist prasosiin; siiski on modafiniil inaktiivne teistes in vitro testimissüsteemides, mis teadaolevalt reageerivad Î-adrenergilistele agonistidele, näiteks roti vas deferensi preparaadile.
Armodafiniil ei ole otsese ega kaudse toimega dopamiini retseptori agonist. Kuid in vitro seonduvad nii armodafiniil kui ka modafiniil dopamiini transporteriga ja pärsivad dopamiini tagasihaarde. Modafiniili puhul on seda toimet seostatud in vivo rakuvälise dopamiini tasemega loomade mõnes ajupiirkonnas. Geneetiliselt muundatud hiirtel, kellel puudus dopamiini transporter (DAT), puudus modafiniilil ärkvelolekut soodustav toime, mis viitab sellele, et see aktiivsus sõltus DAT-ist. Kuid dopamiini retseptori antagonist haloperidool ei mõjutanud rottidel modafiniili ärkamist soodustavat toimet, erinevalt amfetamiinist.
Lisaks blokeerib dopamiini sünteesi inhibiitor alfa-metüül-p-türosiin amfetamiini toimet, kuid ei blokeeri modafiniili põhjustatud lokomotoorset aktiivsust.
Armodafiniilil ja modafiniilil on ärkamist soodustavad toimed, mis on sarnased sümpatomimeetiliste ainetega, sealhulgas amfetamiiniga ja metüülfenidaat, kuigi nende farmakoloogiline profiil ei ole identne sümpatomimeetikumiga amiinid. Lisaks ärkvelolekut soodustavale toimele ja võimele suurendada loomade liikumisaktiivsust toodab modafiniil teistele kesknärvisüsteemi stimulantidele tüüpilised psühhoaktiivsed ja eufoorilised mõjud, meeleolu, taju, mõtlemise ja tunnete muutused inimestel. Modafiniilil on tugevdavaid omadusi, mida tõendab selle manustamine ahvidele, kes on eelnevalt koolitatud kokaiini ise manustama; modafiniili eristati osaliselt ka stimulantidena.
Mittekliiniliste uuringute põhjal näib, et modafiniili või armodafiniili kaks peamist metaboliiti, hape ja sulfoon, ei aita kaasa lähteühendite kesknärvisüsteemi aktiveerivatele omadustele.
Farmakokineetika
NUVIGILi aktiivne komponent on armodafiniil, mis on modafiniili pikema elueaga enantiomeer. Pärast ühekordse ja korduva suukaudse annuse manustamist on NUVIGILil lineaarne ajast sõltumatu kineetika. Süsteemse ekspositsiooni suurenemine on proportsionaalne annusevahemikus 50 kuni 400 mg. 12-nädalase annustamisaja jooksul kineetilises ajas sõltuvaid muutusi ei täheldatud. NUVIGILi nähtav tasakaalukontsentratsioon saavutati 7 päeva jooksul pärast manustamist. Püsiseisundi korral on NUVIGILi süsteemne ekspositsioon 1,8-kordne kui ühekordse annuse manustamisel. Puhta R-enantiomeeri kontsentratsiooni-aja profiilid pärast 50 mg NUVIGILi või 100 mg PROVIGIL'i manustamist® (modafiniil) on peaaegu üksteisega kokkusobivad.
Imendumine
NUVIGIL imendub pärast suukaudset manustamist kergesti. Armodafiniili vesilahustumatuse tõttu, mis välistas intravenoosse manustamise, absoluutset suukaudset biosaadavust ei määratud. Maksimaalne plasmakontsentratsioon saavutatakse umbes 2 tunniga tühja kõhuga. Toidu mõju NUVIGILi üldisele biosaadavusele peetakse minimaalseks; tippkontsentratsiooni (tmax) võib toitunud olekus viibida umbes 2–4 tundi. Kuna viivitus tmax Samuti on toit hiljem seotud kõrgenenud plasmakontsentratsiooniga, võib toit mõjutada NUVIGILi farmakoloogilise toime algust ja kulgu.
Levitamine
NUVIGILi näiline jaotusruumala on umbes 42 L. Armodafiniili valkudega seondumise andmed puuduvad. Kuid modafiniil on mõõdukalt seotud plasmavalkudega (umbes 60%), peamiselt albumiiniga. NUVIGILi koostoime potentsiaali tugevalt valkudega seotud ravimitega peetakse minimaalseks.
Ainevahetus
In vitro ja in vivo andmed näitavad, et armodafiniil läbib hüdrolüütilist deamidatsiooni, S-oksüdatsiooni ja aromaatset tsükli hüdroksüülimist, millele järgneb hüdroksüülitud toodete konjugeerimine glükuroniidiga. Amiidi hüdrolüüs on kõige silmatorkavam metaboolne rada, tähtsuselt järgmine on tsütokroom P450 (CYP) 3A4 / 5 toimel sulfooni moodustumine. Teised oksüdatiivsed produktid moodustuvad in vitro liiga aeglaselt, et võimaldada tuvastada vastutavat ensüümi (ensüüme). Ainult kaks metaboliiti saavutavad plasmas märgatava kontsentratsiooni (st R-modafiniilhape ja modafiniilsulfoon).
NUVIGILi dispositsiooni konkreetsed andmed pole saadaval. Kuid modafiniil elimineeritakse peamiselt metabolismi kaudu, peamiselt maksas, vähem kui 10% lähteühendist eritub uriiniga. 11 päeva jooksul pärast manustamist eritus kokku 81% manustatud radioaktiivsusest, peamiselt uriinis (80% vs 1,0% roojas).
Kõrvaldamine
Pärast NUVIGIL'i suukaudset manustamist ilmneb armodafiniilil ilmne monoeksponentsiaalne langus maksimaalsest plasmakontsentratsioonist. Ilmne terminaalne t ½ on umbes 15 tundi. NUVIGIL'i suukaudne kliirens on umbes 33 ml / min.
Ravimite ja ravimite koostoimed
Armodafiniili metabolismiks on mitu rada, samuti asjaolu, et mitte-CYP-ga seotud rada on armodafiniili metaboliseerimisel kõige kiirem, näitavad, et samaaegse CYP-i pärssimise tõttu on NUVIGIL-i üldisele farmakokineetilisele profiilile oluline mõju ravimid.
In vitro andmed näitasid, et armodafiniilil on nõrk induktiivne vastus CYP1A2 ja võimalik, et CYP3A suhtes aktiivsust kontsentratsiooniga seotud viisil ja CYP2C19 aktiivsust pärsib pöörduvalt armodafiniil. Armodafiniil ei mõjutanud muid CYP-i toiminguid. In vitro uuring näitas, et armodafiniil on P-glükoproteiini substraat.
NUVIGILi krooniline annus annuses 250 mg vähendas midasolaami süsteemset ekspositsiooni 32% ja 17% pärast ühekordset suukaudset manustamist (5). mg) ja intravenoosselt (2 mg) annused, mis viitavad sellele, et NUVIGIL'i manustamine indutseerib mõõdukalt CYP3A tegevus. CYP3A4 / 5 substraadiks olevad ravimid, näiteks tsüklosporiin, võivad vajada annuse kohandamist. (Vt Ettevaatusabinõud, Ravimite koostoimed).
NUVIGILi krooniline annus annuses 250 mg ei mõjutanud kofeiini (200 mg), mis on CYP1A2 aktiivsuse proovialus, farmakokineetikat.
NUVIGIL'i ühekordse 400 mg annuse ja omeprasooli (40 mg) samaaegne manustamine suurendas süsteemset toimet kokkupuude omeprasooliga umbes 40%, mis näitab, et armodafiniil pärsib mõõdukalt CYP2C19 tegevus. CYP2C19 substraadiks olevad ravimid võivad vajada annuse vähendamist. (Vt Ettevaatusabinõud, Ravimite koostoimed).
Sooline mõju
Populatsiooni farmakokineetiline analüüs ei näidanud soolist mõju armodafiniili farmakokineetikale.
Eripopulatsioonid
Spetsiifilistes populatsioonides armodafiniili kohta andmed puuduvad.
Vanuse mõju: Ühekordse annuse uuringus täheldati modafiniili suukaudse kliirensi (CL / F) väikest langust (~ 20%) (~ 20%) 12 katsealused, kelle keskmine vanus oli 63 aastat (vahemik 53–72 aastat), kuid muutust peeti kliiniliselt ebatõenäoliseks märkimisväärne. Mitmeannuselises uuringus (300 mg / päevas) 12 patsiendil keskmise vanusega 82 aastat (vahemik 67–87 aastat) oli keskmine modafiniili tase vereplasmas oli umbes kaks korda suurem kui vastsündinutel varem katsealused. Tänu samaaegsetele ravimitele, millega enamik patsiente olid seotud, võimalike mõjude tõttu ravi ajal ei pruugi modafiniili farmakokineetika näiline erinevus olla tingitud ainult ravimi mõjust vananemine. Tulemused viitavad sellele, et eakatel võib modafiniili kliirens väheneda (vt Annustamine ja manustamine).
Võistluse efekt: Rassi mõju modafiniili farmakokineetikale ei ole uuritud.
Neerukahjustus: Ühekordse annusega 200 mg modafiniili uuringus ei põhjustanud raske krooniline neerupuudulikkus (kreatiniini kliirens ≤ 20 ml / min) mõjutab märkimisväärselt modafiniili farmakokineetikat, kuid kokkupuude modafiniilhappega suurenes 9-kordselt (vt Ettevaatusabinõud).
Maksakahjustus: maksatsirroosiga patsientidel (6 meest ja 3 naist) uuriti modafiniili farmakokineetikat ja metabolismi. Kolmel patsiendil oli B- või B + -tsirroos ja 6 patsiendil C- või C + -tsirroos (vastavalt Child-Pugh skoorikriteeriumidele). Kliiniliselt 8 patsienti 9-st oli icteric ja kõigil neil oli astsiit. Nendel patsientidel vähenes modafiniili suukaudne kliirens umbes 60% ja tasakaalukontsentratsioon kahekordistus võrreldes normaalsete patsientidega. Raske maksakahjustusega patsientidel tuleb NUVIGIL'i annust vähendada (vt lõik 4.2) Ettevaatusabinõud ja Annustamine ja manustamine).
ülaosa
Kliinilistes uuringutes
NUVIGILi tõhusus ärkveloleku parandamisel on kindlaks tehtud järgneva une ajal häired: obstruktiivne uneapnoe / hüpopnea sündroom (OSAHS), narkolepsia ja vahetustega töö unehäired (SWSD).
Iga kliinilise uuringu jaoks oli statistilise olulisuse jaoks vajalik p-väärtus ± 0,05.
Obstruktiivne uneapnoe / hüpopnea sündroom (OSAHS)
NUVIGILi tõhusus OSAHS-iga seotud liigse unisusega patsientide ärkveloleku parandamisel tehti kindlaks aastal kaks 12-nädalast, mitmetsentrilist, platseebokontrollitud, paralleelrühmaga, topeltpimedat uuringut ambulatoorsete patsientidega, kes vastasid rahvusvahelise Unehäirete klassifikatsiooni (ICSD) kriteeriumid OSAHS-i jaoks (mis on kooskõlas ka Ameerika Psühhiaatrite Assotsiatsiooniga DSM-IV kriteeriumid). Need kriteeriumid hõlmavad kas: 1) liigset unisust või unetust ja sageli esinevaid häireid hingamine une ajal ja sellega seotud omadused, näiteks valju norskamine, hommikused peavalud või suukuivus ärkamine; või 2) liigne unisus või unetus; ja polüsomnograafia, millel on üks järgmistest omadustest: unetunnis rohkem kui viis obstruktiivset apneat, igaüks kestusega üle 10 sekundi; ja üks või mitu järgmistest: sagedased une ärritused, mis on seotud apnoedega, bradütahükardia või arteriaalse hapniku desaturatsioon apneasidega. Lisaks pidi nendesse uuringutesse astumiseks olema kõigil patsientidel liigne unisus, nagu näitas Epworthi unisuse skaalal skaalal 10 - vaatamata pideva positiivse hingamisteede rõhuga ravimisele (CPAP). Lisaks CPAP kasutamise dokumenteerimisele oli vaja tõendeid selle kohta, et CPAP oli efektiivne apnoe / hüpopnoe episoodide vähendamisel.
Patsiendid pidid vastama CPAP-le, mis on määratletud kui CPAP-i kasutamine 4 tundi öösel 70% -l öödest. CPAP-i kasutamist jätkati kogu uuringu vältel. Mõlemas uuringus olid efektiivsuse esmased mõõtmed 1) une latentsus, mida hinnati ärkveloleku säilimise testiga (MWT) ja 2) patsiendi üldise haigusseisundi muutus, mida mõõdetakse kliinilises globaalses muutuste avalduses (CGI-C) külastada. Eduka uuringu jaoks pidid mõlemad meetmed näitama statistiliselt olulist paranemist.
MWT mõõdab uinumise latentsusaega (minutites). Pikendatud MWT viidi läbi katseseanssidega 2-tunnise intervalliga 9:00 kuni 7:00. Esmane analüüs oli esimese nelja katseseansi (9:00 kuni 3:00) une latentsusaja keskmine. Iga katseseansi ajal paluti katsealusel ärkvel püsida ilma erakorralisi abinõusid kasutamata. Iga katseseanss katkestati 30 minuti pärast, kui und ei toimunud, või kohe pärast une algust. CGI-C on 7-punktiline skaala, mille keskpunkt on Change (muutused) ja mis ulatub väga palju halvemast kuni väga palju paremaks. Hindajatele ei antud konkreetseid juhiseid kriteeriumide kohta, mida nad patsientide hindamisel kohaldama peaksid.
Esimeses uuringus randomiseeriti 395 OSAHS-iga patsienti randomiseeritult saama NUVIGIL-i 150 mg päevas, NUVIGIL-i 250 mg päevas või sobivat platseebot. NUVIGIL-iga ravitud patsientidel ilmnes statistiliselt oluline paranemine ärkvel püsimisel võrreldes platseeboga ravitud patsientidega, mõõdetuna MWT-st viimase visiidi ajal. Statistiliselt oluline suurem NUVIGIL-iga ravitud patsientide arv näitas üldise kliinilise seisundi paranemist, mida hinnati CGI-C skaala järgi viimasel visiidil. Katsete algtaseme keskmised une latentsusajad (minutites) MWT-s on näidatud allpool tabelis 1 koos keskmiste muutustega algtasemest MWT-l viimasel visiidil. Allpool tabelis 2 on toodud nende patsientide protsent, kellel ilmnes CGI-C taseme paranemine kliinilistes uuringutes. NUVIGILi kaks annust põhjustasid statistiliselt olulise sarnaste mõjudega mõju MWT-le ja ka CGI-C-le.
Teises uuringus randomiseeriti 263 OSAHS-iga patsienti kas NUVIGIL 150 mg / päevas või platseeboga. NUVIGIL-iga ravitud patsientidel ilmnes MWT abil statistiliselt oluline paranemine ärkvel püsimisel võrreldes platseeboga ravitud patsientidega [tabel 1]. Statistiliselt oluline suurem NUVIGIL-iga ravitud patsientide arv näitas CGI-C skaala järgi üldise kliinilise seisundi paranemist [tabel 2].
NUVIGILi kasutamine kummaski uuringus ei mõjutanud polüsomnograafia abil mõõdetud öist und.
Narkolepsia
Tõestati NUVIGILi tõhusus ärkveloleku parandamisel narkolepsiaga seotud ülemäärase unisusega (ES) patsientidel ühes 12-nädalases, mitmekeskuses, platseebokontrollitud, paralleelrühmaga, topeltpimedas uuringus ambulatoorsetel patsientidel, kes vastasid ICSD narkolepsia. Kokku randomiseeriti 196 patsienti, kes said NUVIGIL 150 või 250 mg / päevas või sobivat platseebot. ICSD narkolepsia kriteeriumid hõlmavad kas 1) korduvat päevaset uinakut või magamajäämist, mis toimub peaaegu iga päev vähemalt kolme kuud, millele lisandub posturaalse lihastoonuse järsk kahepoolne kaotus koos intensiivsete emotsioonidega (katapleksia), või 2) liigse kaebus unisus või järsk lihasnõrkus koos sellega kaasnevate tunnustega: une halvatus, hüpnogeetilised hallutsinatsioonid, automaatne käitumine, häiritud unepisood; ja polüsomnograafia, mis näitab ühte järgmistest: une latentsus alla 10 minuti või kiire silma liikumise (REM) une latentsus vähem kui 20 minutit ja mitu une Latentsustesti (MSLT), mis näitab, et keskmine une latentsusaeg on vähem kui 5 minutit ja kaks või enam une algust REM-perioodil ning ühtegi meditsiinilist või vaimset häiret ei arvestata sümptomid. Nendesse uuringutesse astumiseks pidid kõik patsiendid olema MSLT kaudu objektiivselt dokumenteeritud ülemäärase unisuse päeval uneaegusega 6 minutit või vähem ja muu kliiniliselt olulise meditsiinilise või psühhiaatrilise patsiendi puudumine häire. MSLT - objektiivne polüsomnograafiline hinnang patsiendi võimele uinuda stimuleerimata keskkond, mõõdetud latentsusaeg (minutites) une alguse kohta keskmiselt 4 katseseansi ajal 2-tunnise intervalliga. Iga katseseansi ajal öeldi katsealusele vaikselt valetada ja proovida magada. Iga katseseanss katkestati 20 minuti pärast, kui und ei toimunud, või kohe pärast une algust.
Efektiivsuse põhinäitajad olid: 1) une latentsus, mida hinnati ärkveloleku säilitamise testiga (MWT) ja 2) patsiendi üldise haiguse muutus seisund, mõõdetuna kliinilise globaalse muutuse avalduse (CGI-C) kaudu viimasel visiidil (nende kirjeldust vt eespool KLIINILISED KATSED, OSAHS) mõõdud). Kõik selles uuringus katkestatud MWT-testimise seansid lõpetati 20 minuti pärast, kui und ei toimunud, või kohe pärast une algust.
NUVIGIL-iga ravitud patsientidel ilmnes statistiliselt oluliselt paranenud võime püsida ärkvel MWT korral iga annuse korral, võrreldes platseeboga viimasel visiidil [tabel 1]. Statistiliselt oluline suurem arv patsiente, keda raviti NUVIGIL-iga iga annuse korral, näitas üldise kliinilise seisundi paranemist, mida hinnati CGI-C skaala järgi viimasel visiidil [tabel 2].
Kaks NUVIGIL-i annust avaldasid CGI-C-le statistiliselt olulist samasuguse ulatusega mõju. Ehkki iga annuse puhul täheldati statistiliselt olulist mõju MWT-le, täheldati, et suurema annuse korral oli selle mõju suurem.
NUVIGILi kasutamine ei mõjutanud polüsomnograafia abil mõõdetud öist und.
Töövahetuse unehäire (SWSD)
NUVIGILi efektiivsus ärkveloleku parandamisel patsientidel, kellel on seotud liigse unisusega SWSD-d demonstreeriti 12-nädalases, mitmetsentrilises, topeltpimedas, platseebokontrollitud, paralleelrühmaga kliinilises kliinilises uuringus. kohtuprotsess. Kokku randomiseeriti 254 kroonilise SWSD-ga patsienti saama NUVIGILi 150 mg päevas või platseebot. Kõik patsiendid vastasid kroonilise SWSD ICSD kriteeriumidele [mis on kooskõlas Ameerika Psühhiaatrite Assotsiatsiooni DSM-IV kriteeriumidega ööpäevase rütmi unehäirete korral: vahetustega töö tüüp]. Nende kriteeriumide hulka kuulub 1) kas: a) esmane kaebus liigse unisuse või unetuse kohta, mis on ajaliselt seotud sellise tööperioodiga (tavaliselt öötöö), mis toimub harjumuspärase une faasis või b) polüsomnograafia ja MSLT näitab normaalse une-ärkveloleku režiimi kadumist (st häiritud kronobioloogiline rütmilisus); ja 2) ükski teine meditsiiniline või vaimne häire ei kajasta sümptomeid ja 3) sümptomid ei vasta kriteeriumidele mis tahes muu unehäireid või liigset unisust põhjustavate unehäirete korral (nt ajavööndi muutus [jet lag] sündroom).
Tuleb märkida, et mitte kõik unisuse kaebusega patsiendid, kes tegelevad ka vahetustega, ei vasta SWSD diagnoosimise kriteeriumidele. Kliinilises uuringus osalesid ainult patsiendid, kellel oli sümptomaatiline vähemalt 3 kuud.
Kaasatud patsiendid pidid samuti töötama vähemalt 5 öövahetust kuus, neil peab olema liigne unisus nende öövahetuste aeg (MSLT skoor - 6 minutit) ja päevasel polüsomnogrammil on dokumenteeritud unetus (PSG).
Efektiivsuse põhinäitajad olid 1) une latentsus, mida hinnati mitme uneaja latentsuse testiga (MSLT), mis viidi läbi simuleeritud öövahetuse ajal viimane visiit ja 2) patsiendi üldise haigusseisundi muutus, mida mõõdetakse viimase visiidi kliinilise globaalse muutuse mulje (CGI-C) abil. (Vt Kliinilistes uuringutes, Narkolepsia ja OSAHS ülaltoodud lõigud nende meetmete kirjeldamiseks).
NUVIGIL'iga ravitud patsientidel ilmnes uneaja statistiliselt oluline pikenemine algusega võrreldes platseeboga ravitud patsientidega, mõõdetuna öisel MSLT-l viimasel visiidil [tabel 1]. Statistiliselt oluline suurem NUVIGIL-iga ravitud patsientide arv näitas üldise kliinilise seisundi paranemist, mida hinnati CGI-C skaala järgi viimasel visiidil [tabel 2].
NUVIGILi kasutamine ei mõjutanud polüsomnograafiaga mõõdetud päevaset und.
| Häire | Mõõda | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Platseebo | |||
* Kõigi uuringute puhul oluliselt erinev platseebost (p <0,05) | |||||||
| Baasjoon | Muuta lähtejoonest |
Baasjoon | Muuta lähtejoonest |
Baasjoon | Muutke alates Baasjoon |
||
| OSAHS I | MWT | 21.5 | 1.7 | 23.3 | 2.2 | 23.2 | -1.7 |
| OSAHS II | MWT | 23.7 | 2.3 | - | - | 23.3 | -1.3 |
| Narkolepsia | MWT | 12.1 | 1.3 | 9.5 | 2.6 | 12.5 | -1.9 |
| SWSD | MSLT | 2.3 | 3.1 | - | - | 2.4 | 0.4 |
| Häire | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Platseebo |
* Kõigi uuringute puhul oluliselt erinev platseebost (p <0,05) | |||
| OSAHS I | 71% | 74% | 37% |
| OSAHS II | 71% | - | 53% |
| Narkolepsia | 69% | 73% | 33% |
| SWSD | 79% | - | 59% |
ülaosa
Näidustused ja kasutamine
NUVIGIL on näidustatud ärkveloleku parandamiseks patsientidel, kellel on liigne unisus, mis on seotud obstruktiivse uneapnoe / hüpopnea sündroomi, narkolepsia ja vahetustega töö unehäiretega.
OSAHS-is on NUVIGIL näidustatud kaasneva obstruktsiooni standardse ravi (de) lisana. Kui patsiendi jaoks on raviks valitud pidev positiivne hingamisteede rõhk (CPAP), tuleb enne NUVIGIL-ravi alustamist teha maksimaalne pingutus CPAP-iga ravimiseks. Kui NUVIGILi kasutatakse koos CPAP-iga, on CPAP-i järgimise julgustamine ja perioodiline hindamine vajalik.
Kõigil juhtudel on äärmiselt oluline hoolikas tähelepanu kaasnevate unehäirete diagnoosimisele ja ravile. Ravimi väljakirjutajad peaksid teadma, et mõnel patsiendil võib olla rohkem kui üks unehäire, mis võib põhjustada nende liigset unisust.
NUVIGILi efektiivsust pikaajalisel kasutamisel (rohkem kui 12 nädalat) ei ole platseebo-kontrollitud uuringutes süstemaatiliselt hinnatud. Arst, kes otsustab NUVIGILi pikema aja jooksul patsientidele välja kirjutada, peab perioodiliselt hindama konkreetse patsiendi pikaajalist kasulikkust.
ülaosa
Vastunäidustused
NUVIGIL on vastunäidustatud patsientidele, kellel on teadaolev ülitundlikkus modafiniili ja armodafiniili või selle inaktiivsete koostisosade suhtes.
ülaosa
HOIATUSED
Tõsine lööve, sealhulgas Stevens-Johnsoni sündroom
Täiskasvanutel on seoses raviga teatatud tõsistest löövetest, mis nõuavad haiglaravi ja ravi katkestamist armodafiniili ning täiskasvanutel ja lastel seoses modafiniili, S ja R modafiniili ratseemilise segu kasutamisega (viimane on armodafiniil).
Armodafiniili ei ole lastel üheski keskkonnas uuritud ja see ei ole lubatud kasutamiseks lastel ühegi näidustuse jaoks.
Täiskasvanute armodafiniili kliinilistes uuringutes (0/1 595) ei ole tõsiseid nahalööbeid täheldatud. Kuid turustamisjärgse kogemusega täiskasvanutel on esinenud tõsise lööbe juhtumeid. Kuna armodafiniil on ratseemilise modafiniili R-isomeer, ei saa välistada sarnast tõsise lööbe riski armodafiniiliga lastel.
Modafiniili (ratsemaadi) kliinilistes uuringutes oli katkestamise põhjustatud lööbe esinemissagedus lastel (vanus <17 aastat) umbes 0,8% (13 juhtu 1 585 kohta); nende löövete hulka kuulus üks võimalik Stevens-Johnsoni sündroomi (SJS) juhtum ja 1 ilmse mitme organi ülitundlikkusreaktsiooni juhtum. Mitmeid juhtumeid seostati palaviku ja muude kõrvalekalletega (nt oksendamine, leukopeenia). Keskmine lööbe ilmnemise aeg, mille tulemusel ravi katkestati, oli 13 päeva. Platseebot saanud 380 pediaatrilise patsiendi seas selliseid juhtumeid ei täheldatud. Täiskasvanute kliinilistes uuringutes (0 juhtu 4 264 kohta) ei ole modafiniili kasutamisest teatatud tõsistest nahalöövetest. Harva esinevad tõsised või eluohtlikud lööbed, sealhulgas SJS, toksiline epidermaalne nekrolüüs (TEN) ja ravimlööve koos Ülemaailmse turustusjärgse kogemusega täiskasvanutel ja lastel on teatatud eosinofiiliast ja süsteemsetest sümptomitest (DRESS) koos modafiniiliga. Modafiniili kasutamisega seotud TEN-i ja SJS-i teadete esinemissagedus, mida üldiselt peetakse alaaruandluse tõttu alahindavaks, ületab taustal esineva esinemissageduse. Nende rahvatervise tõsiste nahareaktsioonide esinemissageduse hinnanguline ulatus on vahemikus 1 kuni 2 juhtu miljoni inimese kohta.
Armodafiniili või modafiniiliga seotud lööbe tekkimise riski või raskuse prognoosimiseks teadaolevalt pole ühtegi tegurit. Peaaegu kõik armodafiniili või modafiniiliga seotud tõsise lööbe juhtumid tekkisid 1–5 nädala jooksul pärast ravi alustamist. Kuid pärast pikaajalist ravi modafiniiliga (nt 3 kuud) on teatatud üksikutest juhtudest. Järelikult ei saa ravi kestusele tugineda kui vahendit lööbe ilmnemisest tuleneva võimaliku riski ennustamiseks.
Ehkki healoomulisi lööbeid esineb ka armodafiniiliga, ei ole võimalik usaldusväärselt ennustada, millised lööbed osutuvad tõsiseks. Seetõttu tuleks armodafiniili kasutamine tavaliselt lööbe esimeste nähtude korral katkestada, välja arvatud juhul, kui lööve ei ole selgelt seotud ravimiga. Ravi katkestamine ei pruugi takistada lööbe muutumist eluohtlikuks või püsivalt töövõimetuks või moonutavaks.
Angioödeem ja anafülaktoidsed reaktsioonid
1595 armodafiniiliga ravitud patsiendi hulgas täheldati ühte rasket angioödeemi ja ühte ülitundlikkuse juhtumit (koos lööbe, düsfaagia ja bronhospasmiga). Patsientidel tuleb soovitada ravi katkestada ja kõik nähud tuleb arstile viivitamatult teatada või sümptomid, mis viitavad angioödeemile või anafülaksiale (nt näo, silmade, huulte, keele või keele turse) kõri; neelamis- või hingamisraskused; kähedus).
Mitme organi ülitundlikkusreaktsioonid
Mitme organi ülitundlikkusreaktsioonidel, kaasa arvatud vähemalt üks surmajuhtum turustamise järgselt, on esinenud esines tihedas ajalises ühenduses (mediaanne aeg tuvastamiseni 13 päeva: vahemik 4-33) kuni nakatumise alguseni modafiniil. Armodafiniiliga ei saa välistada sarnast mitme organi ülitundlikkusreaktsioonide riski.
Kuigi teateid on olnud piiratud arv, võivad mitme organi ülitundlikkusreaktsioonid põhjustada hospitaliseerimise või olla eluohtlikud. Puuduvad teadaolevad tegurid, mis ennustaksid modafiniiliga seotud mitme organi ülitundlikkusreaktsioonide tekkeriski või tõsidust. Selle häire nähud ja sümptomid olid mitmekesised; kuid patsientidel on tavaliselt, ehkki mitte ainult, palavik ja lööve, mis on seotud muude elundisüsteemidega. Muud kaasnevad ilmingud olid müokardiit, hepatiit, maksafunktsiooni testide kõrvalekalded, hematoloogilised kõrvalekalded (nt eosinofiilia, leukopeenia, trombotsütopeenia), kihelus ja asteenia. Kuna mitme organi ülitundlikkus on selle väljenduses varieeruv, võivad ilmneda muud elundisüsteemi sümptomid ja nähud, mida siin ei ole nimetatud.
Mitme organi ülitundlikkusreaktsiooni kahtluse korral tuleb NUVIGIL-ravi katkestada. Kuigi puuduvad juhtumite andmed, mis viitaksid risttundlikkusele teiste seda sündroomi tekitavate ravimitega, mitme organi ülitundlikkusega seotud ravimite kasutamise kogemus näitab, et see on a võimalus.
Püsiv unisus
Ebanormaalse unisusega patsiente, kes võtavad NUVIGIL'i, tuleb hoiatada, et nende ärkveloleku tase ei pruugi normaliseeruda. Liigse unisusega patsientide, sealhulgas NUVIGILi võtvate patsientide seisundit tuleks sageli uuesti hinnata unisuse aste ja vajadusel soovitatakse vältida sõiduki juhtimist või muud potentsiaalselt ohtlikku tegevus. Ravimi väljakirjutajad peaksid ka teadma, et patsiendid ei pruugi unisust või uimasust enne ära tunda, kui konkreetsete tegevuste ajal on uimasust või unisust otseselt küsitud.
Psühhiaatrilised sümptomid
Modafiniiliga ravitud patsientidel on esinenud psühhiaatrilisi kõrvaltoimeid. Modafiniil ja armodafiniil (NUVIGIL) on väga tihedalt seotud. Seetõttu arvatakse, et armodafiniiliga seotud psühhiaatriliste sümptomite esinemissagedus ja tüüp on sarnased modafiniiliga seotud nende juhtude esinemissageduse ja tüübiga.
Turustamisjärgsete modafiniili kasutamisega seotud kõrvalnähtude hulka kuuluvad maania, luulud, hallutsinatsioonid, enesetapumõtted ja agressioon, mille tagajärjeks on haiglaravi. Paljudel, kuid mitte kõigil patsientidel oli eelnev psühhiaatriline anamnees. Ühel tervel meessoost vabatahtlikul tekkisid viited ideedele, paranoilistele pettekujutlustele ja kuulmishallutsinatsioonidele seoses mitmepäevase 600 mg modafiniili annuse ja unepuudusega. 36 tundi pärast uimastitarbimise lõpetamist ei olnud psühhoosist mingeid tõendeid.
NUVIGILi kontrollitud uuringu andmebaasis olid põhjuseks ärevus, agitatsioon, närvilisus ja ärrituvus ravi katkestamine sagedamini NUVIGILi saavatel patsientidel, võrreldes platseeboga (NUVIGIL 1,2% ja platseebo 0.3%). NUVIGILi kontrollitud uuringutes oli depressioon ka ravi katkestamise põhjus sagedamini NUVIGILi saanud patsientidel võrreldes platseeboga (NUVIGIL 0,6% ja platseebo 0,2%). Kliinilistes uuringutes täheldati kahte suitsiidimõtmise juhtumit. NUVIGILi kasutamisel patsientidega, kellel on anamneesis psühhoos, depressioon või maania, tuleb olla ettevaatlik. Kui seoses NUVIGIL-i manustamisega tekivad psühhiaatrilised sümptomid, kaaluge NUVIGIL-ravi katkestamist.
ülaosa
ETTEVAATUSABINÕUD
Unehäirete diagnoosimine
NUVIGIL'i tuleks kasutada ainult patsientidel, kellel on täielikult hinnatud nende liigset unisust ja kellel a kas narkolepsia, OSAHS ja / või SWSD on diagnoositud vastavalt ICSD või DSM diagnostilistele kriteeriumidele (vt Kliinilistes uuringutes). Selline hindamine koosneb tavaliselt täielikust anamneesist ja füüsilisest läbivaatusest ning sellele võib lisada katseid laboris. Mõnel patsiendil võib olla rohkem kui üks unehäire, mis võib põhjustada nende liigset unisust (nt OSAHS ja SWSD langevad samal patsiendil kokku).
CPAP kasutamine OSAHS-iga patsientidel
OSAHS-is on NUVIGIL näidustatud kaasneva obstruktsiooni standardse ravi (de) lisana. Kui patsiendi jaoks on raviks valitud pidev positiivne hingamisteede rõhk (CPAP), tuleb enne NUVIGIL-ravi alustamist teha maksimaalne pingutus CPAP-iga ravimiseks. Kui NUVIGILi kasutatakse koos CPAP-iga, on CPAP-i järgimise julgustamine ja perioodiline hindamine vajalik. CPAP kasutamise vähenemine aja jooksul oli väike (NUVIGIL'iga ravitud patsientide keskmine vähenemine 18 minutit) ja 6-minutiline vähendamine NUVIGIL-is platseeboga ravitud patsientidel alates keskmisest algtaseme kasutamisest 6,9 tundi öösel kohtuprotsessid.
Üldine
Kuigi pole tõestatud, et NUVIGIL põhjustaks funktsionaalset kahjustust, võib iga kesknärvisüsteemi mõjutav ravim muuta otsustusvõimet, mõtlemist või motoorseid oskusi. Patsiente tuleb hoiatada auto või muu ohtliku masina kasutamisel kuni selleni välja on üsna kindel, et NUVIGIL-ravi ei kahjusta nende võimet sellega tegeleda tegevused.
Kardiovaskulaarsüsteem
NUVIGILi ei ole hinnatud ega kasutatud märkimisväärsel määral patsientidel, kellel on hiljuti esinenud müokardiinfarkti või ebastabiilset stenokardiat, ja sellistesse patsientidesse tuleb suhtuda ettevaatusega.
PROVIGILi kliinilistes uuringutes ilmnesid nähud ja sümptomid, sealhulgas valu rinnus, südamepekslemine, hingeldus ja mööduv isheemia Kolmel isikul täheldati T-laine muutusi EKG-s seoses mitraalklapi prolapsi või vasaku vatsakesega hüpertroofia. NUVIGIL'i tablette ei soovitata kasutada patsientidel, kellel on anamneesis vasaku vatsakese hüpertroofia või kes on põetud mitraalklapi prolapsiga patsiendid, kellel on varem KNS-i kasutamisel esinenud mitraalklapi prolapsi sündroomi stimulandid. Mitraalklapi prolapsi sündroomi nähud hõlmavad, kuid mitte ainult, isheemilisi EKG muutusi, valu rinnus või arütmiat. Kui mõni neist sümptomitest ilmneb uuesti, kaaluge südame hindamist.
Vererõhu jälgimine lühiajalistes (¤ 3 kuud) kontrollitud uuringutes näitas keskmise süstoolse ja keskmise diastoolne vererõhk NUVIGILi saavatel patsientidel võrreldes platseeboga (erinevates katsetes 1,2–4,3 mmHg rühmad). NUVIGIL-ravi saanud patsientide osakaal antihüpertensiivsete ravimite uut või suuremat kasutamist vajavate patsientide hulgas oli pisut suurem (2,9%) kui platseebot saanud patsientide hulgas (1,8%). NUVIGIL-ravi saavatel patsientidel võib olla vajalik vererõhu tugevdatud jälgimine.
Steroidseid rasestumisvastaseid vahendeid kasutavad patsiendid
Steroidsete rasestumisvastaste ravimite efektiivsus võib väheneda, kui neid kasutatakse koos NUVIGILiga ja ühe kuu jooksul pärast ravi katkestamist (vt Ettevaatusabinõud, Ravimite koostoimed). NUVIGIL-ravi saavatel patsientidel ja ühe kuu jooksul pärast NUVIGIL-ravi katkestamist soovitatakse kasutada alternatiivseid või samaaegseid rasestumisvastaseid meetodeid.
Tsüklosporiini kasutavad patsiendid
NUVIGIL-i kasutamisel võib tsüklosporiini sisaldus veres langeda (vt lõik 4.2) Ettevaatusabinõud, Ravimite koostoimed). Nende ravimite samaaegsel kasutamisel tuleks kaaluda tsirkuleeriva tsüklosporiini kontsentratsiooni jälgimist ja tsüklosporiini annuse sobivat kohandamist.
Raske maksakahjustusega patsiendid
Raske maksakahjustusega, maksatsirroosiga või ilma (vt Kliiniline farmakoloogia), Tuleb NUVIGIL'i manustada vähendatud annusena (vt Annustamine ja manustamine).
Raske neerukahjustusega patsiendid
Annustamise ohutuse ja efektiivsuse määramiseks raske neerukahjustusega patsientidele ei ole piisavalt teavet (neerukahjustuse farmakokineetika kohta vt. Kliiniline farmakoloogia).
Eakad patsiendid
Eakatel patsientidel võib armodafiniili ja selle metaboliitide eritumine vananemise tagajärjel väheneda. Seetõttu tuleks selles populatsioonis kaaluda väiksemate annuste kasutamist (vt Kliiniline farmakoloogia ja Annustamine ja manustamine).
Teave patsientidele
Arstidel soovitatakse arutada järgmisi küsimusi patsientidega, kellele nad määravad NUVIGILi.
NUVIGIL on näidustatud patsientidele, kellel on ebanormaalne unisus. On tõestatud, et NUVIGIL parandab seda ebanormaalset magamajäämist, kuid ei kõrvalda seda. Seetõttu ei tohiks patsiendid oma varasemat käitumist potentsiaalselt ohtlike tegevuste (nt autojuhtimine, masinatega töötamine) või muu osas muuta tegevused, mis nõuavad sobivat ärkveloleku taset, kuni ja kui pole NUVIGIL-raviga tõestatud, et see põhjustab sellist ärkveloleku taset tegevused. Patsiente tuleb hoiatada, et NUVIGIL ei asenda und.
Patsiente tuleb teavitada sellest, et võib osutuda kriitiliseks jätkata oma varem ette nähtud ravi (nt CPAP-i saavad OSAHS-iga patsiendid peaksid seda jätkama).
Patsiente tuleb teavitada patsiendi infolehe olemasolust ja neid tuleks juhendada enne NUVIGILi kasutamist infolehte lugema. Patsientidele mõeldud infolehe teksti leiate selle märgistuse lõpus patsienditeabest.
Patsientidel tuleb soovitada pöörduda arsti poole, kui neil tekib lööve, depressioon, ärevus või psühhoosi või maania tunnused.
Rasedus
Patsientidel tuleb soovitada oma arstil teatada, kui nad rasestuvad või kavatsevad rasestuda ravi ajal. Steroidsete rasestumisvastaste vahendite (sealhulgas depoo- või siirdatavad) kasutamisel tuleb patsiente hoiatada seoses võimaliku suurenenud raseduse riskiga rasestumisvastaseid vahendeid) koos NUVIGILiga ja ühe kuu jooksul pärast ravi katkestamist (vt kantserogenees, mutagenees, viljakuse langus ja Rasedus).
Põetamine
Patsientidel tuleb soovitada teavitada oma arsti, kui nad imetavad last.
Samaaegsed ravimid
Patsientidel tuleb soovitada informeerida oma arsti, kui nad võtavad või plaanivad seda võtta retsepti- või käsimüügiravimid NUVIGILi ja muud ravimid.
Alkohol
Patsiente tuleb hoiatada, et NUVIGILi kasutamist koos alkoholiga ei ole uuritud. Patsientidele tuleb öelda, et NUVIGILi kasutamise ajal on mõistlik hoiduda alkoholist.
Allergilised reaktsioonid
Patsientidel tuleb soovitada lõpetada NUVIGILi võtmine ja teavitada oma arsti, kui neil tekib lööve, nõgestõbi, haavandid suuõõnes, villid, naha koorimine, neelamis- või hingamisraskused või sellega seotud allergik nähtus.
Ravimite koostoimed
Võimalik koostoime ravimitega, mis pärsivad, indutseerivad või metaboliseeruvad tsütokroom P450 isoensüümide ja muude maksaensüümide poolt
CYP3A ensüümide osalise osaluse tõttu armodafiniili metaboolses elimineerimisel põhjustab CYP3A4 / 5 tugevate indutseerijate samaaegne manustamine (nt karbamasepiin, fenobarbitaal, rifampiin) või CYP3A4 / 5 inhibiitorid (nt ketokonasool, erütromütsiin) võivad muuta armodafiniil.
NUVIGILi potentsiaal muuta ensüümide indutseerimise või inhibeerimise kaudu teiste ravimite metabolismi
CYP1A2 vahendusel metaboliseeritavad ravimid: In vitro andmed näitasid, et armodafiniilil on nõrk induktiivne vastus CYP1A2 ja võimalik, et CYP3A suhtes aktiivsused kontsentratsiooniga seotud viisil ja näitasid, et CYP2C19 aktiivsus pärsib pöörduvalt armodafiniil. Kofeiiniga läbi viidud koostoimeuuringus ei täheldatud siiski kliiniliselt mõju CYP1A2 aktiivsusele (vt Kliiniline farmakoloogia, Farmakokineetika, ravimite ja ravimite koostoimed).
CYP3A4 / 5 abil metaboliseeritavad ravimid (nt tsüklosporiin, etinüülöstradiool, midasolaam ja triasolaam): NUVIGILi krooniline manustamine põhjustas CYP3A aktiivsuse mõõduka induktsiooni. Seega on CYP3A ensüümide substraatideks olevate ravimite (nt tsüklosporiin, etinüül) efektiivsus östradiooli, midasolaami ja triasolaami sisaldust) võib väheneda pärast samaaegse ravi alustamist NUVIGIL. Armodafiniili ja midasolaami samaaegsel kasutamisel vähenes suukaudse midasolaami süsteemne ekspositsioon 32%. Võib osutuda vajalikuks annuse kohandamine (vt Kliiniline farmakoloogia, Farmakokineetika, ravimite ja ravimite koostoimed). Selliseid toimeid (vähenenud kontsentratsioon) täheldati ka modafiniili koosmanustamisel tsüklosporiini, etinüülöstradiooli ja triasolaamiga.
CYP2C19 abil metaboliseeritavad ravimid (nt omeprasool, diasepaam, fenütoiin ja propranolool): NUVIGILi manustamine põhjustas CYP2C19 aktiivsuse mõõduka pärssimise. Seetõttu võib mõnede CYP2C19 substraatideks olevate ravimite (nt fenütoiin, diasepaam ja propranolool, omeprasool ja klomipramiin) annust vähendada, kui neid kasutatakse samaaegselt NUVIGILiga. Armodafiniili ja omeprasooli koosmanustamisel ilmnes ekspositsiooni 40% -line suurenemine. (Vt Kliiniline farmakoloogia, Farmakokineetika, ravimite ja ravimite koostoimed).
Koostoimed kesknärvisüsteemiga Alooduslikud ravimid
Spetsiifilised andmed ravimite armodafiniili koostoime kohta kesknärvisüsteemi aktiivsete ravimitega puuduvad. Armodafiniili suhtes peaks siiski kehtima järgmine kättesaadav teave ravimite ja ravimite koostoime kohta modafiniili kohta (vt Kirjeldus ja Kliiniline farmakoloogia).
Modafiniili manustamine koos metüülfenidaadi või dekstroamfetamiiniga ei põhjustanud olulisi muutusi modafiniili või kummagi stimulandi farmakokineetiline profiil, ehkki modafiniili imendumine viibis umbes ühe tund.
Samaaegne modafiniil või klomipramiin ei muutnud kummagi ravimi PK-profiili; kuid modafiniilravi ajal teatati narkolepsiaga patsiendist ühest klomipramiini ja selle aktiivse metaboliidi desmetüülklomipramiini taseme tõusu juhtumist.
Spetsiifilised andmed armodafiniili või modafiniili ravimite ja ravimite koostoime kohta monoamiini oksüdaasi (MAO) inhibiitoritega ei ole kättesaadavad. Seetõttu tuleb MAO inhibiitorite ja NUVIGIL'i samaaegsel kasutamisel olla ettevaatlik.
Koostoimed teiste ravimitega
Muude täiendavate ravimite armodafiniili koostoime võimaliku kohta andmed puuduvad. Armodafiniili suhtes peaks siiski kehtima järgmine kättesaadav teave ravimite ja ravimite koostoime kohta modafiniili kohta.
Varfariin - Modafiniili ja varfariini samaaegne manustamine ei põhjustanud olulisi muutusi R- ja S-varfariini farmakokineetilistes profiilides. Kuna selles uuringus testiti ainult üksiku varfariini annust, ei saa välistada farmakodünaamilist koostoimet. Seetõttu tuleks alati kaaluda protrombiini aja / INR sagedamat jälgimist, kui NUVIGIL'i manustatakse koos varfariiniga.
Kantserogenees, mutagenees, viljakuse langus
Kantserogenees
Ainult armodafiniiliga ei ole kantserogeensuse uuringuid läbi viidud. Viidi läbi kantserogeensuse uuringud, milles modafiniili manustati dieedis hiirtele 78 nädala jooksul ja rottidele 104 nädala jooksul annustes 6, 30 ja 60 mg / kg päevas. Suurim uuritud annus on 1,5 (hiir) või 3 (rott) korda suurem kui täiskasvanud inimese soovitatav modafiniili ööpäevane annus (200 mg) mg / m2 kohta. Nendes uuringutes ei olnud tõendeid modafiniili manustamisega seotud kasvajageneesi kohta. Kuna hiirte uuringus kasutati ebapiisavat suurt annust, mis ei olnud maksimaalse talutava annuse suhtes representatiivne, viidi Tg-s läbi järgmine kantserogeensuse uuring. Vahelduvvoolu transgeenne hiir. Tg-s hinnatud annused AC testid olid 125, 250 ja 500 mg / kg päevas, manustatuna naha kaudu. Modafiniili manustamisega ei olnud seotud tumorigeensust; see dermaalne mudel ei pruugi siiski suukaudselt manustatava ravimi kantserogeenset potentsiaali piisavalt hinnata.
Mutagenees
Armodafiniili hinnati in vitro bakteriaalse pöördmutatsiooni katses ja in vitro imetajate kromosoomaberratsiooni testis inimese lümfotsüütides. Armodafiniil oli nendes testides negatiivne, nii metaboolse aktivatsiooni puudumisel kui ka juuresolekul.
Modafiniil ei näidanud mutageenset ega klastogeenset potentsiaali in vitro (s.o bakteriaalse pöördmutatsiooni test, hiire lümfoomi tk test, kromosoomaberratsioon) test inimese lümfotsüütides, raku transformatsiooni test hiire BALB / 3T3 embrüo rakkudes) testid metaboolse aktiveerimise puudumisel või olemasolul või in vivo (hiire luuüdi mikrotuuma) testid. Modafiniil oli negatiivne ka roti hepatotsüütide planeerimata DNA sünteesi testis.
Viljakuse langus
Ainult armodafiniiliga viljakuse ja varase embrüonaalse arengu (kuni implanteerumiseni) uuringut läbi ei viidud.
Modafiniili suukaudne manustamine (annused kuni 480 mg / kg päevas) isastele ja emastele rottidele enne ja kogu selle vältel paaritumine ja jätkamine naistel kuni tiinuse 7. päevani suurendas paaritumisaega kõige rohkem annus; mõju muudele viljakuse või reproduktiivsuse parameetritele ei täheldatud. Toimeta annust 240 mg / kg päevas seostati modafiniili plasmakontsentratsiooniga (AUC), mis oli umbes sama, mis inimestel soovitatava 200 mg annuse korral.
Rasedus
C-kategooria rasedus
Rottidega (armodafiniil, modafiniil) ja küülikutega (modafiniil) tehtud uuringutes täheldati kliiniliselt oluliste ekspositsioonide korral arengutoksilisust.
Armodafiniili suukaudsel manustamisel (60, 200 või 600 mg / kg päevas) tiinetele rottidele kogu organogeneesi perioodil suurenes loote siseelundite ja luustiku variatsioonide esinemissagedused keskmise või suurema annuse kasutamisel ja loote kehamassi vähenemine kõige kõrgemal annus. Efektiivset annust rottide embrüo / loote arengutoksilisuse suhtes seostati plasma armodafiniiliga kokkupuude (AUC) umbes 0,03-kordne AUC inimestel maksimaalse soovitatava ööpäevase annuse 250 korral mg.
Modafiniili (50, 100 või 200 mg / kg päevas) manustati suukaudselt tiinetele rottidele kogu põhjustatud organogeneesi perioodil, ilma emasloomale avalduv toksilisus, resorptsioonide suurenemine ning vistseraalsete ja luustiku muutuste sagenemine järglastel annus. Embrüo / loote arenguhäirete toksilisuse suurem annus ilma toimeta oli seotud plasmaga - modafiniili ekspositsioon umbes 0,5 korda suurem AUC - st inimestel soovitatavast ööpäevasest annusest (RHD) 200 mg. Järgnevas uuringus annusega kuni 480 mg / kg päevas (modafiniili plasmakontsentratsioon inimese RHD-s kahekordne AUC korral) ei täheldatud embrüo ja loote arengule kahjulikku mõju.
Modafiniili manustati suukaudselt tiinetele küülikutele kogu organogeneesi perioodil annustes kuni 100 mg / kg päevas (modafiniili plasma AUC ligikaudu võrdne AUC-ga inimestel RHD-l) embrüo ja lootele mingit mõju areng; kasutatud annused olid siiski liiga madalad, et adekvaatselt hinnata modafiniili mõju embrüo ja loote arengule. Järgnevas arengutoksilisuse uuringus, milles hinnati rasedatel annuseid 45, 90 ja 180 mg / kg päevas küülikutel suurenes loote struktuursete muutuste ja embrüo ja loote surma sagedus kõige rohkem annus. Suurim arenguhäireid põhjustav toimeta annus seostati modafiniili plasma AUC-ga, mis oli ligikaudu võrdne inimeste AUC-ga RHD-s.
Modafiniili manustamine rottidele kogu tiinuse ja imetamise ajal suukaudsetes annustes kuni 200 mg / kg päevas vähendas elujõulisus järglastel annustes üle 20 mg / kg päevas (plasma modafiniili AUC umbes 0,1-kordne AUC inimestel RHD). Ellujäänud järglastel ei täheldatud mingit mõju sünnitusjärgsele arengule ja neuro-käitumuslikele parameetritele.
Armodafiniili ega modafiniili kasutamise kohta rasedatel ei ole piisavalt ja hästi kontrollitud uuringuid. Seoses armodafiniili ja modafiniiliga on teatatud kahest emakasisese kasvu aeglustumise ja ühe spontaanse abordi juhtumist. Ehkki armodafiniili farmakoloogia ei ole identne sümpatomimeetiliste amiinidega, on sellel selle klassiga mõned farmakoloogilised omadused. Mõnda neist ravimitest on seostatud emakasisese kasvupeetuse ja spontaansete abortidega. Kas armodafiniili juhtumid on seotud uimastitega, pole teada.
Armodafiniili või modafiniili tuleks raseduse ajal kasutada ainult siis, kui potentsiaalne kasu õigustab potentsiaalset ohtu lootele.
Tööjõud ja sünnitus
Armodafiniili mõju sünnitusele ja sünnitusele inimestel ei ole süstemaatiliselt uuritud.
Imetavad emad
Ei ole teada, kas armodafiniil või selle metaboliidid erituvad inimese rinnapiima. Kuna paljud ravimid erituvad inimese rinnapiima, tuleb NUVIGIL'i tablettide manustamisel imetavale naisele olla ettevaatlik.
Kasutamine lastel
Armodafiniili kasutamise ohutust ja efektiivsust alla 17-aastastel inimestel ei ole kindlaks tehtud. Modafiniili saavatel lastel on täheldatud tõsist löövet
Geiratric kasutamine
Ohutus ja efektiivsus üle 65-aastastel inimestel pole tõestatud.
ülaosa
Kõrvaltoimed
Armodafiniili ohutust on hinnatud enam kui 1100 ülemäärase unisusega patsiendi puhul, mis on seotud primaarsete unehäirete ja ärkvelolekuga. Kliinilistes uuringutes on NUVIGIL üldiselt hästi talutav ja enamik kõrvaltoimeid olid kerged kuni mõõdukad.
Platseebokontrollitud kliinilistes uuringutes olid kasutamisega seotud kõige sagedamini täheldatud kõrvaltoimed (~ 5%) NUVIGIL'ist sagedamini kui platseeboga ravitud patsientidel olid peavalu, iiveldus, pearinglus ja unetus. Kõrvaltoimete profiil oli kõigis uuringutes sarnane.
Platseebokontrollitud kliinilistes uuringutes katkestas NUVIGILi saanud 645 patsiendist 44 (7%) 44, võrreldes platseebot saanud 445 patsiendist (4%) 16-st. Kõige sagedasem ravi katkestamise põhjus oli peavalu (1%).
Esinemine kontrollitud uuringutes
Järgmises tabelis (tabel 3) on esitatud kahjulikud kogemused, mis esinesid vähemalt 1% ja rohkem sageli NUVIGIL'iga ravitud patsientidel kui platseeborühmaga patsientidel platseebokontrollitud kliinilistes uuringutes.
Ravimi väljakirjutaja peaks teadma, et allpool esitatud arvandmeid ei saa kasutada kahjulike kogemuste esinemissageduse prognoosimiseks tavapärase meditsiinilise praktika käigus, kus patsiendi omadused ja muud tegurid võivad erineda kliinilises seisundis esinevatest uuringud. Samuti ei saa viidatud esinemissagedusi otseselt võrrelda teiste kliinilisi uuringuid, mis hõlmavad erinevaid raviviise, kasutusviise või uurijaid, saadud arvudega. Nende esinemissageduste ülevaade annab väljakirjutajatele aga aluse hinnata uimastite ja mitte-ravimite tegurite suhtelist panust uuritud populatsioonis esinevate kõrvalnähtude esinemissagedusse.
| Organisüsteemi klass MedDRA eelistatud termin |
Nuvigil (Protsenti, N = 645) |
Platseebo (Protsenti, N = 445) |
ª Neli topeltpimedat, platseebokontrollitud kliinilist uuringut SWSD, OSAHS ja narkolepsia korral; esinemissagedus ümardatakse lähima täisprotsendini. Siia kuuluvad ainult need sündmused, mille korral Nuvigili esinemissagedus on suurem kui platseeboga. | ||
| Südame häired | ||
| Südamepekslemine | 2 | 1 |
| Seedetrakti häired | ||
| Iiveldus | 7 | 3 |
| Kõhulahtisus | 4 | 2 |
| Kuiv suu | 4 | 1 |
| Düspepsia | 2 | 0 |
| Kõhuvalu ülaosas | 2 | 1 |
| Kõhukinnisus | 1 | 0 |
| Oksendamine | 1 | 0 |
| Lahtised väljaheited | 1 | 0 |
| Üldised häired ja manustamiskoha tingimused | ||
| Väsimus | 2 | 1 |
| Janu | 1 | 0 |
| Gripilaadne haigus | 1 | 0 |
| Valu | 1 | 0 |
| Püreksia | 1 | 0 |
| Immuunsüsteemi häired | ||
| Hooajaline allergia | 1 | 0 |
| Juurdlused | ||
| Gamma-glutamüültransferaasi sisalduse suurenemine | 1 | 0 |
| Südame löögisagedus suurenenud | 1 | 0 |
| Ainevahetus- ja toitumishäired | ||
| Anoreksia | 1 | 0 |
| Söögiisu vähenemine | 1 | 0 |
| Närvisüsteemi häired | ||
| Peavalu | 17 | 9 |
| Peapööritus | 5 | 2 |
| Tähelepanu häirimine | 1 | 0 |
| Treemor | 1 | 0 |
| Migreen | 1 | 0 |
| Paresteesia | 1 | 0 |
| Psühhiaatrilised häired | ||
| Unetus | 5 | 1 |
| Ärevus | 4 | 1 |
| Depressioon | 2 | 0 |
| Agitatsioon | 1 | 0 |
| Närvilisus | 1 | 0 |
| Masendunud tuju | 1 | 0 |
| Neerude ja kuseteede häired | ||
| Polüuuria | 1 | 0 |
| Hingamisteede, rindkere ja mediastiinumi häired | ||
| Hingeldus | 1 | 0 |
| Naha ja nahaaluste kudede häired | ||
| Lööve | 2 | 0 |
| Kontakt dermatiit | 1 | 0 |
| Hüperhüdroos | 1 | 0 |
Kõrvaltoimete sõltuvus annusest
Platseebokontrollitud kliinilistes uuringutes, kus võrreldi Nuvigili ja platseebo annuseid 150 mg päevas ja 250 mg päevas, ainsad annusest sõltuvad kõrvaltoimed olid peavalu, lööve, depressioon, suukuivus, unetus ja iiveldus.
ª Neli topeltpimedat, platseebokontrollitud kliinilist uuringut SWSD, OSAHS ja narkolepsia korral. | ||||
| Organisüsteemi klass MedDRA eelistatud termin |
Nuvigil 250 mg (Protsent, N = 198) |
Nuvigil 150 mg (Protsent, N = 447) |
Nuvigil Kombineeritud (Protsent, N = 645) |
Platseebo (Protsent, N = 445) |
|---|---|---|---|---|
| Seedetrakti häired | ||||
| Iiveldus | 9 | 6 | 7 | 3 |
| Kuiv suu | 7 | 2 | 4 | <1 |
| Närvisüsteemi häired | ||||
| Peavalu | 23 | 14 | 17 | 9 |
| Psühhiaatrilised häired | ||||
| Unetus | 6 | 4 | 5 | 1 |
| Depressioon | 3 | 1 | 2 | <1 |
| Naha ja nahaaluste kudede häired | ||||
| Lööve | 4 | 1 | 2 | <1 |
Vital märkide muutused
Kontrollitud uuringutes esines süstoolse ja diastoolse vererõhu keskmiste väärtuste väikest, kuid järjepidevat tõusu (vt. Ettevaatusabinõud). Kontrollitud uuringutes oli pulsisageduse keskmine kasv platseeboga võrreldes väike, kuid püsiv. See tõus varieerus vahemikus 0,9 kuni 3,5 BPM.
Laboratoorsed muudatused
Uuringutes jälgiti kliinilist keemiat, hematoloogiat ja uriinianalüüsi parameetreid. Gammaglutamüültransferaasi (GGT) ja aluselise fosfataasi (AP) keskmised plasmatasemed leiti olevat pärast NUVIGIL'i manustamist kõrgemad, kuid mitte platseebo. Kuid vähestel katsealustel esines GGT või AP tõus väljaspool normi. Erinevusi alaniinaminotransferaasi, aspartaataminotransferaasi, üldvalgu, albumiini või üldbilirubiini sisaldust, ehkki harva esines ASAT ja / või ALAT aktiivsuse tõusu üksikjuhtudel. Pärast 35-päevast ravi täheldati üksikut kerget pantsütopeeniat, mis lahenes ravi katkestamisega. Kliinilistes uuringutes täheldati seerumi kusihappe väikest keskmist langust algtasemest võrreldes platseeboga. Selle leiu kliiniline tähtsus pole teada.
EKG muutused
Platseebokontrollitud kliinilistes uuringutes ei saanud NUVIGILi manustamisel EKG kõrvalekaldeid täheldada.
ülaosa
Uimastite kuritarvitamine ja sõltuvus
Kontrollitav aineklass
Armodafiniil (NUVIGIL) on IV nimekirja kuuluv kontrollitav aine.
Kuritarvitamise potentsiaal ja sõltuvus
Kuigi armodafiniili kuritarvitamise potentsiaali pole spetsiaalselt uuritud, on selle kuritarvitamise potentsiaal tõenäoliselt sarnane modafiniiliga (PROVIGIL). Inimestel põhjustab modafiniil psühhoaktiivseid ja eufoorilisi mõjusid, tuju, taju, mõtlemise ja tunnete muutusi, mis on tüüpilised teistele kesknärvisüsteemi stimulantidele. In vitro seondumise uuringutes seostub modafiniil dopamiini tagasihaardekohaga ja põhjustab rakuvälise dopamiini suurenemist, kuid dopamiini vabanemise suurenemist ei toimu. Modafiniil tugevdab, mida tõendab selle isemajandamine ahvidel, kes on eelnevalt koolitatud kokaiini ise manustama. Mõnes uuringus eristati modafiniili osaliselt ka stimulantide moodi. Arstid peaksid hoolikalt jälgima patsiente, eriti neid, kellel on varem esinenud narkootikume ja / või stimulante (nt metüülfenidaat, amfetamiin või kokaiin). Patsiente tuleb jälgida väärkasutuse või kuritarvitamise tunnuste osas (nt annuste suurendamine või uimastite otsimise käitumine).
Modafiniili (200, 400 ja 800 mg) kuritarvitamise potentsiaali hinnati metüülfenidaadi (45 ja 90 mg) suhtes statsionaarses uuringus isikutel, kes olid kogenud kuritarvitamisega ravimeid. Selle kliinilise uuringu tulemused näitasid, et modafiniil tekitas psühhoaktiivseid ja eufoorilisi toimeid ja tundeid, mis olid kooskõlas teiste kavandatud kesknärvisüsteemi stimulantidega (metüülfenidaat).
ülaosa
Üleannustamine
Inimkogemus
NUVIGILi kliinilistes uuringutes ei olnud üleannustamist täheldatud. NUVIGILi üleannustamise sümptomid on tõenäoliselt sarnased modafiniiliga. Modafiniili kliinilistes uuringutes sisaldas üleannustamine erutust või agitatsiooni, unetust ning hemodünaamiliste parameetrite kerget või mõõdukat tõusu. Modafiniili turustusjärgsetest kogemustest ei ole teatatud surmaga lõppevatest üledoosidest, mis hõlmaksid ainult modafiniili (annused kuni 12 grammi). Mitut ravimit, sealhulgas modafiniili hõlmavate üledooside tagajärg on surmav. Kaasatud on sümptomid, mis enamasti kaasnevad modafiniili üledoosiga, üksi või koos teiste ravimitega; unetus; kesknärvisüsteemi sümptomid nagu rahutus, desorientatsioon, segasus, erutus ja hallutsinatsioonid; seedetrakti muutused nagu iiveldus ja kõhulahtisus; ja kardiovaskulaarsed muutused, nagu tahhükardia, bradükardia, hüpertensioon ja valu rinnus.
Üleannustamise ravi
NUVIGILi üleannustamise toksiliste mõjude jaoks puudub spetsiifiline antidoot. Selliseid üledoose tuleb ravida peamiselt toetava raviga, sealhulgas kardiovaskulaarse jälgimisega. Kui vastunäidustusi pole, tuleks kaaluda esilekutsutud oksendamist või maoloputust. Puuduvad andmed, mis viitaksid dialüüsi või uriini hapendamise või leelistamise kasulikkusele ravimi eliminatsiooni suurendamisel. Arst peaks üleannustamise ravimisel võtma ühendust mürgistuskontrolli keskusega.
ülaosa
Annustamine ja manustamine
Obstruktiivne uneapnoe / hüpopnea sündroom (OSAHS) ja narkolepsia
NUVIGILi soovitatav annus OSAHS-i või narkolepsiaga patsientidele on 150 mg või 250 mg, manustatuna ühekordse annusena hommikul. OSAHS-iga patsientidel on ühekordse annusena manustatud annused kuni 250 mg / päevas hästi talutavad, kuid ei ole järjepidevaid tõendeid selle kohta, et see annus annab 150 mg / päevas annusest suuremat lisatoetust (vt Kliiniline farmakoloogia ja Kliinilistes uuringutes).
Töövahetuse unehäire (SWSD)
NUVIGILi soovitatav annus SWSD-ga patsientidele on 150 mg päevas umbes 1 tund enne töövahetuse algust.
Samaaegsete ravimite, mis on CYP3A4 / 5 substraadid, nagu steroidsed rasestumisvastased vahendid, triasolaam ja tsüklosporiin, annuse kohandamist tuleks kaaluda (vt ETTEVAATUSABINÕUD, Koostoimed ravimitega).
Ravimitel, mis elimineeritakse suures osas CYP2C19 metabolismi kaudu, näiteks diasepaamil, propranoloolil ja fenütoiinil, võib olla pikaajaline eliminatsioon koos NUVIGIL'iga manustamisel ning võib vajada annuse vähendamist ja toksilisuse jälgimist (Vt Ettevaatusabinõud, Ravimite koostoimed).
Raske maksakahjustusega patsientidele tuleb NUVIGIL'i manustada vähendatud annuses (vt lõik 4.2) Kliiniline farmakoloogia ja Ettevaatusabinõud).
Raske neerukahjustusega patsientide jaoks annustamise ohutuse ja efektiivsuse määramiseks ei ole piisavalt teavet (vt Kliiniline farmakoloogia ja Ettevaatusabinõud).
Eakatel patsientidel võib armodafiniili ja selle metaboliitide eritumine vananemise tagajärjel väheneda. Seetõttu tuleks selles populatsioonis kaaluda väiksemate annuste kasutamist (vt Kliiniline farmakoloogia ja Ettevaatusabinõud).
ülaosa
Kuidas komplekteeritud / ladustamine ja käitlemine
Nuvigil® (armodafiniil) tabletid [C-IV]
50 mg: iga ümmarguse, valge kuni valkja tableti siltidega on pressitud  ühel küljel ja "205" teisel.
ühel küljel ja "205" teisel.
NDC 63459-205-60 - pudelid 60-st
150 mg: iga ovaalse, valge kuni valkja tableti siltidega on trükitud  ühel küljel ja "215" teisel.
ühel küljel ja "215" teisel.
NDC 63459-215-60 - pudelid 60-st
250 mg: iga ovaalse, valge kuni valkja tableti siltidega on trükitud  ühel küljel ja "225" teisel.
ühel küljel ja "225" teisel.
NDC 63459-225-60 - pudelid 60-st
Hoida temperatuuril 20–25 ° C (68–77 ° F).
Toodetud:
Cephalon, Inc.
Frazer, PA 19355
viimati uuendatud 02/2010
Nuvigili patsiendi infoleht (lihtsas inglise keeles)
Üksikasjalik teave saidil Unehäirete nähud, sümptomid, põhjused, ravi
Selles monograafias sisalduv teave ei hõlma kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet ega kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi:
~ kõik artiklid magamishäirete kohta

