Kofeiintsitraat: stimulant (täielik teave ravimi väljakirjutamise kohta)
Brändinimi: Cafcit
Üldnimi: kofeiintsitraat
Annustamisvorm: süst
Kofeiintsitraat on kesknärvisüsteemi stimulant, mis on saadaval Cafcitina ja mida kasutatakse imikute apnoe raviks. Kasutamine, annustamine, kõrvaltoimed.
Sisu:
Kirjeldus
Kliiniline farmakoloogia
Näidustused ja kasutamine
Hoiatused
Ettevaatusabinõud
Kõrvaltoimed
Üleannustamine
Annustamine ja manustamine
Kuidas komplektis
Patsiendi teave kofeiintsitraadi kohta (lihtsas inglise keeles)
Kirjeldus
Nii kofeiintsitraadi süste intravenoosseks manustamiseks kui ka kofeiintsitraadi suukaudne lahus on selge, värvitu, steriilne, mittepürogeenne, säilitusainevabad vesilahused, mille pH on reguleeritud 4,7-ni. Üks ml sisaldab 20 mg kofeiintsitraati (vastab 10 mg kofeiinialusele), mis on valmistatud lahus, lisades 10 mg veevaba kofeiini, USP, 5 mg sidrunhappe monohüdraadile, USP, 8,3 mg naatriumtsitraadi dihüdraati, USP ja vett Süstimine, USP.
Kofeiin, kesknärvisüsteemi stimulant, on lõhnatu valge kristalne pulber või graanulid, millel on kibe maitse. Toatemperatuuril on see vees ja etanoolis halvasti lahustuv. Kofeiini keemiline nimetus on 3,7-dihüdro-1,3,7-trimetüül-1 H-puriin-2,6-dioon. Sidrunhappe juuresolekul moodustab see lahuses kofeiintsitraadi soola. Järgneb kofeiintsitraadi struktuurivalem ja molekulmass.
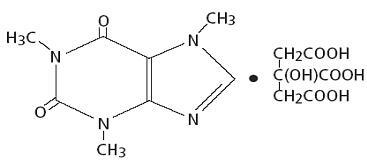
Kofeiintsitraat
C14H18N4O9 Mol. Wt. 386,31
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Kofeiin on struktuurilt seotud teiste metüülksantiinide, teofülliini ja teobromiiniga. See on bronhide silelihasrelaksant, kesknärvisüsteemi stimuleeriv aine, südamelihase stimulant ja diureetikum.
jätka lugu allpool
Ehkki kofeiini toimemehhanism enneaegse apnoe korral pole teada, on hüpoteesitud mitmele mehhanismile. Nende hulka kuuluvad: (1) hingamiskeskuse stimuleerimine, (2) suurenenud ventilatsioon minutiga, (3) hüperkapnia läve vähenemine, (4) suurenenud reageerimine kuni hüperkapniani, (5) suurenenud skeletilihaste toonus, (6) vähenenud diafragmaatiline väsimus, (7) suurenenud ainevahetuse kiirus ja (8) suurenenud hapniku sisaldus tarbimine.
Enamik neist mõjudest on tingitud kofeiini adenosiini retseptorite antagonismist, nii A1 kui ka A2 alatüüpidest, mis Seda on tõestatud retseptori sidumiskatsetes ja täheldatud kontsentratsioonidel, mis lähenevad terapeutiliselt saavutatule.
Farmakokineetika
Imendumine: Pärast 10 mg kofeiini aluse suukaudset manustamist enneaegsetele vastsündinutele on maksimaalne plasmakontsentratsioon (Cmax) kofeiini sisaldus oli vahemikus 6-10 mg / L ja piigi kontsentratsiooni saavutamise keskmine aeg (Tmax) kestis 30 minutit kuni 2 tundi. Tmax ei mõjutanud piimasegu söötmine. Absoluutset biosaadavust ei olnud enneaegsetel vastsündinutel siiski täielikult uuritud.
Jaotumine: kofeiin jaotub kiiresti ajus. Kofeiini tase enneaegsete vastsündinute tserebrospinaalvedelikus on ligikaudne nende plasmakontsentratsioon. Kofeiini keskmine jaotusruumala väikelastel (0,8–0,9 l / kg) on pisut suurem kui täiskasvanutel (0,6 l / kg). Andmed vastsündinute ja imikute plasmavalkudega seondumise kohta puuduvad. Täiskasvanutel on keskmine plasmavalkudega seondumine in vitro umbes 36%.
Metabolism: Kofeiini biotransformatsioonis osaleb maksa tsütokroom P450 1A2 (CYP1A2). Kofeiini metabolism enneaegsetel vastsündinutel on piiratud nende ebaküpsete maksaensüümide tõttu.
Enneaegsetel vastsündinutel on teatatud kofeiini ja teofülliini vahelisest teisenemisest; kofeiini tase on pärast teofülliini manustamist umbes 25% teofülliini tasemest ja eeldatakse, et umbes 3–8% manustatud kofeiinist muundub teofülliiniks.
Eliminatsioon: noorte imikute puhul on kofeiini eliminatsioon maksa ja / või neerufunktsiooni tõttu palju aeglasem kui täiskasvanutel. Keskmine poolestusaeg (T1/2) ja fraktsioon, mis eritub muutumatul kujul uriiniga (Ae) Kofeiini sisaldus imikutel on osutunud pöördvõrdeliseks rasedusjärgse / kontseptuaalse vanusega. Vastsündinutel on T1/2 on umbes 3-4 päeva ja Ae on umbes 86% (6 päeva jooksul). 9 kuu vanuseks on kofeiini metabolism täiskasvanute omadega sarnane (T1/2 = 5 tundi ja Ae = 1%).
Spetsiaalsed populatsioonid: Kofeiini farmakokineetikat maksa- või neerupuudulikkusega vastsündinutel ei ole läbi viidud. Kofeiintsitraati tuleb neeru- või maksafunktsiooni kahjustusega enneaegsetele vastsündinutele manustada ettevaatusega. Selle populatsiooni toksilisuse vältimiseks tuleb jälgida kofeiini kontsentratsiooni seerumis ja kohandada kofeiintsitraadi annust.
Kliinilised uuringud
Ühes multitsentrilises randomiseeritud topeltpimedas uuringus võrreldi kofeiintsitraati platseeboga kaheksakümne viiel (85) enneaegsel imikul (tiinuse vanus 28 kuni <33 nädalat) enneaegse apnoega. Enneaegset apnoed defineeriti kui vähemalt 6 apnoeperioodi, mis kestsid 24-tunnise perioodi jooksul üle 20 sekundi ja millel pole muud tuvastatavat apnoe põhjust. Intravenoosselt manustati 1 ml / kg (20 mg / kg kofeiintsitraati, kofeiinialusena 10 mg / kg) kofeiintsitraadi küllastusannust, millele järgnes 0,25 ml / kg (5 mg / kg kofeiintsitraati, mis annab 2,5 mg / kg kofeiini alust) ööpäevane säilitusannus, manustatuna intravenoosselt või suu kaudu (tavaliselt söötmise kaudu) toru). Ravi kestus selles uuringus oli 10 kuni 12 päeva. Protokoll võimaldas imikuid "päästa" kofeiintsitraadiga avatud raviga, kui nende apnoe oli uuringu topeltpimedas faasis kontrollimatu.
Apnoeta patsientide protsent ravi teisel päeval (24–48 tundi pärast küllastusannust) oli kofeiintsitraadiga võrreldes platseeboga võrreldes oluliselt suurem. Järgmine tabel võtab kokku selles uuringus hinnatud kliiniliselt olulised tulemusnäitajad: klipp
| Kofeiintsitraat | Platseebo | p-väärtus | |
|---|---|---|---|
| Hinnatud patsientide arv * | 45 | 37 | |
| % patsientidest, kellel 2. päeval ei esinenud apnoe | 26.7 | 8.1 | 0.03 |
| Apnoe esinemissagedus 2. päeval (24 tunni kohta) | 4.9 | 7.2 | 0.134 |
| % patsientidest, kelle apnoe esinemissagedus vähenes 50% võrreldes algtasemega 2. päeval | 76 | 57 | 0.07 |
| * Ravimit saanud 85-st patsiendist 3 ei kaasatud efektiivsuse analüüsi, kuna neil oli <6 apnoeepisoodi 24 tunni jooksul. |
Selles 10–12-päevases uuringus oli null-apnoeta sündmuste keskmine arv päevi 3 kofeiintsitraadi rühmas ja 1,2 platseeborühmas. Apnoejuhtude vähenemine keskmiselt 50% võrreldes algtasemega oli keskmiselt 6,8 päeva kofeiintsitraadi rühmas ja 4,6 platseeborühmas.
ülaosa
Näidustused ja kasutamine
Kofeiintsitraadi süstelahus ja kofeiintsitraadi suukaudne lahus on näidustatud enneaegse apnoe lühiajaliseks raviks imikutel vanuses 28 kuni <33 rasedusnädalat.
ülaosa
Vastunäidustused
Kofeiintsitraadi süste ja kofeiintsitraadi suukaudne lahus on vastunäidustatud patsientidele, kellel on ilmnenud ülitundlikkus selle koostisosade suhtes.
ülaosa
Hoiatused
Topeltpimedas, platseebokontrollitud kliinilises uuringus tekkis 85 uuritud imiku hulgas 6 nekrootilise enterokoliidi juhtu (kofeiin = 46, platseebo = 39), 3 juhul lõppes surm. Kuuest nekrotiseeriva enterokoliidiga patsiendist viis randomiseeriti kofeiintsitraadiga või olid seda saanud.
Avaldatud kirjanduse aruannetes on tõstatatud küsimus metüülksantiinide kasutamise võimaliku seose kohta nekrotiseeriva enterokoliidi teke, kuigi põhjuslikku seost metüülksantiini kasutamise ja nekrotiseeriva enterokoliidi vahel pole asutatud. Seetõttu, nagu kõigi enneaegsete imikute puhul, tuleb kofeiintsitraadiga ravitavaid patsiente hoolikalt jälgida nekrotiseeriva enterokoliidi tekke suhtes.
ülaosa
Ettevaatusabinõud
Üldine
Enneaegse sünnituse apnoe on välistamise diagnoos. Muud apnoe põhjused (nt kesknärvisüsteemi häired, esmane kopsuhaigus, aneemia, sepsis, metaboolsed häired, kardiovaskulaarsed häired või obstruktiivne apnoe) tuleks enne kofeiini kasutamist välistada või korralikult ravida Tsitraat.
Kofeiin on kesknärvisüsteemi stimulant ja kofeiini üleannustamise korral on teatatud krambihoogudest. Kofeiintsitraati tuleb krambihäiretega väikelastel kasutada ettevaatusega.
Platseebokontrollitud uuringus enneaegse apnoe ravi kestus oli 10 kuni 12 päeva. Kofeiintsitraadi ohutus ja efektiivsus pikema raviperioodi jooksul pole tõestatud. Kofeiintsitraadi ohutus ja tõhusus imiku äkksurma profülaktiliseks raviks sündroomi (SIDS) ega enne ekstubatsiooni ka mehhaaniliselt ventileeritavatel imikutel asutatud.
Kardiovaskulaarsed
Ehkki platseebo-kontrollitud uuringus ei ole teatatud südametoksilisuse juhtudest, on avaldatud uuringutes näidatud, et kofeiin suurendab südame löögisagedust, vasaku vatsakese väljundit ja insuldi mahtu. Seetõttu tuleks kofeiintsitraati kasutada ettevaatusega südame-veresoonkonna haigustega väikelastel.
Neerude ja maksa süsteemid
Neeru- või maksafunktsiooni häirega imikutele tuleb kofeiintsitraati manustada ettevaatusega. Selle populatsiooni toksilisuse vältimiseks tuleb jälgida kofeiini kontsentratsiooni seerumis ja kohandada kofeiintsitraadi annust. (Vt Kliiniline farmakoloogia, Elimineerimine, eripopulatsioonid.)
Teave patsientidele
Kofeiintsitraadi suukaudset lahust saavate patsientide vanemad / hooldajad peaksid saama järgmised juhised:
- Kofeiintsitraadi suukaudne lahus ei sisalda säilitusaineid ja iga viaal on mõeldud ainult ühekordseks kasutamiseks. Kasutamata ravimiosa tuleb ära visata.
- On oluline, et kofeiintsitraadi suukaudse lahuse annust mõõdetaks täpselt, st 1 cm3 või muu sobiva süstlaga.
- Pidage nõu oma arstiga, kui lapsel jätkub apnoe; ärge suurendage kofeiintsitraadi suukaudse lahuse annust ilma arsti konsultatsioonita.
- Pidage nõu oma arstiga, kui lapsel ilmnevad seedetrakti talumatuse nähud, nagu kõhu paisumine, oksendamine või verine väljaheide, või kui see tundub unine.
- Kofeiintsitraadi suukaudset lahust tuleb enne manustamist visuaalselt kontrollida, ega selles pole osakesi ega värvuse muutusi. Viaalid, mis sisaldavad värvimuutust või nähtavaid osakesi, tuleb minema visata.
Laborikatsed
Enne kofeiintsitraadi manustamist tuleb kofeiini sisaldust seerumis mõõta algväärtustes - varem teofülliiniga ravitud imikud, kuna enneaegsed imikud metaboliseerivad teofülliini kofeiin. Samuti tuleks mõõta kofeiinitaset seerumis algsetel imikutel, kes on sündinud emadele, kes tarbisid kofeiini enne sünnitust, kuna kofeiin läbib platsenta kergesti.
Platseebokontrollitud kliinilises uuringus oli kofeiini tase vahemikus 8 kuni 40 mg / l. Platseebokontrollitud kliinilises uuringus ei olnud võimalik kofeiini terapeutilist plasmakontsentratsioonivahemikku määrata. Kirjanduses on teatatud tõsisest toksilisusest, kui kofeiini sisaldus seerumis ületab 50 mg / L. Toksilisuse vältimiseks tuleb kogu ravi vältel perioodiliselt jälgida kofeiini kontsentratsiooni seerumis.
Kirjanduses avaldatud kliinilistes uuringutes on täheldatud hüpoglükeemia ja hüperglükeemia juhtumeid. Seetõttu võib kofeiintsitraati saavatel imikutel olla vaja perioodiliselt kontrollida seerumi glükoosisisaldust.
Ravimite koostoimed
Tsütokroom P450 1A2 (CYP1A2) on teadaolevalt peamine kofeiini metabolismis osalev ensüüm. Seetõttu on kofeiinil võimalik suhelda ravimitega, mis on CYP1A2 substraadid, inhibeerivad CYP1A2 või indutseerivad CYP1A2.
Umbes andmeid ravimite koostoime kohta kofeiiniga enneaegsetel vastsündinutel. Täiskasvanute andmete põhjal võib pärast ravimite, mis väidetavalt vähendavad kofeiini eritumist (nt tsimetidiin) koosmanustamist vajada väiksemat kofeiini annust kofeiini eritumist suurendavate ravimite (nt fenobarbitaal ja fenütoiin) samaaegse manustamise korral võivad olla vajalikud suuremad kofeiini annused.
Samaaegselt ketoprofeeniga manustatud kofeiin vähendas neljal tervel vabatahtlikul uriini kogust. Selle koostoime kliiniline tähtsus enneaegsetel vastsündinutel pole teada.
Enneaegsetel vastsündinutel on teatatud kofeiini ja teofülliini vaheldumisest. Nende ravimite samaaegset kasutamist ei soovitata.
Kantserogenees, mutagenees, viljakuse langus
2-aastases Sprague-Dawley rottidega läbiviidud uuringus ei olnud joogivees manustatud kofeiin (kofeiini alusena) kartsinogeenne isastel rottidel annuste korral kuni 102 mg / kg või emastel rottidel annustes kuni 170 mg / kg (vastavalt umbes 2 ja 4 korda maksimaalne soovitatav veenisisene küllastusannus imikutele mg / m2 alus). 18-kuulises C57BL / 6 hiirtega läbi viidud uuringus ei täheldatud kasvajatogeensuse tõendeid dieediannuste kuni 55 mg / kg korral (vähem kui maksimaalne soovitatav veenisisene küllastusannus imikutele annuses mg / m2 alus).
Kofeiin (kofeiinialusena) suurendas hiire in vivo metafaasianalüüsis õdekromatiidivahetust (SCE) SCE / raku metafaasi (sõltub kokkupuuteajast). Kofeiin tugevdas ka teadaolevate mutageenide genotoksilisust ja suurendas mikrotuumade moodustumist (5-kordselt) folaadivaegusega hiirtel. Kuid kofeiin ei suurendanud in vitro hiina hamstri munasarjarakkude (CHO) ja inimese lümfotsüütide testides kromosomaalseid aberratsioone ning oli ei ole mutageenne in vitro CHO / hüpoksantiin guaniini fosforibosüültransferaasi (HGPRT) geenimutatsiooni katses, välja arvatud tsütotoksilisel kontsentratsioonid. Lisaks ei olnud kofeiin hiire in vivo mikrotuuma testis klastogeenne.
Kofeiin (kofeiinialusena), manustatud isastele rottidele annuses 50 mg / kg / päevas subkutaanselt (ligikaudu võrdne imikutele soovitatava maksimaalse intravenoosse küllastusannusega mg / m2 põhjal) 4 päeva enne töötlemata emasloomadega paaritamist põhjustas lisaks embrüotoksilisusele ka meeste reproduktiivsuse langust. Lisaks oli kofeiini suurte suukaudsete annuste (3 g 7 nädala jooksul) pikaajaline kokkupuude rottide munanditega toksiline, väljendudes spermatogeensete rakkude degeneratsioonil.
Rasedus: C-kategooria rasedus
Mure kofeiini teratogeensuse pärast ei ole imikutele manustamisel oluline. Täiskasvanud loomadega läbiviidud uuringutes manustati tiinetele hiirtele kofeiini (kofeiinialusena) toimeainet prolongeeritult vabastavad graanulid annuses 50 mg / kg (väiksem kui maksimaalne soovitatav veenisisene küllastusannus imikutele) mg / m2 alusel) põhjustas organogeneesi perioodil suulaelõhe ja eksentsefaalia vähest esinemist lootel. Rasedatel ei ole piisavalt ja hästi kontrollitud uuringuid.
ülaosa
Kõrvaltoimed
Üldiselt oli kontrollitud uuringu topeltpimedal perioodil teatatud kõrvaltoimete arv kofeiintsitraadi ja platseebo rühmas sarnane. Järgmises tabelis on toodud kontrollitud uuringu topeltpimedal perioodil ilmnenud kõrvaltoimed, mida esines kofeiintsitraadiga ravitud patsientidel sagedamini kui platseebot.
| Ebasoodne sündmus (AE) | Kofeiintsitraat N = 46 n (%) |
Platseebo N = 39 n (%) |
|---|---|---|
| KEHA KUI TÄIS | ||
| Juhuslik vigastus | 1 (2.2) | 0 (0.0) |
| Söötmatus | 4 (8.7) | 2 (5.1) |
| Sepsis | 2 (4.3) | 0 (0.0) |
| KARDIOVASKULAARSÜSTEEM | ||
| Hemorraagia | 1 (2.2) | 0 (0.0) |
| SEEDEELUNDKOND | ||
| Nekrotiseeriv enterokoliit | 2 (4.3) | 1 (2.6) |
| Gastriit | 1 (2.2) | 0 (0.0) |
| Seedetrakti verejooks | 1 (2.2) | 0 (0.0) |
| KEEMILISED JA LÜMFAATILISED SÜSTEEMID | ||
| Levinud intravaskulaarne koagulatsioon | 1 (2.2) | 0 (0.0) |
| METABOOLSED JA TOITLIKUD RIKKUMISED | ||
| Atsidoos | 1 (2.2) | 0 (0.0) |
| Paranemine ebanormaalne | 1 (2.2) | 0 (0.0) |
| NÄRVISÜSTEEM | ||
| Aju verejooks | 1 (2.2) | 0 (0.0) |
| HINGAMISSÜSTEEM | ||
| Hingeldus | 1 (2.2) | 0 (0.0) |
| Kopsu tursed | 1 (2.2) | 0 (0.0) |
| NAHK JA LISAD | ||
| Kuiv nahk | 1 (2.2) | 0 (0.0) |
| Lööve | 4 (8.7) | 3 (7.7) |
| Naha lagunemine | 1 (2.2) | 0 (0.0) |
| ERISÕNUMID | ||
| Enneaegsuse retinopaatia | 1 (2.2) | 0 (0.0) |
| UROGENITAALNE SÜSTEEM | ||
| Neerupuudulikkus | 1 (2.2) | 0 (0.0) |
Lisaks ülaltoodud juhtudele diagnoositi uuringu avatud faasis kofeiintsitraati saanud patsientidel kolm nekrotiseeriva enterokoliidi juhtu.
Kolm imikut, kellel tekkis uuringu käigus nekrootiline enterokoliit, suri. Kõik olid kokku puutunud kofeiiniga. Kaks randomiseeriti kofeiiniks ja üks platseeboga patsient "päästeti" kontrollimatu apnoe jaoks avatud kofeiiniga.
Avaldatud kirjanduses kirjeldatud kõrvalnähtude hulka kuuluvad: kesknärvisüsteemi stimuleerimine (st ärrituvus, rahutus, närvilisus), kardiovaskulaarsed mõjud (s.o. tahhükardia, vasaku vatsakese suurenenud väljund ja suurenenud insuldi maht), seedetrakti toimed (st suurenenud mao aspiraat, seedetrakti talumatus), seerumi glükoosisisalduse muutused (hüpoglükeemia ja hüperglükeemia) ning neerude mõjud (suurenenud uriini voolukiirus, suurenenud kreatiniini kliirens ja suurenenud naatriumi ja kaltsiumi sisaldus) eritumine). Avaldatud pikaajalised järeluuringud ei ole näidanud, et kofeiin kahjustaks neuroloogilist arengut või kasvunäitajaid.
ülaosa
Üleannustamine
Pärast üleannustamist on kofeiini sisaldus seerumis olnud umbes 24 mg / L (turuletulekujärgne periood) spontaanne juhtum, kus imikul ilmnes ärrituvus, halb toitmine ja unetus) kuni 350-ni mg / l. Tõsist toksilisust on seostatud seerumi sisaldusega üle 50 mg / L (vt punkt 4.2) Ettevaatusabinõud-Labori testid ja Annustamine ja manustamine). Pärast kofeiini üledoosi enneaegsetel imikutel on kirjanduses teatatud nähtude ja sümptomite hulka palavik, tahhüpnea, tuimus, unetus, jäsemete peen värisemine, hüpertoonia, opisthotonos, toonilis-kloonilised liigutused, lõualuude ja huulte mittesihipärased liigutused, oksendamine, hüperglükeemia, kõrgenenud vere uurea lämmastiku ja kõrgenenud leukotsüütide arv kontsentratsioon. Krampe on teatatud ka üleannustamise juhtudest. On teatatud ühest kofeiini üleannustamise juhtumist, mis on komplitseeritud intraventrikulaarse hemorraagia ja pikaajaliste neuroloogiliste tagajärgedega. Hinnanguliselt 600 mg kofeiintsitraadi (umbes 322 mg / kg) 40 minuti jooksul manustatud kofeiintsitraadi (Uus-Meremaalt) üledoseerimise komplitseeris tahhükardia, ST-depressioon, hingamishäired, südamepuudulikkus, maopeetus, atsidoos ja tugev ekstravasatsioon põletik koos perifeerse intravenoosse koe nekroosiga süstekoht. Kofeiini üledoseerimisega seotud surmajuhtumeid enneaegsetel imikutel ei ole teatatud.
Kofeiini üleannustamise ravi on peamiselt sümptomaatiline ja toetav. On näidatud, et kofeiini sisaldus väheneb pärast vereülekannet. Krampe võib ravida diasepaami või barbituraadi, näiteks pentobarbitaalnaatriumi intravenoosse manustamisega.
ülaosa
Annustamine ja manustamine
Enne kofeiintsitraadi manustamist tuleb kofeiini sisaldust seerumis mõõta algväärtustes - varem teofülliiniga ravitud imikud, kuna enneaegsed imikud metaboliseerivad teofülliini kofeiin. Samuti tuleks mõõta kofeiinitaset seerumis algsetel imikutel, kes on sündinud emadele, kes tarbisid kofeiini enne sünnitust, kuna kofeiin läbib platsenta kergesti.
Järgneb kofeiintsitraadi soovitatav annus ja säilitusannus.
| Kofeiintsitraadi annus Maht |
Kofeiintsitraadi annus mg / kg |
Tee | Sagedus | |
|---|---|---|---|---|
| Laadimisannus | 1 ml / kg | 20 mg / kg | Intravenoosne (üle 30 minuti) | Üks kord |
| Säilitusannus | 0,25 ml / kg | 5 mg / kg | Intravenoosne (üle 10 minuti) või suu kaudu | Iga 24 tunni järel ** |
| * kasutades süstla infusioonipumpa ** algab 24 tundi pärast küllastusannust |
Pange tähele, et kohvipõhja annus on vaid pool, kui seda väljendatakse kofeiintsitraadina (nt 20 mg kofeiintsitraati on ekvivalentne 10 mg kofeiinialusega).
Toksilisuse vältimiseks tuleb kogu ravi vältel perioodiliselt jälgida kofeiini kontsentratsiooni seerumis. Tõsist toksilisust on seostatud seerumi sisaldusega üle 50 mg / L.
Kofeiintsitraadi süste ja kofeiintsitraadi suukaudset lahust tuleb enne manustamist visuaalselt kontrollida, ega selles pole osakesi ega värvuse muutusi. Viaalid, mis sisaldavad värvimuutust või nähtavaid osakesi, tuleb minema visata.
Ravimite ühilduvus
Ravimi ühilduvuse kontrollimiseks tavaliste intravenoossete lahuste või ravimitega süstiti 20 ml kofeiintsitraati koos 20 ml lahuse või ravimiga, välja arvatud Intralipid® segu, mida kombineeriti 80 ml / 80 ml. Kombineeritud lahuste füüsikalist välimust hinnati sademete osas. Segusid segati 10 minutit ja seejärel määrati kofeiini sisaldus. Seejärel segati segu 24 tunni jooksul pidevalt, lisaproovid kofeiinianalüüside jaoks tehti 2, 4, 8 ja 24 tunni pärast.
Selle katsetamise põhjal on 60 mg / 3 ml kofeiintsitraadi süstimisel keemiliselt stabiilne 24 tundi toatemperatuuril, kui seda kombineerida järgmiste testitavate toodetega.
- Dekstroosi süst, USP 5%
- 50% dekstroosisüst
- Intralipiidne® 20% IV rasvaemulsioon
- Aminosyn® 8,5% kristalne aminohappe lahus
- Dopamiini HCI süste, USP 40 mg / ml, lahjendatud dekstroosi süstiga 0,6 mg / ml, USP 5%
- Kaltsiumglükonaadi süst, USP 10% (0,465 mekv / Ca + 2 / ml)
- Naatriumhepariini süste, USP 1000 ühikut / ml, lahjendatud dekstroosi süstimisega 1 ühikuni / ml, USP 5%
- Fentanüültsitraadi süste, USP 50 ug / ml, lahjendatud dekstroosisüstiga 10 ug / ml, USP 5%
ülaosa
Kuidas komplektis
Nii kofeiintsitraadi süstelahus kui ka kofeiintsitraadi suukaudne lahus on saadaval selgete, värvitu, steriilsete, mittepürogeensete, säilitusaineteta vesilahustena 5 ml värvitu klaasviaalis. Kofeiintsitraadi süsteviaalid on suletud halli kummikorgi ja valge eemaldatava alumiiniumist korgiga, millele on punasega trükitud "AINULT INTRAVENOOSseks KASUTAMISEKS". Kofeiintsitraadi suukaudse lahuse viaalid on suletud halli kummikorgi ja tumesinisega matt viimistlus, eemaldage maha rebitav alumiiniumist tihend, millele on trükitud tekst "AINULT SUULISEKS KASUTAMISEKS - PÖÖRAKE & TEAR" valge.
Nii süste- kui ka suukaudse lahuse viaalid sisaldavad 3 ml lahust kontsentratsioonis 20 mg / ml kofeiintsitraati (60 mg / viaal), mis vastab 10 mg / ml kofeiini alusele (30 mg / viaal).
Kofeiintsitraadi süst, USP
NDC 47335-289-40: 3 ml viaal, pakendatud eraldi karbis.
Kofeiintsitraadi suukaudne lahus, USP
NDC 47335-290-44: 3 ml viaal (MITTE LASTELE vastupidav), 10 viaali valge kohta
polüpropüleenist lastekindel konteiner.
Hoida temperatuuril 20–25 ° C (68–77 ° F); ekskursioonid on lubatud vahemikus 15 ° C kuni 30 ° C (59 ° kuni 86 ° F) [vaata USP kontrollitud ruumi temperatuuri].
Säilitusainete vaba. Ainult ühekordseks kasutamiseks. Visake kasutamata osa ära.
TÄHELEPANU FARMAKTIK: Eemaldage pakendi infolehelt "Kasutamisjuhised" ja loobuge kofeiintsitraadi suukaudse lahuse retseptidest.
Jaotatud:
Caraco Farmaatsialaborid, Ltd
1150 Elijah McCoy Drive, Detroit, MI 48202
Toodetud:
Sun Pharmaceutical Ind. OÜ
Halol-Baroda maanteel,
Halol-389 350, Gujarat, India.
viimati uuendatud 02/2010
Patsiendi teave kofeiintsitraadi kohta (lihtsas inglise keeles)
Üksikasjalik teave saidil Unehäirete nähud, sümptomid, põhjused, ravi
Selles monograafias sisalduv teave ei hõlma kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet ega kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi:
~ kõik artiklid magamishäirete kohta



