Actos II tüüpi diabeedi korral
Brändinimi: Actos
Üldnimi: Pioglitasoonvesinikkloriid
Sisu:
Kirjeldus
Farmakoloogia
Näidustused ja kasutamine
Vastunäidustused
Hoiatused
Ettevaatusabinõud
Kõrvaltoimed
Üleannustamine
Annustamine ja manustamine
Kuidas komplektis
Actos, pioglitasoon hcl, teave patsiendi kohta (lihtsas inglise keeles)
HOIATUS: SÜNNIVA SÜDAMISE Rikke
- Tiasolidiindioonid, sealhulgas Actos, põhjustavad või süvendavad mõnedel patsientidel südame paispuudulikkust (vt HOIATUSED). Pärast Actos'i kasutamise alustamist ja pärast annuse suurendamist jälgige patsiente hoolikalt südamepuudulikkuse nähtude ja sümptomite suhtes (sealhulgas liigne, kiire kaalutõus, hingeldus ja / või tursed). Kui need nähud ja sümptomid ilmnevad, tuleb südamepuudulikkust ravida vastavalt kehtivatele hooldusstandarditele. Lisaks tuleb kaaluda Actos'i kasutamise lõpetamist või annuse vähendamist.
- Actos'i ei soovitata kasutada sümptomaatilise südamepuudulikkusega patsientidel. Actos'e ravi alustamine patsientidel, kellel on tuvastatud NYHA III või IV klassi südamepuudulikkus, on vastunäidustatud (vt lõik 4.2) VASTUNÄIDUSTUSED ja HOIATUSED).
Kirjeldus
Actos (pioglitasoonvesinikkloriid) on suukaudne diabeedivastane aine, mis toimib peamiselt insuliiniresistentsuse vähendamise kaudu. Actost kasutatakse II tüüpi suhkurtõve (tuntud ka kui insuliinisõltumatu suhkruhaiguse (NIDDM) või täiskasvanutel tekkiva diabeedi) raviks. Farmakoloogilised uuringud näitavad, et Actos parandab lihaste ja rasvkoe tundlikkust insuliini suhtes ning pärsib maksa glükoneogeneesi. Actos parandab glükeemilist kontrolli, vähendades samal ajal ringleva insuliini taset.
Pioglitasoon [(±) -5 - [[4- [2- (5-etüül-2-püridinüül) etoksü] fenüül] metüül] -2,4-] tiasolidiindioonmonovesinikkloriid kuulub erineva keemilise klassiga ja sellel on erinev farmakoloogiline toime kui sulfonüüluurea, metformiinil või Î-glükosidaasil inhibiitorid. Molekul sisaldab ühte asümmeetrilist süsinikku, ühend sünteesitakse ja kasutatakse ratseemilise seguna. Pioglitasooni kaks enantiomeeri on in vivo teineteisega konversioonid. Kahe enantiomeeri farmakoloogilises aktiivsuses ei leitud erinevusi. Struktuurivalem on järgmine:
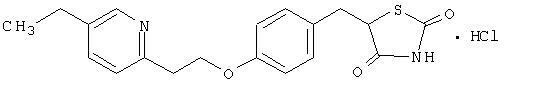
Pioglitasoonvesinikkloriid on lõhnatu valge kristalne pulber, mille molekulvalem on C19H20N2O3S-HCl ja molekulmass 392,90 daltonit. See lahustub N, N-dimetüülformamiidis, vähe lahustub veevabas etanoolis, väga vähe lahustub atsetoonis ja atsetonitriilis, praktiliselt vees ja eetris.
Actos on saadaval suukaudseks manustamiseks mõeldud tablettidena, mis sisaldavad 15 mg, 30 mg või 45 mg pioglitasooni (alusena), mis on valmistatud järgmised abiained: laktoosmonohüdraat NF, hüdroksüpropüültselluloos NF, karboksümetüültselluloosi kaltsium NF ja magneesiumstearaat NF.
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Actos on tiasolidiindioondiabeetikum, mille toimemehhanism sõltub insuliini olemasolust. Actos vähendab perifeerias ja maksas insuliiniresistentsust, suurendades insuliinist sõltuvat glükoosivarustust ja vähendades maksa glükoosisisaldust. Erinevalt sulfonüülkarbamiididest ei ole pioglitasoon insuliini sekreteerija. Pioglitasoon on tugev peroksisoomi proliferaatori aktiveeritud gamma-retseptori (PPARγ) agonist. PPAR-retseptoreid leidub kudedes, mis on olulised insuliini toimimiseks, näiteks rasvkoes, skeletilihastes ja maksas. PPARγ tuumaretseptorite aktiveerimine moduleerib paljude insuliinile reageerivate geenide transkriptsiooni, mis on seotud glükoosi ja lipiidide metabolismi juhtimisega.
Diabeedi loommudelites vähendab pioglitasoon hüperglükeemiat, hüperinsulineemiat ja hüpertriglütserideemiat, mis on iseloomulik insuliiniresistentsetele seisunditele nagu 2. tüüpi diabeet. Pioglitasooni põhjustatud metaboolsed muutused põhjustavad insuliinist sõltuvate kudede suuremat reageerimisvõimet ja neid täheldatakse paljudes insuliiniresistentsuse loommudelites.
Kuna pioglitasoon tugevdab tsirkuleeriva insuliini toimet (vähendades insuliiniresistentsust), ei alanda see endogeense insuliini puudunud loommudelites vere glükoosisisaldust.
Farmakokineetika ja ravimite metabolism
Pioglitasooni (pioglitasooni ja aktiivsete metaboliitide) kontsentratsioon seerumis püsib kõrge 24 tundi pärast üks kord päevas manustamist. Nii pioglitasooni kui ka kogu pioglitasooni püsikontsentratsioon seerumis saavutatakse 7 päeva jooksul. Püsiseisundi korral saavutavad kaks pioglitasooni farmakoloogiliselt aktiivset metaboliiti, metaboliidid III (M-III) ja IV (M-IV), seerumi kontsentratsiooni, mis on pioglitasooniga võrdne või suurem. Nii tervetel vabatahtlikel kui ka II tüüpi diabeediga patsientidel moodustas pioglitasoon umbes 30% kuni 50% pioglitasooni maksimaalsed seerumikontsentratsioonid seerumis ja kontsentratsiooni-aja kõvera alune pindala vahemikus 20–25% (AUC).
Maksimaalne kontsentratsioon seerumis (Cmax), AUC ja minimaalne kontsentratsioon seerumis (Cmin), nii pioglitasooni kui ka kogu pioglitasooni korral suureneb proportsionaalselt annustes 15 mg ja 30 mg päevas. Pioglitasooni ja kogu pioglitasooni suurenemine annuses 60 mg päevas on pisut vähem kui proportsionaalne.
Imendumine: Pärast suukaudset manustamist saab tühja kõhuga pioglitasooni seerumis mõõta kõigepealt 30 minutiga, maksimaalne kontsentratsioon täheldatakse 2 tunni jooksul. Toit lühendab seerumi maksimaalse kontsentratsiooni saavutamise aega pisut 3 kuni 4 tunnini, kuid ei muuda imendumise ulatust.
Jaotumine: pioglitasooni keskmine näiv jaotusruumala (Vd / F) pärast ühekordse annuse manustamist on 0,63 ± 0,41 (keskmine ± SD) L / kg kehakaalu kohta.
Pioglitasoon seondub inimese seerumis ulatuslikult valkudega (> 99%), peamiselt seerumi albumiiniga. Pioglitasoon seondub ka teiste seerumivalkudega, kuid madalama afiinsusega. Metaboliidid M-III ja M-IV on samuti ulatuslikult (> 98%) seotud seerumi albumiiniga.
Metabolism: Pioglitasoon metaboliseerub ulatuslikult hüdroksüülimise ja oksüdeerimise teel; metaboliidid muutuvad osaliselt ka glükuroniidi või sulfaadi konjugaatideks. Metaboliidid M-II ja M-IV (pioglitasooni hüdroksüderivaadid) ja M-III (pioglitasooni ketoderivaadid) on 2. tüüpi diabeedi loommudelites farmakoloogiliselt aktiivsed. Lisaks pioglitasoonile on M-III ja M-IV peamised ravimiga seotud liigid, mida inimese seerumis leidub pärast korduvat manustamist. Püsiseisundis pioglitasoon nii tervetel vabatahtlikel kui ka II tüüpi diabeediga patsientidel sisaldab umbes 30% kuni 50% kogu seerumi maksimaalsest kontsentratsioonist ja 20% kuni 25% plasmakontsentratsioonist kogu AUC.
In vitro andmed näitavad, et pioglitasooni metabolismis osalevad mitmed CYP isovormid. Kaasatud tsütokroom P450 isovormid on CYP2C8 ja vähemal määral CYP3A4, millele lisanduvad mitmesugused muud isovormid, sealhulgas peamiselt ekstrahepaatiline CYP1A1. Pioglitasooni kombinatsioonis P450 inhibiitorite ja substraatidega on läbi viidud in vivo uuringud (vt lõik 4.2) Ravimite koostoimed). Actosiga ravitavatel patsientidel mõõdetud 6 6-hüdroksükortisooli / kortisooli suhe näitas, et pioglitasoon ei ole tugev CYP3A4 ensüümi indutseerija.
Eritumine ja eliminatsioon: Pärast suukaudset manustamist eritub uriiniga umbes 15–30% pioglitasooni annusest. Pioglitasooni eritumine neerude kaudu on ebaoluline ja ravim eritub peamiselt metaboliitide ja nende konjugaatidena. Eeldatakse, et suurem osa suukaudsest annusest eritub muutumatul kujul või metaboliitidena sapiga ja elimineeritakse väljaheitega.
Pioglitasooni ja kogu pioglitasooni keskmine poolväärtusaeg seerumis on vastavalt 3 kuni 7 tundi ja 16 kuni 24 tundi. Pioglitasooni kliirens, CL / F, on 5 kuni 7 l / h.
Eripopulatsioonid
Neerupuudulikkus: keskmise raskusega patsientidel jääb pioglitasooni, M-III ja M-IV eliminatsiooni poolväärtusaeg muutumatuks. (kreatiniini kliirens 30–60 ml / min) kuni raske (kreatiniini kliirens <30 ml / min) neerukahjustus võrreldes normaalsega katsealused. Neerufunktsiooni häiretega patsientidel ei soovitata annust kohandada (vt lõik 4.2) ANNUSTAMINE JA HALDAMINE).
Maksapuudulikkus: võrreldes normaalse kontrolliga on maksafunktsiooni kahjustusega (Child-Pugh aste B / C) patsientidel pioglitasooni ja pioglitasooni üldsisalduse keskmised kontsentratsioonid vähenevad ligikaudu 45%, kuid keskmise AUC muutused puuduvad väärtused.
Actos-ravi ei tohiks alustada, kui patsiendil on aktiivse maksahaiguse kliinilisi tunnuseid või kui seerumi transaminaaside (ALAT) tase ületab normi ülempiiri 2,5 korda (vt ETTEVAATUSABINÕUD, Maksafunktsiooni häired).
Eakad: Tervetel eakatel inimestel ei ole pioglitasooni ja kogu pioglitasooni maksimaalne kontsentratsioon seerumis oluliselt erinevad, kuid AUC väärtused on pisut kõrgemad ja terminaalne poolestusaeg pisut pikem kui nooremad õppeained. Need muutused ei olnud kliiniliselt olulisteks peetava ulatusega.
Pediaatria: Farmakokineetilised andmed lastel puuduvad.
Sugu: Keskmine Cmax ja AUC väärtused tõusid naistel 20% -lt 60% -ni. Monoteraapiana ja koos sulfonüüluurea, metformiini või insuliiniga parandas Actos glükeemilist kontrolli nii meestel kui naistel. Kontrollitud kliinilistes uuringutes hemoglobiin A1c (HbA1c) langus algtasemest oli naistel üldiselt suurem kui meestel (keskmine erinevus HbA-s1c 0.5%). Kuna glükeemilise kontrolli saavutamiseks tuleb ravi iga patsiendi jaoks individualiseerida, ei soovitata annust kohandada ainult soo põhjal.
Rahvus: etniliste rühmade farmakokineetilised andmed pole kättesaadavad.
Ravimite ja ravimite koostoimed
Järgmisi ravimeid uuriti tervetel vabatahtlikel, kellele manustati Actos 45 mg üks kord päevas. Allpool on toodud tulemused:
Suukaudsed kontratseptiivid: Actos'i (45 mg üks kord päevas) ja suukaudsete rasestumisvastaste ravimite (1 mg noretindrooni koos 0,035 mg etinüülöstradiooli üks kord päevas) 21 päeva jooksul, mille tulemuseks oli etinüülöstradiooli AUC vähenemine 11% ja 11-14% (0–24 tundi). ja Cmax vastavalt. Noretisterooni AUC (0–24 h) ja C osas olulisi muutusi ei toimunudmax. Etinüülöstradiooli farmakokineetika suurt varieeruvust silmas pidades ei ole selle leiu kliiniline tähtsus teada.
Feksofenadiinvesinikkloriid: Actos'i 7-päevane koosmanustamine suukaudselt kaks korda päevas manustatava 60 mg feksofenadiiniga ei mõjutanud märkimisväärselt pioglitasooni farmakokineetikat. Actosel ei olnud feksofenadiini farmakokineetikale olulist mõju.
Glipisiid: Actos'i ja 5 mg glipisiidi samaaegne manustamine suu kaudu üks kord päevas 7 päeva jooksul ei muutnud glipisiidi püsikontsentratsiooni faasi farmakokineetikat.
Digoksiin: Actos'i koosmanustamine 0,25 mg digoksiiniga suu kaudu üks kord päevas 7 päeva jooksul ei muutnud digoksiini püsiseisundi farmakokineetikat.
Varfariin: Actos'i 7 päeva jooksul koos varfariiniga manustamine ei muutnud varfariini püsikontsentratsiooni faasi farmakokineetikat. Kroonilise varfariinravi saavatel patsientidel ei oma Actos kliiniliselt olulist mõju protrombiini ajale.
Metformiin: Metformiini ühekordse annuse (1000 mg) ja Actos'i samaaegne manustamine pärast Actos'i 7-päevast manustamist ei muutnud metformiini ühekordse annuse farmakokineetikat.
Midasolaam: Actos'i manustamine 15 päeva jooksul, millele järgnes ühekordne 7,5 mg midasolaami siirupi annus, vähendas midasolaami C sisaldust 26%max ja AUC.
Ranitidiinvesinikkloriid: Actos'i 7-päevane koosmanustamine kaks korda päevas manustatava ranitidiiniga 7 või 7 päeva jooksul ei mõjutanud märkimisväärselt pioglitasooni farmakokineetikat. Actos ei avaldanud ranitidiini farmakokineetikale olulist mõju.
Nifedipiin ER: Actos'e samaaegne manustamine 7 päeva jooksul koos 30 mg nifedipiini ER manustamisega suu kaudu üks kord päevas 4 päeva jooksul mees- ja naissoost vabatahtlike tulemuseks oli muutumatu nifedipiini väikseim ruutkeskmine väärtus (90% CI) 0,83 (0,73–0,95) Cmax ja AUC 0,88 (0,80 - 0,96). Arvestades nifedipiini farmakokineetika suurt varieeruvust, pole selle leiu kliiniline tähtsus teada.
Ketokonasool: Actos'i 7-päevane koosmanustamine kaks korda 200 mg ketokonasooliga päevas andis muutumatu pioglitasooni väikseim ruutkeskmine väärtus (90% CI) 1,14 (1,06 - 1,23) C jaoksmax, AUC 1,34 (1,26 - 1,41) ja C jaoks 1,87 (1,71 - 2,04)min.
Atorvastatiinkaltsium: Actos'i 7-päevane koosmanustamine 80 mg atorvastatiinkaltsiumiga (LIPITOR®) üks kord päevas andis muutumatu pioglitasooni väikseim ruutkeskmine väärtus (90% CI) 0,69 (0,57–0,85) C jaoksmax, AUC jaoks 0,76 (0,65 - 0,88) ja C jaoks 0,96 (0,87 - 1,05)min. Muutmata atorvastatiini korral olid vähima ruutkeskmise väärtused (90% CI) C jaoks 0,77 (0,66–0,90).max, AUC 0,86 (0,78 - 0,94) ja C jaoks 0,92 (0,82 - 1,02)min.
Teofülliin: Actos'i 7-päevane koosmanustamine 400 mg teofülliiniga kaks korda päevas koosmanustamisega ei mõjutanud kummagi ravimi farmakokineetikat.
Tsütokroom P450: vt ETTEVAATUSABINÕUD
Gemfibrosiil: CYP2C8 inhibiitori gemfibrosiili (suukaudselt 600 mg kaks korda päevas) ja pioglitasooni (suukaudselt 30 mg) samaaegne manustamine 10-le eelnevalt ravitud tervele vabatahtlikule 2 päeva enne gemfibrosiili (suukaudne 600 mg kaks korda päevas) kasutamisel oli pioglitasooni ekspositsioon (AUC0-24) gemfibrosiili puudumisel 226% pioglitasooni ekspositsioonist (vt ETTEVAATUSABINÕUD).
Rifampiin: CIF2C8 indutseerija rifampini (suukaudne 600 mg üks kord päevas) ja pioglitasooni (suukaudselt 30 mg) samaaegne manustamine 10-le tervele inimesele. vabatahtlikel, keda oli eelnevalt ravitud 5 päeva enne rifampini (suukaudne 600 mg üks kord päevas) tulemuseks oli pioglitasooni AUC vähenemine 54% (vt. ETTEVAATUSABINÕUD).
Farmakodünaamika ja kliiniline toime
Kliinilised uuringud näitavad, et Actos parandab insuliiniresistentsete patsientide insuliinitundlikkust. Actos suurendab rakkude reageerimist insuliinile, suurendab insuliinist sõltuvat glükoosi eritumist, parandab maksa tundlikkust insuliini suhtes ja parandab funktsionaalset glükoosi homöostaasi. II tüüpi diabeediga patsientidel põhjustab Actos'i vähenenud insuliiniresistentsus madalamat vere glükoosikontsentratsiooni, madalamat plasmainsuliini taset ja madalamat HbA1c väärtused. Avatud laiendusuuringu tulemuste põhjal näib Actose glükoosisisaldust langetav toime püsiv vähemalt üks aasta. Kontrollitud kliinilistes uuringutes oli Actosel kombinatsioonis sulfonüüluurea, metformiini või insuliiniga glükeemilise kontrolli täiendav toime.
Actosiga tehtud kliinilistesse uuringutesse kaasati lipiidide sisalduse häiretega patsiendid. Üldiselt oli Actos'ega ravitavatel patsientidel triglütseriidide keskmine sisaldus vähenenud, HDL-kolesterooli tase tõusis keskmiselt ning LDL-i ja üldkolesterooli sisaldus ei muutunud keskmiselt.
26-nädalases platseebokontrollitud annust muutvas uuringus vähenesid triglütseriidide keskmised tasemed Actos'i annustes 15 mg, 30 mg ja 45 mg võrreldes platseeborühma keskmise suurenemisega. Actos'iga ravitud patsientidel tõusis HDL-i keskmine tase suuremal määral kui platseebot saanud patsientidel. Actos-ravi saavatel patsientidel ei olnud LDL-i ja üldkolesterooli osas püsivaid erinevusi võrreldes platseeboga (tabel 1).
Tabel 1 lipiidid 26-nädalases platseebokontrollitud monoteraapia annusevahemiku uuringus
| Platseebo | Actos 15 mg Üks kord Iga päev |
Actos 30 mg Üks kord Iga päev |
Actos 45 mg Üks kord Iga päev |
|
| Triglütseriidid (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baasjoon (keskmine) | 262.8 | 283.8 | 261.1 | 259.7 |
| Protsentuaalne muutus võrreldes algtasemega (keskmine) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL-kolesterool (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Baasjoon (keskmine) | 41.7 | 40.4 | 40.8 | 40.7 |
| Protsentuaalne muutus võrreldes algtasemega (keskmine) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL-kolesterool (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Baasjoon (keskmine) | 138.8 | 131.9 | 135.6 | 126.8 |
| Protsentuaalne muutus võrreldes algtasemega (keskmine) | 4.8% | 7.2% | 5.2% | 6.0% |
| Üldkolesterool (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baasjoon (keskmine) | 224.6 | 220.0 | 222.7 | 213.7 |
| Protsentuaalne muutus võrreldes algtasemega (keskmine) | 4.4% | 4.6% | 3.3% | 6.4% |
Kahes teises monoteraapia uuringus (24 nädalat ja 16 nädalat) ja kombineeritud ravi uuringutes sulfonüüluureaga (24 nädalat ja 16 nädalat) ja metformiini (24 nädalat ja 16 nädalat), tulemused olid üldiselt andmetega kooskõlas ülalpool. Platseebokontrollitud uuringutes vähenesid Actos'iga ravitud patsientidel platseeboga korrigeeritud keskmised muutused algtasemest 5% kuni 26% triglütseriidide osas ja HDL 6% kuni 13%. Sarnast tulemuste mustrit nähti Actos'i 24-nädalases kombineeritud ravi uuringus sulfonüüluurea või metformiiniga.
Insuliiniga kombineeritud ravi uuringus (16 nädalat) vähenes ka Actosiga ravitud patsientide platseebo korrigeeritud keskmine protsentuaalne muutus triglütseriidide väärtuses võrreldes algtasemega. 15 mg annuserühmas täheldati platseebo korrigeeritud LDL-kolesterooli 7% -list muutust algtasemest. Vaadeldi sarnaseid tulemusi, mida eespool HDL ja üldkolesterooli osas märgiti. Sarnast tulemuste mustrit nähti 24-nädalases kombineeritud ravi uuringus Actos'e ja insuliini vahel.
Kliinilised uuringud
Monoteraapia
USA-s viidi Actos'i kasutamise monoteraapiana II tüüpi diabeediga patsientidel läbi kolm randomiseeritud, topeltpimedat, platseebokontrollitud uuringut kestusega 16 kuni 26 nädalat. Nendes uuringutes vaadeldi 865 patsiendil Actost annustes kuni 45 mg või platseebot üks kord päevas.
26-nädalases annusepõhises uuringus randomiseeriti 408 II tüüpi diabeediga patsienti 7,5 mg, 15 mg, 30 mg või 45 mg Actos'i või platseebot üks kord päevas. Ravi mis tahes eelneva diabeedivastase ravimiga katkestati 8 nädalat enne topeltpimedat perioodi. Ravi Actos'iga 15 mg, 30 mg ja 45 mg põhjustas platseeboga võrreldes statistiliselt olulist paranemist HbA1c ja tühja kõhuga glükoosisisalduse (FPG) osas (joonis 1, tabel 2).
Joonisel 1 on näidatud FPG ja HbA1c muutuste aeg kogu uuringupopulatsioonis selles 26-nädalases uuringus.

Tabelis 2 on toodud HbA1c ja FPG väärtused kogu uuritavas populatsioonis.
Tabel 2 Glükeemilised parameetrid 26-nädalases platseebokontrollitud annusevahemiku uuringus
| Platseebo | Actos 15 mg Üks kord Iga päev |
Actos 30 mg Üks kord Iga päev |
Actos 45 mg Üks kord Iga päev |
|
| RAHVASTIK KOKKU | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Baasjoon (keskmine) | 10.4 | 10.2 | 10.2 | 10.3 |
| Muutus algtasemest (korrigeeritud keskmine+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Erinevus platseebost (korrigeeritud keskmine)+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baasjoon (keskmine) | 268 | 267 | 269 | 276 |
| Muutus algtasemest (korrigeeritud keskmine+) | 9 | -30 | -32 | -56 |
| Erinevus platseebost (korrigeeritud keskmine)+) | -39* | -41* | -65* | |
|
+ Kohandatud vastavalt lähtejoonele, koondatud keskpunktile ja koondatud keskusele ravi interaktsiooni põhjal * p - 0,050 vs. platseebo |
Uuringupopulatsiooni kuulusid patsiendid, keda ei olnud varem ravitud diabeedivastaste ravimitega (ei olnud varem; 31%) ja patsiendid, kes said uuringusse registreerimise ajal diabeedivastaseid ravimeid (varem ravitud; 69%). Juba varem ravimata patsientide alamhulkade andmed on toodud tabelis 3. Kõik patsiendid astusid enne topeltpimedat ravi 8-nädalase puhastus- / sisseastumisperioodi. Seda sisenemisperioodi seostati HbA vähese muutumisega1c ja FPG väärtused sõeluuringust baasväärtuseni varem mitte saanud patsientidel; eelnevalt ravitud rühmas varasematest diabeedivastastest ravimitest loobumine aga halvendas glükeemilist kontrolli ja suurendas HbA1c ja FPG. Ehkki enamikul varem ravitud rühma patsientidel oli HbA langus algtasemest1c ja FPG koos Actos'iga, ei olnud väärtused paljudel juhtudel uuringu lõpuks skriiningutasemele jõudnud. Uuringu ülesehitus ei võimaldanud hinnata patsiente, kes olid vahetult Actoselt üle läinud mõne teise diabeedivastase ravimi kasutamiselt.
Tabel 3 Glükeemilised parameetrid 26-nädalases platseebokontrollitud annusevahemiku uuringus
| Platseebo | Actos 15 mg Üks kord Iga päev |
Actos 30 mg Üks kord Iga päev |
Actos 45 mg Üks kord Iga päev |
|
| Pole teraapias käinud HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Sõelumine (keskmine) | 9.3 | 10.0 | 9.5 | 9.8 |
| Baasjoon (keskmine) | 9.0 | 9.9 | 9.3 | 10.0 |
| Muutus algtasemest (korrigeeritud keskmine *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Erinevus platseebost (korrigeeritud keskmine *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Sõelumine (keskmine) | 223 | 245 | 239 | 239 |
| Baasjoon (keskmine) | 229 | 251 | 225 | 235 |
| Muutus algtasemest (korrigeeritud keskmine *) | 16 | -37 | -41 | -64 |
| Erinevus platseebost (korrigeeritud keskmine *) | -52 | -56 | -80 | |
| Varem ravitud HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Sõelumine (keskmine) | 9.3 | 9.0 | 9.1 | 9.0 |
| Baasjoon (keskmine) | 10.9 | 10.4 | 10.4 | 10.6 |
| Muutus algtasemest (korrigeeritud keskmine *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Erinevus platseebost (korrigeeritud keskmine *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Sõelumine (keskmine) | 222 | 209 | 230 | 215 |
| Baasjoon (keskmine) | 285 | 275 | 286 | 292 |
| Muutus algtasemest (korrigeeritud keskmine *) | 4 | -32 | -27 | -55 |
| Erinevus platseebost (korrigeeritud keskmine *) | -36 | -31 | -59 | |
| * Kohandatud algtaseme ja ühendatud keskpunkti jaoks |
24-nädalases platseebokontrollitud uuringus randomiseeriti 260 II tüüpi diabeediga patsienti ühte kahest sunniviisilise tiitrimise Actos'e ravirühmast või platseebogrupi tiitrimisest. Ravi mis tahes eelneva diabeedivastase ravimiga katkestati 6 nädalat enne topeltpimedat perioodi. Ühes Actos'e ravirühmas said patsiendid algannust 7,5 mg üks kord päevas. Nelja nädala pärast suurendati annust 15 mg-ni üks kord päevas ja veel nelja nädala pärast suurendati annust 30 mg-ni üks kord päevas ülejäänud uuringu vältel (16 nädalat). Teises Actos'e ravirühmas said patsiendid algannuse 15 mg üks kord päevas ja tiitriti samal viisil 30 mg-ni üks kord päevas ja 45 mg-ni üks kord päevas. Kirjeldatud ravi Actos'iga põhjustas HbA statistiliselt olulist paranemist1c ja FPG lõpp-punktis võrreldes platseeboga (tabel 4).
Tabel 4 Glükeemilised parameetrid 24-nädalases platseebokontrollitud sunnitud tiitrimise uuringus
| Platseebo | Actos 30 mg+ Üks kord päevas |
Actos 45 mg+ Üks kord päevas |
|
| Kogurahvastik HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Baasjoon (keskmine) | 10.8 | 10.3 | 10.8 |
| Muutus algtasemest (korrigeeritud keskmine++) | 0.9 | -0.6 | -0.6 |
| Erinevus platseebost (korrigeeritud keskmine)++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Baasjoon (keskmine) | 279 | 268 | 281 |
| Muutus algtasemest (korrigeeritud keskmine++) | 18 | -44 | -50 |
| Erinevus platseebost (korrigeeritud keskmine)++) | -62* | -68* | |
|
+ Viimane annus sunnitud tiitrimisel ++ Kohandatud vastavalt lähtejoonele, koondatud keskpunktile ja koondatud keskusele ravi interaktsiooni põhjal * p - 0,050 vs. platseebo |
Patsientide puhul, keda ei olnud varem ravitud diabeedivastaste ravimitega (24%), olid skriiningu keskmised väärtused HbA-d 10,1%1c ja 238 mg / dl FPG jaoks. Algjoonel tähendab keskmine HbA1c oli 10,2% ja keskmine FPG oli 243 mg / dl. Võrreldes platseeboga põhjustas ravi Actos'iga, mille tiitrimine lõppannuseks oli 30 mg ja 45 mg, keskmise HbA langust algväärtusest1c 2,3% ja 2,6% ning keskmine FPG vastavalt 63 mg / dL ja 95 mg / dL. Patsientide puhul, keda oli varem ravitud diabeedivastaste ravimitega (76%), katkestati see ravi läbivaatusel. Skriiningu keskmised väärtused olid HbA suhtes 9,4%1c ja 216 mg / dl FPG jaoks. Algjoonel tähendab keskmine HbA1c oli 10,7% ja keskmine FPG oli 290 mg / dl. Võrreldes platseeboga põhjustas ravi Actos'iga, mille tiitrimine lõppannuseks oli 30 mg ja 45 mg, keskmise HbA langust algväärtusest1c 1,3% ja 1,4% ning keskmine FPG vastavalt 55 mg / dL ja 60 mg / dL. Paljude varem ravitud patsientide puhul on HbA1c ja FPG ei olnud uuringu lõpuks nakatumistasemele naasnud.
16-nädalases uuringus randomiseeriti 197 2. tüüpi diabeediga patsienti raviks 30 mg Actosiga või platseeboga üks kord päevas. Ravi mis tahes eelneva diabeedivastase ravimiga katkestati 6 nädalat enne topeltpimedat perioodi. Ravi 30 mg Actos'iga parandas HbA statistiliselt olulist taset1c ja FPG lõpp-punktis võrreldes platseeboga (tabel 5).
Tabel 5 Glükeemilised parameetrid 16-nädalases platseebokontrollitud uuringus
| Platseebo | Actos 30 mg Üks kord päevas |
|
| Kogurahvastik HbA1c (%) |
N = 93 | N = 100 |
| Baasjoon (keskmine) | 10.3 | 10.5 |
| Muutus algtasemest (korrigeeritud keskmine+) | 0.8 | -0.6 |
| Erinevus platseebost (korrigeeritud keskmine)+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Baasjoon (keskmine) | 270 | 273 |
| Muutus algtasemest (korrigeeritud keskmine+) | 8 | -50 |
| Erinevus platseebost (korrigeeritud keskmine)+) | -58* | |
|
+ Kohandatud vastavalt lähtejoonele, koondatud keskpunktile ja koondatud keskusele ravi interaktsiooni põhjal * p - 0,050 vs. platseebo |
Patsientide puhul, keda ei olnud varem ravitud diabeedivastaste ravimitega (40%), olid skriiningu keskmised väärtused HbA1c korral 10,3% ja FPG korral 240 mg / dL. Algjoonel tähendab keskmine HbA1c oli 10,4% ja keskmine FPG oli 254 mg / dl. Võrreldes platseeboga vähendas Actos 30 mg ravi keskmise HbA langust algtasemest1c 1,0% ja keskmine FPG 62 mg / dl. Patsientide puhul, keda oli varem ravitud diabeedivastaste ravimitega (60%), katkestati see ravi läbivaatusel. Skriiningu keskmised väärtused olid HbA suhtes 9,4%1c ja 216 mg / dl FPG jaoks. Algjoonel tähendab keskmine HbA1c oli 10,6% ja keskmine FPG oli 287 mg / dl. Võrreldes platseeboga vähendas Actos 30 mg ravi keskmise HbA langust algtasemest1c 1,3% ja keskmine FPG 46 mg / dl. Paljude varem ravitud patsientide puhul on HbA1c ja FPG ei olnud uuringu lõpuks nakatumistasemele naasnud.
Kombineeritud ravi
Kolm 16-nädalast randomiseeritud, topeltpimedat, platseebokontrolliga kliinilist uuringut ja kolm 24-nädalast randomiseeritud, topeltpimedat, annusega kontrollitud kliinilist uuringut viidi läbi kliinilised uuringud, et hinnata Actos'i mõju glükeemilisele kontrollile II tüüpi diabeediga patsientidel, kes olid ebapiisavad kontrollitud (HbA1c - 8%) vaatamata praegusele ravile sulfonüüluurea, metformiini või insuliiniga. Varasem diabeediravi võis olla monoteraapia või kombineeritud ravi.
Actos Plus sulfonüüluurea uuringud
Actos-iga ja sulfonüüluureaga viidi läbi kaks kliinilist uuringut. Mõlemad uuringud hõlmasid II tüüpi diabeediga patsiente sulfonüüluurea abil, kas üksi või kombinatsioonis mõne teise diabeediravimiga. Kõik muud diabeediravimid katkestati enne uuringuravi alustamist. Esimeses uuringus randomiseeriti 560 patsienti, kellele manustati lisaks praegusele sulfonüüluurea režiimile 16 nädala jooksul 15 mg või 30 mg Actost või platseebot üks kord päevas. Võrreldes platseeboga 16. nädalal, vähendas Actos lisamine sulfonüüluureale märkimisväärselt keskmist HbA1c 0,9% ja 1,3% ning keskmine FPG vastavalt 39 mg / dL ja 58 mg / dL vastavalt 15 mg ja 30 mg annuste korral.
Teises uuringus randomiseeriti 702 patsienti saama 30 mg või 45 mg Actosit üks kord päevas 24 nädala jooksul lisaks praegusele sulfonüüluurea režiimile. HbA keskmised langused algtasemest 24. nädalal1c olid 30,5 ja 45 mg annuste korral vastavalt 1,55% ja 1,67%. FPG langus keskmiselt võrreldes algtasemega oli 51,5 mg / dL ja 56,1 mg / dL.
Actos'e ja sulfonüüluurea kombinatsiooni terapeutilist toimet täheldati patsientidel sõltumata sellest, kas patsiendid said madalat, keskmist või suurtes annustes sulfonüüluurea.
Actos Plus metformiini uuringud
Actos'iga ja metformiiniga tehti kaks kliinilist uuringut. Mõlemad uuringud hõlmasid II tüüpi diabeediga patsiente metformiiniga, kas üksi või kombinatsioonis mõne muu diabeediravimiga. Kõik muud diabeediravimid katkestati enne uuringuravi alustamist. Esimeses uuringus randomiseeriti 328 patsienti lisaks praegusele metformiini režiimile 16 nädala jooksul kas 30 mg Actost või platseebot üks kord päevas. Võrreldes platseeboga 16. nädalal, vähendas Actos'i lisamine metformiinile märkimisväärselt keskmist HbA-d1c 0,8% ja vähendas keskmist FPG-d 38 mg / dL.
Teises uuringus randomiseeriti 827 patsienti lisaks praegusele metformiini režiimile 24 nädala jooksul kas 30 mg või 45 mg Actosit üks kord päevas. HbA keskmised langused algtasemest 24. nädalal1c olid 30 mg ja 45 mg annuste korral vastavalt 0,80% ja 1,01%. FPG keskmine langus algtasemest oli 38,2 mg / dL ja 50,7 mg / dL.
Actos'i ja metformiini kombinatsiooni terapeutilist toimet täheldati patsientidel sõltumata sellest, kas patsiendid said metformiini väiksemaid või suuremaid annuseid.
Actos Plus insuliini uuringud
Actos'e ja insuliini kombinatsioonis viidi läbi kaks kliinilist uuringut. Mõlemas uuringus osales II tüüpi diabeediga patsiente insuliini kasutamisel kas üksi või kombinatsioonis mõne muu diabeedivastase ravimiga. Kõik muud diabeediravimid katkestati enne uuringuravi alustamist. Esimeses uuringus randomiseeriti 566 patsienti, kes said keskmiselt 60,5 ühikut ööpäevas insuliini saavad lisaks insuliinile kas 15 mg või 30 mg Actost või platseebot üks kord päevas 16 nädala jooksul raviskeem. Võrreldes platseeboga 16. nädalal, vähendas Actos'i lisamine insuliinile märkimisväärselt nii HbA-d1c vastavalt 0,7% ja 1,0% ning FPG vastavalt 35 mg / dL ja 49 mg / dL vastavalt 15 mg ja 30 mg annuste korral.
Teises uuringus said 690 patsienti, kes said keskmiselt 60,0 ühikut ööpäevas insuliini, lisaks praegusele insuliinirežiimile kas 30 mg või 45 mg Actost üks kord päevas 24 nädala jooksul. HbA keskmised langused algtasemest 24. nädalal1c olid 30 mg ja 45 mg annuste korral vastavalt 1,17% ja 1,46%. FPG langus keskmiselt algtasemest oli 31,9 mg / dl ja 45,8 mg / dL. Paranenud glükeemilise kontrolliga kaasnes insuliini annuste vajaduse langus keskmiselt 6,0% ja 9,4% päevas võrreldes algtasemega vastavalt 30 mg ja 45 mg annuste puhul.
Actos'i ja insuliini kombinatsiooni terapeutilist toimet täheldati patsientidel sõltumata sellest, kas patsiendid said väiksemaid või suuremaid insuliiniannuseid.
ülaosa
Näidustused ja kasutamine
Actos on näidustatud dieedi ja füüsilise koormuse lisandina glükeemilise kontrolli parandamiseks II tüüpi suhkurtõvega täiskasvanutel.
ülaosa
Vastunäidustused
Actos-ravi alustamine patsientidel, kellel on väljakujunenud New York Heart Association (NYHA) III või IV klassi südamepuudulikkus, on vastunäidustatud (vt BOXED HOIATUS).
Actos on vastunäidustatud patsientidele, kellel on teadaolev ülitundlikkus selle toote või selle mõne koostisosa suhtes.
ülaosa
Hoiatused
Südamepuudulikkus ja muud südamekahjustused
Actos, nagu ka teised tiasolidiindioonid, võib üksi või koos teiste diabeedivastaste ainetega, sealhulgas insuliiniga, põhjustada vedelikupeetust. Vedelikupeetus võib põhjustada või süvendada südamepuudulikkust. Patsiente tuleb jälgida südamepuudulikkuse nähtude ja sümptomite osas. Nende sümptomite ilmnemisel tuleb südamepuudulikkust ravida vastavalt kehtivatele hooldusstandarditele. Lisaks sellele tuleb kaaluda Actos'i kasutamise lõpetamist või annuse vähendamist (vt lõik 4.2) BOXED HOIATUS). NYHA III ja IV klassi südameseisundiga patsiente müügiloa saamiseelses kliinilises uuringus ei uuritud ning Actos'i ei soovitata neil kasutada (vt BOXED HOIATUS ja VASTUNÄIDUSTUSED).
Ühes 16-nädalases USA topeltpimedas platseebokontrolliga kliinilises uuringus osales 566 II tüüpi patsienti diabeedi korral võrreldi Actos'i annustega 15 mg ja 30 mg kombinatsioonis insuliiniga insuliinraviga üksi. See uuring hõlmas pikaajalise diabeediga patsiente ja olemasolevate haigusseisundite suurt levikut järgmiselt: arteriaalne hüpertensioon (57,2%), perifeerne neuropaatia (22,6%), südame isheemiatõbi (19,6%), retinopaatia (13,1%), müokardiaalne infarkt (8,8%), veresoonkonna haigused (6,4%), stenokardia (4,4%), insult ja / või mööduv isheemiline atakk (4,1%) ja kongestiivne südamepuudulikkus (2,3%).
Selles uuringus osales 191 patsiendist kaks, kes said 15 mg Actos'i ja insuliini (1,1%), ja kaks 188 patsiendist, kes said 30 mg Actosel ja insuliinil (1,1%) tekkis südame paispuudulikkus, mitte ühegi 187 patsiendist, kes said ainult insuliinravi. Kõigil neil neljal patsiendil oli varasem kardiovaskulaarsete seisundite ajalugu, sealhulgas pärgarteritõbi, eelnevad CABG protseduurid ja müokardiinfarkt. 24-nädalases, annusega kontrollitud uuringus, kus Actost manustati koos insuliiniga, teatasid 0,3% patsientidest (1/345) 30 mg ja 0,9% (3/345) 45 mg patsientidest CHF-i kui tõsist kõrvaltoimet. .
Nende uuringute andmete analüüs ei tuvastanud spetsiifilisi tegureid, mis ennustavad südame paispuudulikkuse riski suurenemist kombineeritud ravi korral insuliiniga.
II tüüpi diabeedi ja kongestiivse südamepuudulikkuse korral (süstoolne düsfunktsioon)
Viidi läbi 24-nädalane turustamisjärgne ohutusuuring, et võrrelda Actost (n = 262) glüburiidiga (n = 256) kontrollimata diabeediga patsientidel (keskmine HbA1c 8,8% algväärtusest) NYHA II ja III klassi südamepuudulikkuse ja väljutusfraktsiooniga vähem kui 40% (keskmine EF 30% algväärtusest). Uuringu jooksul teatati 9,9% -l patsientidest ööpäevase hospitaliseerimise tõttu südame paispuudulikkuse tõttu Actos-ravi saavatel patsientidel, võrreldes 4,7% -l glüburiidi saanud patsientidest, ravi erinevus täheldati 6-st nädalat. See Actosiga seotud kõrvalnäht oli enam täheldatud patsientidel, kes kasutasid insuliini algul ja üle 64-aastastel patsientidel. Ravigruppide vahel kardiovaskulaarses suremuses erinevusi ei täheldatud.
Actos'i tuleb alustada väikseima lubatud annusega, kui see on ette nähtud II tüüpi diabeedi ja süstoolse südamepuudulikkusega patsientidele (NYHA II klass). Kui järgnevat annuse suurendamist on vaja, tuleb annust järk-järgult suurendada alles pärast mitmekordset manustamist kuud kestnud ravi, jälgides hoolikalt kehakaalu tõusu, turset või CHF-i märke ja sümptomeid ägenemine.
Pioglitasooni perspektiivne kliiniline uuring makrovaskulaarsete sündmuste korral (PROaktiivne)
PROaktiivse ravi korral raviti 5238 II tüüpi diabeediga patsienti, kellel oli varasem makrovaskulaarne haigus, Actos'ega (n = 2605), tiitrides jõutõstmist kuni 45 mg üks kord päevas või platseeboga (n = 2633) (vt. KÕRVALTOIMED). Raske südamepuudulikkusega patsientide protsent oli Actos'ega ravitud patsientide hulgas suurem (5,7%, n = 149) kui platseeboga ravitud patsientide hulgas (4,1%, n = 108). Surmajuhtumite arv pärast tõsist südamepuudulikkust oli 1,5% (n = 40) Actosiga ravitud patsientidel ja 1,4% (n = 37) platseebot saanud patsientidel. Patsientidel, keda raviti algul insuliini sisaldava raviskeemiga, oli tõsise südamepuudulikkuse esinemissagedus 6,3% (n = 54/864) Actosiga ja 5,2% (n = 47/896) platseeboga. Nendel patsientidel, keda raviti ravi alguses raviga sulfonüüluureat sisaldava raviskeemiga, oli tõsise südamepuudulikkuse esinemissagedus 5,8% (n = 94/1624) Actos'iga ja 4,4% (n = 71/1626) platseeboga.
ülaosa
Ettevaatusabinõud
Üldine
Actos avaldab hüperglükeemilist toimet ainult insuliini juuresolekul. Seetõttu ei tohiks Actost kasutada 1. tüüpi diabeediga patsientidel ega diabeetilise ketoatsidoosi raviks.
Hüpoglükeemia: Actosit kombinatsioonis insuliini või suukaudsete hüpoglükeemiliste ravimitega saavatel patsientidel võib olla oht hüpoglükeemia tekkeks ja võib osutuda vajalikuks kaasuva aine annuse vähendamine.
Kardiovaskulaarne: USA platseebokontrollitud kliinilistes uuringutes, mis välistasid New York Heart Associationi (NYHA) III ja IV klassi südameseisundiga patsientidest, patsientide puhul, keda raviti Actos monoteraapiana või kombinatsioonis sulfonüüluurea või metformiiniga, ei suurenenud mahu suurenemisega seotud tõsised südamega seotud kõrvaltoimed vs. platseebot saanud patsiendid. Insuliinikombinatsiooni uuringutes osales väike arv patsiente, kellel on varem olnud anamneesis südamehaiguse korral tekkis kongestiivne südamepuudulikkus, kui seda raviti Actos'ega koos insuliiniga (vt HOIATUSED). Nendes Actos'i kliinilistes uuringutes ei uuritud III ja IV klassi NYHA südameseisundiga patsiente. Actos ei ole näidustatud III või IV klassi NYHA südameseisundiga patsientidele.
Actos'i turustamisjärgse kogemuse põhjal on teatatud kongestiivse südamepuudulikkuse juhtudest nii varem teadaolevate südamehaigustega kui ka ilma nendeta patsientidel.
Turse: Actos't tuleb ödeemiga patsientidel kasutada ettevaatusega. Kõigis USA kliinilistes uuringutes täheldati Actosiga ravitud patsientidel turset sagedamini kui platseeboga ravitud patsientidel ja see näib olevat annusest sõltuv (vt KÕRVALTOIMED). Turustamisjärgselt on saadud teateid ödeemi tekkimise või süvenemise kohta. Kuna tiasolidiindioonid, sealhulgas Actos, võivad põhjustada vedelikupeetust, mis võib süvendada või põhjustada südame paispuudulikkust, tuleb Actot kasutada südamepuudulikkuse riskiga patsientidel ettevaatusega. Patsiente tuleb jälgida südamepuudulikkuse nähtude ja sümptomite suhtes (vt lõik 4.2) BOXED HOIATUS, HOIATUSEDja ETTEVAATUSABINÕUD).
Kaalutõus: Annusega seotud kaalutõusu täheldati ainult Actos'e kasutamisel koos teiste hüpoglükeemiliste ainetega (tabel 6). Kaalutõusu mehhanism on ebaselge, kuid tõenäoliselt hõlmab see vedelikupeetuse ja rasva kogunemise kombinatsiooni.
Tabel 6 Kaalumuutused (kg) Actos'iga topeltpimedates kliinilistes uuringutes algtasemest
| Kontrollrühm (Platseebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| Mediaan (25th/75th protsentiil) |
Mediaan (25th/75th protsentiil) |
Mediaan (25th/75th protsentiil) |
Mediaan (25th/75th protsentiil) |
||
| Monoteraapia | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Kombineeritud ravi | Sulfonüüluurea | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| Metformiin | -1.4 (-3.2/0.3) n = 160 |
Ei kohaldata | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Insuliin | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Märkus: katse kestus 16 kuni 26 nädalat |
Ovulatsioon: Actos-ravi, nagu ka teiste tiasolidiindioonide ravi, võib mõnedel menopausieelses eas anovulatoorsetel naistel põhjustada ovulatsiooni. Selle tagajärjel võib nendel patsientidel Actos'i võtmise ajal olla suurem rasedusrisk. Seetõttu tuleks menopausieelses eas naistel soovitada piisavat rasestumisvastast vahendit. Seda võimalikku mõju ei ole kliinilistes uuringutes uuritud, seega ei ole selle esinemise sagedus teada.
Hematoloogiline: Actos võib põhjustada hemoglobiini ja hematokriti langust. Kõigis kliinilistes uuringutes langesid Actos'iga ravitud patsientide keskmised hemoglobiinisisaldused 2–4%. Need muutused toimusid peamiselt esimese 4–12 ravinädala jooksul ja püsisid pärast seda suhteliselt muutumatuna. Need muutused võivad olla seotud suurenenud plasmamahuga ja neid on harva seostatud märkimisväärsete hematoloogiliste kliiniliste mõjudega (vt KÕRVALTOIMED, Laboratoorsed kõrvalekalded).
Mõjud maksale: Heakskiimiseelsetes kliinilistes uuringutes ravitakse Actos'iga üle 4500 katsealuse. USA kliinilistes uuringutes said Actosit üle 4700 II tüüpi diabeediga patsiendi. Kliinilistes uuringutes ei olnud tõendeid ravimite indutseeritud hepatotoksilisuse ega ALAT taseme tõusu kohta.
USA-s läbi viidud platseebokontrollitud kliiniliste uuringute käigus oli kokku 4 patsienti 1526-st (0,26%) Actos-ravi saanud patsientidest ja 2-l 793-st (0,25%) platseeboga ravitud patsiendist oli ALAT väärtus 3 korda suurem kui normaalne. Actos'iga ravitud patsientide ALAT tõus oli pöörduv ega olnud selgelt seotud Actos-raviga.
Turustamise järgselt Actos'iga saadud kogemuste põhjal on saadud teateid hepatiidi ja maksaensüümide aktiivsuse taseme tõusu kohta normi ülemisest piirist 3 või enama korrani. Väga harva on nendes teadetes esinenud maksapuudulikkust surmaga lõppenud tulemustega või ilma, kuigi põhjuslikku seost ei ole kindlaks tehtud.
Kuni täiendavate suurte, pikaajaliste kontrollitud kliiniliste uuringute ja täiendavate kliiniliste uuringute tulemuste kättesaadavuseni Turustamisjärgsete ohutusandmete põhjal on soovitatav Actos'ega ravitavatel patsientidel perioodiliselt kontrollida maksa taset ensüümid.
Seerumi ALAT (alaniinaminotransferaasi) taset tuleks hinnata enne ravi alustamist Actos kõigil patsientidel ja perioodiliselt pärast seda vastavalt tervishoiu kliinilisele hinnangule professionaalne. Maksafunktsiooni testid tuleks võtta ka patsientidelt, kellel esinevad maksafunktsiooni häirele viitavad sümptomid, nt iiveldus, oksendamine, kõhuvalu, väsimus, isutus või tume uriin. Patsiendi Actos-ravi jätkamise üle otsustamiseks tuleb laborianalüüside tegemiseni lähtuda kliinilisest hinnangust. Kui ilmneb kollatõbi, tuleb ravimiravi katkestada.
Actos-ravi ei tohiks alustada, kui patsiendil on aktiivse maksahaiguse kliinilisi tunnuseid või kui ALAT tase ületab normi ülempiiri 2,5-kordselt. Patsiendid, kellel on kergelt kõrgenenud maksaensüümid (ALAT tase 1–2,5 korda üle normi ülemise piiri) at Maksaensüümi põhjuse väljaselgitamiseks tuleb hinnata Actos-ravi algust või mis tahes aega kõrgendus. Actos-ravi alustamine või jätkamine kergelt kõrgenenud maksaensüümidega patsientidel tuleb jätkata ettevaatusega ja hõlmama asjakohast kliinilist järelkontrolli, mis võib hõlmata sagedamini esinevaid maksaensüüme jälgimine. Kui seerumi transaminaaside sisaldus suureneb (ALAT> 2,5 korda üle normi ülemise piiri), maksa talitlusteste tuleks hinnata sagedamini, kuni tasemed normaliseeruvad või toimub eeltöötlus väärtused. Kui ALAT tase ületab normi ülemise piiri 3 korda, tuleb testi korrata nii kiiresti kui võimalik. Kui ALAT tase püsib> 3 korda üle normi ülemise piiri või kui patsiendil on kollatõbi, tuleb Actos-ravi katkestada.
Makulaarne turse: Turustamisjärgselt on makulaarset turset täheldatud diabeediga patsientidel, kes võtsid pioglitasooni või mõnda muud tiasolidiindiooni. Mõnedel patsientidel on nägemine hägustunud või nägemisteravus vähenenud, kuid mõnedel patsientidel on diagnoositud rutiinne oftalmoloogiline uuring. Mõnedel patsientidel oli maakula turse diagnoosimise ajal perifeerne turse. Mõnel patsiendil paranes maakula turse pärast tiasolidiindiooni kasutamise katkestamist. Pole teada, kas pioglitasooni ja kollatähni vahel on põhjuslik seos. Diabeedihaigetel peaks olema regulaarselt silmaarst silmaarsti poolt vastavalt Ameerika Diabeedi Assotsiatsiooni hooldusstandarditele. Lisaks tuleks diabeetik, kes teatab igasugusest visuaalsest sümptomist, viivitamatult silmaarsti vastuvõtule, sõltumata patsiendi kaasnevatest ravimitest või muudest füüsilistest avastustest (vt KÕRVALTOIMED).
Luumurrud: Randomiseeritud uuringus (PROaktiivne) II tüüpi diabeediga patsientidel (keskmine kestus 5%) diabeet 9,5 aastat), täheldati luumurdude sagedasemat esinemist naispatsientidel pioglitasoon. Keskmine jälgimisperiood (34,5 kuud) oli naistel luumurdude esinemissagedus 5,1% (44/870) pioglitasooni ja 2,5% (23/905) platseebo puhul. See erinevus ilmnes pärast esimest raviaastat ja püsis kogu uuringu vältel. Enamik naispatsientidest täheldatud luumurdudest olid mittevertebraalsed luumurrud, sealhulgas alajäseme ja distaalse ülajäseme murrud. Pioglitasooniga ravitud meestel, 1,7% (30/1735), võrreldes platseeboga 2,1% (37/1728), luumurdude suurenemist ei täheldatud. Ravi saavate patsientide, eriti naispatsientide hooldamisel tuleb arvestada luumurdude riskiga pioglitasooni ja tähelepanu tuleks pöörata luude tervise hindamisele ja säilitamisele vastavalt kehtivatele standarditele hooldusest.
Makrovaskulaarsed tulemused: Actos'i või mõne muu diabeedivastase ravimiga ei ole kliinilisi uuringuid, mis kinnitaksid veenvaid tõendeid makrovaskulaarse riski vähenemise kohta.
Laborikatsed
FPG ja HbA1c glükeemilise kontrolli ja Actos'e ravivastuse jälgimiseks tuleks perioodiliselt läbi viia mõõtmised.
Enne Actos-ravi alustamist on soovitatav kõigil patsientidel jälgida maksaensüüme ja seejärel perioodiliselt pärast tervishoiutöötaja kliinilist hinnangut (vt ETTEVAATUSABINÕUD, Üldine, maksafunktsiooniline toime ja KÕRVALTOIMED, Seerumi transaminaasitasemed).
Teave patsientidele
Oluline on juhendada patsiente toitumisjuhistest kinni pidama ning regulaarselt kontrollima veresuhkru ja glükosüülitud hemoglobiini taset. Stressiperioodidel, nagu palavik, trauma, infektsioon või kirurgia, võivad ravivajadused muutuda ja patsientidele tuleb meelde tuletada, et nad pöörduksid viivitamatult arsti poole.
Patsiendid, kellel on ebaharilikult kiire kehakaalu või turse suurenemine või kellel on õhupuudus või muud südamepuudulikkuse sümptomid, kui Actos-ravi ajal tuleb neist sümptomitest viivitamatult teada anda arst.
Patsientidele tuleb öelda, et enne ravi algust ja seejärel perioodiliselt tehakse maksafunktsiooni vereanalüüs tervishoiutöötaja kliiniliste hinnangute kohaselt. Patsientidele tuleb öelda, et nad pöörduksid viivitamatult arsti poole seletamatu iivelduse, oksendamise, kõhuvalu, väsimuse, anoreksia või tumeda uriiniga.
Patsientidele tuleb öelda Actos'i võtmine üks kord päevas. Actos'i võib võtta koos toiduga või ilma. Kui ühel päeval jääb annus vahele, ei tohiks seda järgmisel päeval kahekordistada.
Kombineeritud ravi korral insuliini või suukaudsete hüpoglükeemiliste ainetega hüpoglükeemia riskid, selle sümptomid ja ravi ja tingimusi, mis soodustavad selle arengut, tuleks patsientidele ja nende perekonnale selgitada liikmed.
Nagu ka teiste tiasolidiindioonide ravi Actosiga, võib mõnel premenopausaalsel anovulatoorsel naisel põhjustada ovulatsiooni. Selle tagajärjel võib nendel patsientidel Actos'i võtmise ajal olla suurem rasedusrisk. Seetõttu tuleks menopausieelses eas naistel soovitada piisavat rasestumisvastast vahendit. Seda võimalikku mõju ei ole kliinilistes uuringutes uuritud, seega ei ole selle esinemise sagedus teada.
Ravimite koostoimed
In vivo ravimite koostoimeuuringud on näidanud, et pioglitasoon võib olla CYP 450 isovormi 3A4 substraadi nõrk indutseerija (vt KLIINILINE FARMAKOLOOGIA, Ainevahetus ja Ravimite ja ravimite koostoimed).
CYP2C8 ensüümi inhibiitor (näiteks gemfibrosiil) võib märkimisväärselt suurendada AUC väärtust pioglitasoon ja CYP2C8 ensüümide indutseerija (näiteks rifampiin) võivad oluliselt vähendada pioglitasoon. Seetõttu, kui pioglitasoonravi ajal alustatakse või lõpetatakse CYP2C8 inhibiitor või indutseerija, võib kliinilise ravivastuse põhjal olla vajalik suhkurtõve ravi muutmine (vt KLIINILINE FARMAKOLOOGIA, Ravimite ja ravimite koostoimed).
Kantserogenees, mutagenees, viljakuse langus
Kaheaastane kartsinogeensuse uuring viidi läbi isastel ja emastel rottidel suukaudsete annustena kuni 63 mg / kg (umbes 14-kordne maksimaalne soovitatav inimese suukaudne annus 45 mg, aluseks võttes mg / m2). Ravimitest põhjustatud kasvajaid ei täheldatud üheski elundis, välja arvatud kusepõis. Isastel rottidel täheldati healoomulisi ja / või pahaloomulisi siirderakkude kasvajaid annuses 4 mg / kg päevas ja rohkem (ligikaudu võrdne maksimaalse soovitatava inimesele manustatava suukaudse annusega, mis põhineb mg / m2). Kaheaastane kartsinogeensuse uuring viidi läbi isastel ja emastel hiirtel suukaudsetes annustes kuni 100 mg / kg päevas (umbes 11-kordne maksimaalne soovitatav inimese suukaudne annus, mis põhineb mg / m2). Üheski elundis ei täheldatud ravimitest põhjustatud kasvajaid.
Uriini tsütoloogia eeldatava hindamise käigus, mis hõlmas enam kui 1800 patsienti, kes said Actost kliiniliste uuringute käigus kuni ühe aasta jooksul, ei tuvastatud uusi põiekasvajate juhtumeid. Kahes 3-aastases uuringus, milles pioglitasooni võrreldi platseebo või glüburiidiga, oli 16/3656 (0,44%) teateid põievähi kohta pioglitasooni kasutavatel patsientidel, võrreldes 5/3679 (0,14%) patsientidega, kes ei võtnud pioglitasoon. Pärast patsientide väljajätmist, kellel uuringuravimiga kokkupuude oli põievähi diagnoosimise ajal vähem kui aasta, esines pioglitasooni korral kuus (0,16%) ja platseebot kaks (0,05%).
Pioglitasoonvesinikkloriid ei olnud geneetiliste toksikoloogiliste uuringute, sealhulgas imetajate raku edasikanduva geeni Amesi bakterianalüüsi käigus mutageenne mutatsioonianalüüs (CHO / HPRT ja AS52 / XPRT), in vitro tsütogeneetika test, kasutades CHL rakke, planeerimata DNA sünteesi test ja in vivo mikrotuuma test.
Suukaudse annuse kuni 40 mg / kg pioglitasoon-HCl päevas manustamisel isastel ja emastel rottidel ei täheldatud kahjulikku toimet fertiilsusele enne paaritumist ja tiinust ning selle ajal (umbes 9-kordne maksimaalne soovitatav inimese suukaudne annus, mis põhineb mg / m2).
Loomade toksikoloogia
Suukaudselt manustatud hiirtel (100 mg / kg), rottidel (4 mg / kg ja rohkem) ja koertel (3 mg / kg) on täheldatud südame laienemist. pioglitasoonvesinikkloriid (vastavalt hiirtele, rottidele ja koertele vastavalt umbes 11, 1 ja 2-kordne maksimaalne soovitatav suukaudne annus), põhineb mg / m2). Üheaastastes rottide uuringutes esines ravimiga seotud varajane surm ilmse südamefunktsiooni häire tõttu suukaudne annus 160 mg / kg päevas (umbes 35 korda suurem inimesele soovitatavast maksimaalsest suukaudsest annusest, mis põhineb 100 mg / kg) mg / m2). Südame laienemist täheldati 13-nädalases uuringus ahvidega suukaudsete annuste 8,9 mg / kg ja üle selle kasutamisel (umbes 4-kordne maksimaalne soovitatav suukaudne annus inimesel, mis põhineb mg / m2), kuid mitte 52-nädalases uuringus kuni 32 mg / kg suukaudsete annuste kasutamisel (umbes 13-kordne maksimaalne soovitatav inimese suukaudne annus, mis põhineb mg / m2).
Rasedus
C-kategooria rasedus Pioglitasoon ei olnud teratogeenne rottidel suukaudsete annuste (kuni 80 mg / kg) ja küülikute, kellele manustati kuni 160 mg / kg organogeneesi ajal (ligikaudu 17 ja 40-kordne maksimaalne soovitatav suukaudne annus inimesele) mg / m2vastavalt). Hiline sünnitus ja embrüotoksilisus (mida tõendavad suurenenud implantatsioonijärgsed kaotused, edasilükatud areng ja loote vähenenud kaal) rottidel täheldati suu kaudu manustatavaid annuseid 40 mg / kg päevas ja rohkem (umbes 10-kordne maksimaalne soovitatav inimese suukaudne annus, mis põhineb 100 mg / kg) mg / m2). Rottide järglastel ei täheldatud funktsionaalset ega käitumuslikku toksilisust. Küülikutel täheldati embrüotoksilisust suukaudse annuse 160 mg / kg korral (umbes 40-kordne maksimaalne soovitatav suukaudne annus inimesele, mis põhineb mg / m2). Rottide järglastel täheldati sünnitusjärgset hilinenud arengut, mis oli tingitud vähenenud kehakaalust, suukaudsete annuste 10 mg / kg kasutamisel ja üle selle hilise tiinuse ja laktatsiooni perioodidel (umbes 2 korda suurem inimesele soovitatavast suukaudsest maksimaalsest annusest, mis põhineb 100%) mg / m2).
Rasedatel ei ole piisavalt ja hästi kontrollitud uuringuid. Actos't tohib raseduse ajal kasutada ainult juhul, kui potentsiaalne kasu õigustab potentsiaalset ohtu lootele.
Kuna praegune teave viitab kindlalt sellele, et raseduse ajal on ebanormaalne veresuhkru tase seotud ka kaasasündinud anomaaliate suurema esinemissagedusega, vastsündinute suurenenud haigestumuse ja suremuse tõttu soovitab enamik eksperte raseduse ajal kasutada insuliini, et säilitada vere glükoositase normaalsel tasemel võimalik.
Imetavad emad
Pioglitasoon eritub imetavate rottide piima. Ei ole teada, kas Actos eritub inimese rinnapiima. Kuna paljud ravimid erituvad inimese rinnapiima, ei tohiks Actos'i imetavale naisele manustada.
Kasutamine lastel
Actos'i ohutus ja efektiivsus lastel ei ole tõestatud.
Eakad inimesed
Ligikaudu 500 patsienti, kes osalesid Actos'i platseebokontrollitud kliinilistes uuringutes, olid 65-aastased ja vanemad. Nende patsientide ja nooremate patsientide vahel ei täheldatud olulisi erinevusi efektiivsuses ja ohutuses.
ülaosa
Kõrvaltoimed
Randomiseeritud, topeltpimedates, kontrollitud kliinilistes uuringutes on Actos'iga ravitud enam kui 8500 II tüüpi diabeediga patsienti. See hõlmab 260 aktiivset II tüüpi diabeediga kõrge riskiga patsienti, keda raviti PROaktiivse kliinilise uuringu Actos'ega. Üle 6000 patsiendi on ravi olnud vähemalt 6 kuud ja üle 4500 patsiendi vähemalt üks aasta. Actos'i on vähemalt 2 aasta jooksul saanud üle 3000 patsiendi.
Tabelis 7 on toodud Actos monoteraapiaga 7,5 mg, 15 mg, 30 mg või 45 mg üks kord päevas manustatava platseebo-kontrollitud kliinilistes uuringutes esinenud kõrvaltoimete üldine esinemissagedus ja tüübid.
Tabel 7 Actos monoteraapia platseebokontrollitud kliinilised uuringud: kõrvaltoimed, mille esinemissagedus on umbes 5% Actos'iga ravitud patsientidest
| (% patsientidest) | ||
| Platseebo N = 259 |
Actos N = 606 |
|
| Ülemiste hingamisteede infektsioon | 8.5 | 13.2 |
| Peavalu | 6.9 | 9.1 |
| Sinusiit | 4.6 | 6.3 |
| Müalgia | 2.7 | 5.4 |
| Hammaste häire | 2.3 | 5.3 |
| Diabeedi müelitus süvenenud | 8.1 | 5.1 |
| Farüngiit | 0.8 | 5.1 |
Enamiku kliiniliste kõrvaltoimete esinemissagedus oli sarnane Actos monoteraapiaga ravitud rühmade ja nende rühmade puhul, keda raviti kombinatsioonis sulfonüüluurea, metformiini ja insuliiniga. Actos'i ja insuliiniga ravitud patsientidel esteetide esinemissagedus suurenes võrreldes ainult insuliiniga.
16-nädalases platseebokontrollitud Actos pluss-insuliini uuringus (n = 379) raviti 10 Actos plus-iga patsienti insuliinil tekkis hingeldus ja mingil hetkel ka ravi ajal kas kehakaalu muutus või tursed. Nendest 10 patsiendist seitse said nende sümptomite raviks diureetikume. Insuliini ja platseebo rühmas seda ei olnud.
Platseebokontrollitud kliinilistest uuringutest loobumise esinemissagedus muude kõrvaltoimete kui hüperglükeemia tõttu oli sarnane platseeboga ravitud patsientide (2,8%) või Actos'ega (3,3%) korral.
Kontrollitud kombinatsioonravi uuringutes sulfonüüluurea või insuliiniga täheldati kerget kuni mõõdukat hüpoglükeemiat, mis näib olevat annusest sõltuv (vt ETTEVAATUSABINÕUD, Üldine, hüpoglükeemia ja ANNUSTAMINE JA HALDAMINE, Kombineeritud teraapia).
USA topeltpimedas uuringus täheldati aneemiat 2% -l patsientidest, keda raviti Actos'e ja sulfonüüluurea, metformiini või insuliiniga (vt ETTEVAATUSABINÕUD, Üldine, hematoloogiline).
Monoteraapia uuringutes esines ödeemi 4,8% -l Actos'ega ravitud patsientidest (annustega 7,5 mg kuni 45 mg) ja 1,2% -l platseebot saanud patsientidest. Kombineeritud ravi uuringutes esines ödeemi 7,2% patsientidest, keda raviti Actos ja sulfonüüluurea ravimitega, võrreldes 2,1% patsientidest, kes said ainult sulfonüüluureaid. Metformiiniga kombineeritud ravi uuringutes esines ödeemi 6,0% -l kombineeritud ravi saavatest patsientidest ja 2,5% -l ainult metformiiniga ravitud patsientidest. Kombineeritud ravi uuringutes insuliiniga esines ödeemi 15,3% -l kombineeritud ravi saavatest patsientidest ja 7,0% -l patsientidest, kes said ainult insuliini. Enamikku neist sündmustest peeti kergeks või mõõduka intensiivsusega (vt ETTEVAATUSABINÕUD, Kindral, tursed).
Ühes 16-nädalases kliinilises uuringus insuliini ja Actos'e kombinatsioonraviga tekkis rohkem patsiente kongestiivset südamepuudulikkust kombineeritud ravi korral (1,1%), mitte ühegi patsiendi puhul ainult insuliini kasutamisel (vt HOIATUSED, Südamepuudulikkus ja muud südamehaigused).
Pioglitasooni perspektiivne kliiniline uuring makrovaskulaarsete sündmuste korral (PROaktiivne)
PROaktiivses uuringus osales 5238 II tüüpi diabeediga patsienti, kellel oli varasem makrovaskulaarne haigus töödeldud Actos'iga (n = 2605), tiitritakse jõuga kuni 45 mg päevas või platseeboga (n = 2633) lisaks standardsele hooldusest. Peaaegu kõik katsealused (95%) said kardiovaskulaarseid ravimeid (beetablokaatorid, AKE inhibiitorid, ARB-d, kaltsiumikanali blokaatorid, nitraadid, diureetikumid, aspiriin, statiinid, fibraadid). Patsientide keskmine vanus oli 61,8 aastat, keskmine diabeedi kestus 9,5 aastat ja keskmine HbA1c 8,1%. Keskmine jälgimisperiood oli 34,5 kuud. Selle uuringu peamine eesmärk oli uurida Actose mõju suremusele ja makrovaskulaarne haigestumus II tüüpi suhkurtõvega patsientidel, kellel oli kõrge risk makrovaskulaarsed sündmused. Esmane efektiivsuse muutuja oli aeg kardiovaskulaarse komposiidi tulemusnäitaja mis tahes sündmuse esimese esinemiseni (vt tabel 8 allpool). Ehkki Actos'i ja platseebo vahel ei olnud statistiliselt olulist erinevust 3-aastase esinemissageduse osas esimene sündmus selles ühendis ei olnud suremuse ega makrovaskulaarsete sündmuste suurenemist koos Actos.
Tabel 8 Kardiovaskulaarses komposiitnäitajas iga komponendi esimese ja koguürituse arv
| Platseebo N = 2633 |
Actos N = 2605 |
|||
| Südame-veresoonkonna sündmused | Esimesed sündmused (N) |
Üritusi kokku (N) |
Esimesed sündmused (N) |
Üritusi kokku (N) |
| Mis tahes sündmus | 572 | 900 | 514 | 803 |
| Kõigist põhjustatud suremus | 122 | 186 | 110 | 177 |
| Mittesurmav MI | 118 | 157 | 105 | 131 |
| Stroke | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Südame sekkumine | 101 | 240 | 101 | 195 |
| Jala suur amputatsioon | 15 | 28 | 9 | 28 |
| Jalade revaskularisatsioon | 57 | 92 | 71 | 115 |
Turuletulekujärgsed teated on ka ilmnenud või halvenenud nägemisteravuse diabeetilise makulaarse ödeemi kohta (vt ETTEVAATUSABINÕUD, Üldine, makulaarne turse).
Laboratoorsed kõrvalekalded
Hematoloogiline: Actos võib põhjustada hemoglobiini ja hematokriti langust. Actos'iga hemoglobiini ja hematokriti langus näib olevat annusest sõltuv. Kõigis kliinilistes uuringutes langesid Actos'iga ravitud patsientide keskmised hemoglobiinisisaldused 2–4%. Need muutused toimusid tavaliselt esimese 4–12 ravinädala jooksul ja püsisid pärast seda suhteliselt stabiilsena. Need muutused võivad olla seotud Actos-raviga seotud suurenenud plasmamahuga ja neid on harva seostatud olulise hematoloogilise kliinilise toimega.
Seerumi transaminaaside sisaldus: Kõigi USA-s läbi viidud kliiniliste uuringute jooksul oli 14 Actonosega ravitud 4780-st patsiendist 47,30 (0,30%) ALAT väärtused ravi ajal 3-kordsed kui normaalse ülempiir. Kõigil patsientidel, kellel oli kontrollväärtus, oli ALAT aktiivsuse tõus pöörduv. Actosiga ravitud patsientide populatsioonis vähenesid viimasel visiidil algväärtusega võrreldes bilirubiini, ASAT, ALAT, aluselise fosfataasi ja GGT keskmised väärtused. Alla 0,9% Actosiga ravitud patsientidest katkestati USA-s kliinilistest uuringutest maksafunktsiooni ebanormaalsete testide tõttu.
Heakskiidu saamiseelses kliinilises uuringus ei esinenud maksapuudulikkusele viinud idiosünkraatiliste ravimireaktsioonide juhtumeid (vt ETTEVAATUSABINÕUD, Üldine, mõju maksale).
CPK tase: Kliinilistes uuringutes nõutud laboratoorsete uuringute käigus täheldati kreatiinfosfokinaasi (SPK) juhuslikku ja mööduvat tõusu. 9 patsiendil täheldati isoleeritud tõusu, mis ületas normi ülempiiri üle 10 korra (väärtused 2150 kuni 11400 RÜ / L). Kuus neist patsientidest jätkas Actos kasutamist, kaks patsienti olid uuringu lõpetanud - ravimid kõrgenenud väärtuse ilmnemise ajal ja üks patsient katkestas uuringuravimid kõrgendus. Need tõusud taandusid ilma ilmsete kliiniliste tagajärgedeta. Nende sündmuste seos Actos-teraapiaga pole teada.
ülaosa
Üleannustamine
Kontrollitud kliinilistes uuringutes teatati ühest Actos'i üleannustamise juhtumist. Meespatsient võttis neli päeva päevas 120 mg, seejärel seitse päeva 180 mg päevas. Patsient eitas sel perioodil mingeid kliinilisi sümptomeid.
Üleannustamise korral tuleb vastavalt patsiendi kliinilistele sümptomitele ja sümptomitele alustada sobivat toetavat ravi.
ülaosa
Annustamine ja manustamine
Actos'i tuleks võtta üks kord päevas, sõltumata söögikordadest.
Diabeedivastase ravi juhtimine peaks olema individuaalne. Ideaalis tuleks ravivastust hinnata HbA abil1c mis on pikaajalise glükeemilise kontrolli parem näitaja kui ainult FPG. HbA1c kajastab glükeemiat viimase kahe kuni kolme kuu jooksul. Kliinilises kasutuses on soovitatav patsiente ravida Actos'ega nii kaua, et HbA muutuse hindamine oleks piisav1c (kolm kuud), välja arvatud juhul, kui glükeemiline kontroll halveneb. Pärast Actos'i kasutamise alustamist või annuse suurendamist tuleb patsiente hoolikalt jälgida vedelikupeetusega seotud kõrvaltoimete suhtes (vt lõik 4.2) BOXED HOIATUS ja HOIATUSED).
Monoteraapia
Actos monoteraapiat võib patsientidel, kelle toitumine ja füüsiline koormus ei ole piisavalt kontrolli all, alustada annusega 15 mg või 30 mg üks kord ööpäevas. Patsientidel, kes reageerivad Actos'i algannusele ebapiisavalt, võib annust suurendada suurendades kuni 45 mg üks kord päevas. Patsientide puhul, kes ei reageeri monoteraapiale piisavalt, tuleb kaaluda kombineeritud ravi kasutamist.
Kombineeritud ravi
Sulfonüüluuread: Actos'e kasutamist koos sulfonüüluureaga võib alustada annusega 15 mg või 30 mg üks kord päevas. Actos-ravi alustamisel võib praegust sulfonüüluurea annust jätkata. Kui patsiendid teatavad hüpoglükeemiast, tuleb sulfonüüluurea annust vähendada.
Metformiin: Actos'i võib kombinatsioonis metformiiniga alustada annusega 15 mg või 30 mg üks kord päevas. Actos-ravi alustamisel võib metformiini praegust annust jätkata. Actos'iga kombineeritud ravi ajal on ebatõenäoline, et metformiini annust tuleb kohandada hüpoglükeemia tõttu.
Insuliin: Actos'i kasutamist koos insuliiniga võib alustada annusega 15 mg või 30 mg üks kord päevas. Actos-ravi alustamisel võib praegust insuliiniannust jätkata. Actosit ja insuliini saavatel patsientidel võib insuliini annust vähendada 10–25%, kui patsient teatab hüpoglükeemiast või kui vere glükoosikontsentratsioon langeb alla 100 mg / dL. Edasised kohandused tuleks individuaalselt kohandada vastavalt glükoosisisaldust langetavale reageeringule.
Maksimaalne soovitatav annus
Actos'i annus ei tohi ületada 45 mg üks kord päevas monoteraapiana või kombinatsioonis sulfonüüluurea, metformiini või insuliiniga.
Neerupuudulikkusega patsientidel ei ole annuse kohandamine soovitatav (vt lõik 4.2) KLIINILINE FARMAKOLOOGIA, Farmakokineetika ja ravimite metabolism).
Actos-ravi ei tohiks alustada, kui patsiendil on kliinilisi tõendeid aktiivse maksahaiguse või suurenenud seerumi transaminaaside sisaldus (ALAT on üle 2,5 korra üle normi ülemise piiri) ravi alguses (vt ETTEVAATUSABINÕUD, Üldine, maksafunktsiooniline toime ja KLIINILINE FARMAKOLOOGIA, Eripopulatsioonid, maksapuudulikkus). Kõigil patsientidel on soovitatav enne Actos-ravi alustamist ja perioodiliselt pärast seda jälgida maksaensüümide aktiivsust (vt lõik 4.2) ETTEVAATUSABINÕUD, Üldine, mõju maksale).
Actos'i kasutamise kohta alla 18-aastastel patsientidel andmed puuduvad; seetõttu ei ole Actos'i kasutamine lastel soovitatav.
Actos'i kasutamise kohta koos teise tiasolidiindiooniga andmed puuduvad.
ülaosa
Kuidas komplektis
Actos on saadaval 15 mg, 30 mg ja 45 mg tablettidena järgmiselt:
15 mg tablett: valge kuni valkjas, ümmargune, kumer, poolitusjooneta tablett, mille ühel küljel on "Actos" ja teisel "15", saadaval järgmistes keeltes:
NDC 64764-151-04 30 pudelit
NDC 64764-151-05 pudelid 90-st
NDC 64764-151-06 500 pudelit
30 mg tablett: valge kuni valkjas ümmargune lame poolitusjooneta tablett, mille ühel küljel on "Actos" ja teisel "30", saadaval järgmises keeles:
NDC 64764-301-14 pudelid 30-st
NDC 64764-301-15 pudelid 90-st
NDC 64764-301-16 500 pudelit
45 mg tablett: valge kuni valkjas ümmargune lame poolitusjooneta tablett, mille ühel küljel on "Actos" ja teisel "45", saadaval järgmistes keeltes:
NDC 64764-451-24 pudelid 30-st
NDC 64764-451-25 pudelid 90-st
NDC 64764-451-26 500 pudelit
LADUSTAMINE
Hoida temperatuuril 25 ° C (77 ° F); ekskursioonid on lubatud temperatuurini 15-30 ° C (59-86 ° F) [vt USP kontrollitud ruumi temperatuur]. Hoida pakend tihedalt suletuna ja kaitsta niiskuse ja niiskuse eest.
ülaosa
Viited
- Deng, LJ, et al. Gemfibrosiili mõju pioglitasooni farmakokineetikale. Eur J Clin Pharmacol 2005; 61: 831-836, tabel 1.
2. Jaakkola, T, et al. Rifampitsiini mõju pioglitasooni farmakokineetikale. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Ainult Rx
Toodetud:
Takeda farmaatsiaettevõte
Osaka, Jaapan
Turustas:
Takeda Pharmaceuticals America, Inc.
Üks Takeda Parkway
Deerfield, IL 60015
Actos® on Takeda Pharmaceutical Company Limited registreeritud kaubamärk ja seda kasutab Takeda Pharmaceuticals America, Inc. litsentsi alusel.
Kõik muud kaubamärginimed on nende vastavate omanike omand.
Viimati värskendatud: 08/09
Actos, pioglitasoon hcl, teave patsiendi kohta (lihtsas inglise keeles)
Üksikasjalik teave diabeedi märkide, sümptomite, põhjuste, ravi kohta
Selles monograafias sisalduv teave ei hõlma kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet ega kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi: Sirvige kõiki diabeedi ravimeid


