Iloperidoon (fanapt) täielik väljakirjutamise teave
Kaubamärk: Fanapt
Üldnimi: Iloperidoon
Fanapt (Iloperidoon) väljakirjutamisjuhend (PDF)
Sisu:
Kastiga hoiatus
Näidustused ja kasutamine
Annustamine ja manustamine
Vastunäidustused
Hoiatused ja ettevaatusabinõud
Kõrvaltoimed
Ravimite koostoimed
Kasutamine konkreetsetes populatsioonides
Uimastite kuritarvitamine ja sõltuvus
Üleannustamine
Kirjeldus
Kliiniline farmakoloogia
Mittekliiniline toksikoloogia
Kliinilised uuringud
Kuidas komplektis
Brintellixi ravijuhend
HOIATUS: DEMENTIAGA SEOTUD PSÜHHOOSIGA Eakate patsientide suremus suurenenud
Dementsusega seotud psühhoosiga eakatel patsientidel, keda ravitakse antipsühhootiliste ravimitega, on suurenenud surmaoht. FANAPT ei ole heaks kiidetud dementsusega seotud psühhoosiga patsientide raviks.
Näidustused ja kasutamine
FANAPT® on näidustatud skisofreenia raviks täiskasvanutel.
Selle haigusseisundi jaoks pakutavate alternatiivsete raviviiside hulgast valides peaks määraja arvestama järeldusega, et FANAPT on seotud QTc-intervalli pikenemisega. Mõnede teiste ravimite puhul on QTc-intervalli pikenemine seotud võimega torsade de tekitada pointes tüüpi arütmia, potentsiaalselt fataalne polümorfne ventrikulaarne tahhükardia, mis võib põhjustada surm. Paljudel juhtudel võib see järeldada, et kõigepealt tuleks proovida teisi ravimeid. Kas FANAPT põhjustab torsade de pointes'e tekkimist või äkksurma suurenemist, pole veel teada.
Patsiendid tuleb tiitrida efektiivse FANAPT'i annusega. Seega võib sümptomite kontroll esimese 1-2 ravinädala jooksul edasi lükata võrreldes mõne teise antipsühhootilise ravimiga, mis ei vaja sarnast tiitrimist. Psühhoosivastase ravimi valimisel skisofreenia raviks peaksid arstid seda viivitust arvestama.
jätka lugu allpool
Annustamine ja manustamine
Tavaline annus
FANAPT'i tiitrimist tuleb aeglaselt alustada väikesest algannusest alates, et vältida ortostaatilist hüpotensiooni selle alfa-adrenoblokeerivate omaduste tõttu. FANAPT tablettide soovitatav algannus on 1 mg suu kaudu kaks korda päevas. Annust võib suurendada, et saavutada sihtvahemik 6–12 mg kaks korda päevas (12_24 mg / päevas). Päevast annust tuleb kohandada nii, et see ei ületaks 2 mg kaks korda päevas (4 mg / päevas). Maksimaalne soovitatav annus on 12 mg kaks korda päevas (24 mg / päevas). FANAPTi annuseid üle 24 mg ööpäevas ei ole kliinilistes uuringutes süstemaatiliselt hinnatud. Efektiivsust demonstreeriti FANAPT-iga annuses 6–12 mg kaks korda päevas. Ravimi väljakirjutajad peaksid arvestama asjaoluga, et patsiendid tuleb tiitrida efektiivse FANAPT-annusega. Seega võib sümptomite kontroll esimese 1-2 ravinädala jooksul edasi lükata võrreldes mõne teise antipsühhootilise ravimiga, mis ei vaja sarnast tiitrimist. Ravimi väljakirjutajad peaksid ka teadma, et mõned FANAPT-i kasutamisega seotud kahjulikud mõjud on annusest sõltuvad. FANAPTi võib manustada söögikordadest sõltumata.
Annustamine eripopulatsioonides
Annuse kohandamine patsientidele, kes võtavad FANAPT-i samaaegselt potentsiaalsete CYP2D6 inhibiitoritega: FANAPT-i annus peab olema vähenenud poole võrra, kui seda manustatakse koos tugevate CYP2D6 inhibiitoritega nagu fluoksetiin või paroksetiin. Kui CYP2D6 inhibiitor lõpetatakse kombineeritud ravist, tuleb FANAPTi annust suurendada seni, kuni ta oli.
Annuse kohandamine patsientidele, kes võtavad FANAPT-i samaaegselt potentsiaalsete CYP3A4 inhibiitoritega: FANAPT-i annus peab olema vähenenud poole võrra, kui neid manustatakse koos tugevate CYP3A4 inhibiitoritega nagu ketokonasool või klaritromütsiin. Kui CYP3A4 inhibiitor lõpetatakse kombineeritud ravist, tuleb FANAPTi annust suurendada seni, kuni ta oli.
Annuse kohandamine FANAPTi kasutavatel patsientidel, kes on CYP2D6 halvad metaboliseerijad: FANAPTi annust tuleb vähendada poole võrra, kui CYP2D6 metaboliseerub halvasti.
Maksakahjustus: Kerge maksakahjustusega patsientidel ei ole vaja FANAPT-i annust kohandada. Mõõduka maksakahjustusega patsiendid võivad vajada annuse vähendamist, kui see on kliiniliselt näidustatud. FANAPT'i ei soovitata kasutada raske maksakahjustusega patsientide jaoks.
Hooldusravi
Pikemas perspektiivis läbiviidud uuringus oli FANAPT efektiivne skisofreeniaga patsientide retsidiivini viivitamisel, kui FANAPT saavutas stabiliseerumise kuni 24 mg päevas. Patsiente tuleb säilitusravi vajaduse määramiseks perioodiliselt ümber hinnata.
Ravi taasalustamine patsientidel, kes on varem katkestatud, ehkki puuduvad andmed konkreetse haiguse taasalustamise kohta Kui patsiendil on olnud FANAPT-i vaheline intervall rohkem, on soovitatav järgida tiitrimise alustamise ajakava kui 3 päeva.
ülaosa
Annustamisvormid ja tugevused
FANAPT tabletid on saadaval järgmistes tugevustes: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg ja 12 mg. Tabletid on valged, ümmargused, lamedad, kaldus servaga ja tähistatud logoga “”, mille ühele küljele on pressitud tableti tugevus “1”, “2”, “4”, “6”, “8”, “10”, või “12” on teisele küljele trükitud.
ülaosa
Vastunäidustused
FANAPT on vastunäidustatud isikutele, kellel on teadaolev ülitundlikkusreaktsioon toote suhtes. On teatatud anafülaksiast, angioödeemist ja muudest ülitundlikkusreaktsioonidest.
ülaosa
HOIATUSED JA ETTEVAATUSABINÕUD
Dementsusega seotud psühhoosiga eakate patsientide suurenenud suremus
Antipsühhootilised ravimid suurendavad dementsusega seotud psühhoosiga eakate patsientide surmapõhjuseid. 17 dementsusega seotud psühhoosiga platseebokontrollitud uuringu analüüsid (modaalne kestus 10 nädalat ja enamasti atüüpilist ravi saavatel patsientidel antipsühhootilised ravimid), mis näitas uimastitega ravitud patsientide surmaohtu 1,6–1,7-kordse platseebot saanud patsientide puhul. Tüüpilise 10-nädalase kontrollitud uuringu jooksul oli ravimiga ravitud patsientide surmajuhtumite määr umbes 4,5%, platseeboga ravitud patsientide puhul umbes 2,6%.
Ehkki surma põhjused olid erinevad, näis enamik surmajuhtumeid olevat kas kardiovaskulaarsed (nt südamepuudulikkus, äkksurm) või nakkavad (nt kopsupõletik). FANAPT ei ole heaks kiidetud dementsusega seotud psühhoosiga patsientide raviks.
Tserebrovaskulaarsed kõrvaltoimed, sealhulgas insult, dementsusega seotud psühhoosiga eakatel patsientidel
Platseebokontrollitud uuringutes dementsusega eakate patsientidega randomiseeriti patsiendid risperidooni, aripiprasooli ja olansapiini esinemissagedus insuldi ja mööduva isheemia, sealhulgas surmaga lõppenud insult. FANAPT ei ole heaks kiidetud dementsusega seotud psühhoosiga patsientide raviks.
QT pikendamine
Skisofreenia või skisoafektiivse häirega patsientide (n = 160) avatud QTc-uuringus seostati FANAPT-i QTc pikenemisega 9 msek iloperidooni annusega 12 mg kaks korda päevas. FANAPT mõju QT intervallile suurendas CYP450 2D6 või 3A4 metaboolne pärssimine (vastavalt 20 mg paroksetiini üks kord päevas ja ketokonasooli 200 mg kaks korda päevas). Nii 2D6 kui ka 3A4 metaboolse inhibeerimise tingimustes seostati FANAPT 12 mg kaks korda päevas QTcF keskmise tõusu algväärtusega umbes 19 ms.
Turustamiseelse kliinilise programmi ajal ei täheldatud torsade de pointes'e ega muude raskete südame rütmihäirete juhtumeid.
FANAPT'i kasutamist tuleks vältida koos teiste ravimitega, mis teadaolevalt pikendavad QTc, sealhulgas klass 1A (nt kinidiin, prokaiinamiid) või III klassi (nt amiodaroon, sotalool) antiarütmikumid, antipsühhootilised ravimid (nt kloorpromasiin, tioridasiin), antibiootikumid (nt gatifloksatsiin, moksifloksatsiin) või mis tahes muud ravimiklass, mis teadaolevalt pikendab QTc-intervalli (nt pentamidiin, levometadüülatsetaat, metadoon). FANAPTi tuleks vältida ka kaasasündinud pika QT sündroomiga patsientidel ja patsientidel, kellel on varem esinenud südame rütmihäireid.
Teatud asjaolud võivad suurendada QTc-intervalli pikendavate ravimite kasutamisel torsade de pointes'i ja / või äkksurma riski, sealhulgas (1) bradükardia; (2) hüpokaleemia või hüpomagneseemia; (3) teiste ravimite samaaegne kasutamine, mis pikendavad QTc-intervalli; ja (4) QT-intervalli kaasasündinud pikenemise olemasolu; (5) hiljutine äge müokardiinfarkt; ja / või (6) kompenseerimata südamepuudulikkus.
FANAPTi määramisel ravimitega, mis pärsivad FANAPT metabolismi, ja patsientidel, kellel on CYP2D6 vähenenud aktiivsus, on vajalik ettevaatus.
Soovitatav on kaaluda FANAPT-ravi alustamist patsientidel, kellel on oht tõsiste haiguste tekkeks elektrolüütide häirete korral on seerumi kaaliumisisalduse ja magneesiumi algväärtused mõõdetud perioodiliselt jälgimine. Hüpokaleemia (ja / või hüpomagneseemia) võib suurendada QT pikenemise ja arütmia riski. FANAPTi ei tohiks vältida patsientidel, kellel on esinenud olulisi südame-veresoonkonna haigusi, nt QT pikenemine, hiljutine äge müokardiinfarkt, kompenseerimata südamepuudulikkus või südame rütmihäired. FANAPT tuleb katkestada patsientidel, kellel on püsiv QTc mõõtmine> 500 ms.
Kui FANAPTi kasutavatel patsientidel ilmnevad sümptomid, mis võivad näidata südame rütmihäirete teket, nt pearinglus, südamepekslemine või minestus, peaks väljakirjutaja algatama täiendava hindamise, sealhulgas südame jälgimine.
Pahaloomuline neuroleptiline sündroom (NMS)
Seoses antipsühhootiliste ravimite, sealhulgas FANAPT-i manustamisega on teatatud potentsiaalselt surmaga lõppevast sümptomite kompleksist, mida mõnikord nimetatakse pahaloomuliseks neuroleptiliseks sündroomiks (NMS). Kliinilisteks ilminguteks on hüperpüreksia, lihasjäikus, muutunud vaimne seisund (sh katatoonilised tunnused) ja autonoomse ebastabiilsuse tunnused (ebaregulaarne pulss või vererõhk, tahhükardia, diaforees ja süda düsütmia). Täiendavad nähud võivad olla kreatiinfosfokinaasi taseme tõus, müoglobinuuria (rabdomüolüüs) ja äge neerupuudulikkus. Selle sündroomiga patsientide diagnostiline hindamine on keeruline. Diagnoosi saamiseks on oluline kindlaks teha juhtumid, mille kliiniline ülevaade hõlmab nii tõsine meditsiiniline haigus kui ka ravimata või ebapiisavalt ravitud ekstrapüramidaalsed nähud ja sümptomid (EPS). Muud olulised kaalutlused diferentsiaaldiagnostikas hõlmavad tsentraalset antikolinergilist toksilisust, kuumarabandust, ravimipalavikku ja primaarset kesknärvisüsteemi (KNS) patoloogiat.
Selle sündroomi ravi peaks hõlmama: (1) antipsühhootikumide ja muude ravimite, mis pole samaaegseks raviks hädavajalikud, viivitamatut katkestamist, (2) intensiivne sümptomaatiline ravi ja meditsiiniline jälgimine ning (3) kaasnevate tõsiste meditsiiniliste probleemide ravi, mille jaoks on olemas spetsiaalne ravi. NMSi spetsiifiliste farmakoloogiliste raviskeemide osas puudub üldine kokkulepe.
Kui patsient vajab pärast NMS-ist taastumist antipsühhootilist ravimit, tuleb hoolikalt kaaluda ravimiravi võimalikku taasalustamist. Patsienti tuleb hoolikalt jälgida, kuna on teatatud NMS-i kordumisest.
Hiline düskineesia
Tardiivne düskineesia on sündroom, mis koosneb potentsiaalselt pöördumatutest, tahtmatutest düskineetilistest liikumistest, mis võivad tekkida antipsühhootiliste ravimitega ravitud patsientidel. Kuigi sündroomi levimus näib olevat kõige suurem eakate, eriti eakate naiste seas, on seda võimatu teha tuginevad levimusprognoosidele, et ennustada antipsühhootilise ravi alguses, millistel patsientidel tõenäoliselt haigestub sündroom. Kas antipsühhootilised ravimid erinevad oma potentsiaalist põhjustada tardiivset düskineesiat, pole teada.
Usutakse tardiivse düskineesia tekkimise ohtu ja tõenäosust, et see muutub pöördumatuks suureneb ravi kestuse ja antipsühhootikumide kogu kumulatiivse annuse suurenemisel suureneb. Kuid sündroom võib areneda, kuigi palju harvemini, pärast suhteliselt lühikesi raviperioode väikestes annustes.
Tardiivse düskineesia väljakujunenud juhtumite korral pole teadaolevat ravi, kuigi antipsühhootilise ravi katkestamisel võib sündroom osaliselt või täielikult leevendada. Antipsühhootiline ravi ise võib aga sündroomi tunnuseid ja sümptomeid alla suruda (või osaliselt alla suruda) ja seeläbi maskeerida selle protsessi. Sümptomaatilise supressiooni mõju sündroomi pikaajalisele kulgemisele ei ole teada.
Neid kaalutlusi arvestades tuleks FANAPT välja kirjutada viisil, mis minimeerib tõenäoliselt tardiivse düskineesia. Krooniline antipsühhootiline ravi tuleks üldiselt reserveerida patsientidele, kes põevad kroonilist haigust, millele (1) teadaolevalt reageerib antipsühhootilised ravimid ja (2) kellele alternatiivsed, võrdselt tõhusad, kuid potentsiaalselt vähem kahjulikud ravimeetodid puuduvad, või sobiv. Patsientidel, kes vajavad kroonilist ravi, tuleb otsida väikseim annus ja lühim ravi kestus, mis tagab rahuldava kliinilise vastuse. Ravi jätkamise vajadust tuleb perioodiliselt ümber hinnata.
Kui FANAPT-ravi saaval patsiendil ilmnevad tardiivse düskineesia nähud ja sümptomid, tuleb kaaluda ravimi katkestamist. Kuid mõned patsiendid võivad vajada ravi FANAPT-iga, hoolimata sündroomi olemasolust.
Ainevahetuse muutused
Ebatüüpilisi antipsühhootilisi ravimeid on seostatud metaboolsete muutustega, mis võivad suurendada kardiovaskulaarse / tserebrovaskulaarse riski. Need metaboolsed muutused hõlmavad hüperglükeemiat, düslipideemiat ja kehakaalu tõusu. Ehkki on näidatud, et kõik ebatüüpilised antipsühhootilised ravimid põhjustavad metaboolseid muutusi, on igal selle klassi ravimil oma spetsiifiline riskiprofiil.
Hüperglükeemia ja diabeedi müelitus
Atüüpiliste antipsühhootikumidega (sh FANAPT) ravitud patsientidel on teatatud hüperglükeemiast, mis on mõnel juhul äärmuslik ja seotud ketoatsidoosi või hüperosmolaarse kooma või surmaga. Atüüpilise antipsühhootikumi tarbimise ja glükoosihäirete vahelise seose hindamine on keeruline suurenemise võimalusega suhkurtõve taustarisk skisofreeniahaigetel ja suhkurtõve esinemissageduse suurenemine üldiselt elanikkond. Neid sekeldusi arvestades pole atüüpilise antipsühhootilise kasutamise ja hüperglükeemiaga seotud kõrvaltoimete seos täielikult mõistetav. Siiski viitavad epidemioloogilised uuringud hüperglükeemiaga seotud kõrvaltoimete suurenenud riskile nendes uuringutes sisalduvate atüüpiliste antipsühhootikumidega ravitud patsientidel.
Atüüpiliste antipsühhootikumide kasutamisega patsiente, kellel on kindlaks tehtud suhkruhaiguse diagnoos, tuleb regulaarselt jälgida glükoosikontrolli halvenemise suhtes. Patsiendid, kellel on suhkurtõve riskifaktorid (nt rasvumine, diabeedi perekonna ajalugu) ja kes alustavad ravi ebatüüpilised antipsühhootikumid peaksid ravi alguses ja perioodiliselt ravi ajal tegema tühja kõhu veresuhkru testi ravi. Kõiki atüüpiliste antipsühhootikumidega ravitud patsiente tuleb jälgida hüperglükeemia sümptomite, sealhulgas polüdipsia, polüuuria, polüfaagia ja nõrkuse suhtes. Patsiendid, kellel ilmnevad atüüpiliste antipsühhootikumidega ravi ajal hüperglükeemia sümptomid, peavad tegema tühja kõhu veresuhkru testi. Mõnel juhul on hüperglükeemia taandunud, kui atüüpiline antipsühhootikum lõpetati; mõned patsiendid vajasid siiski diabeediravi jätkamist hoolimata kahtlustatava ravimi katkestamisest.
Tabelis 1 on toodud andmed 4-nädalases fikseeritud annusega uuringus skisofreeniaga täiskasvanud isikutel, mille puhul võeti tühja kõhuga vereproovid.
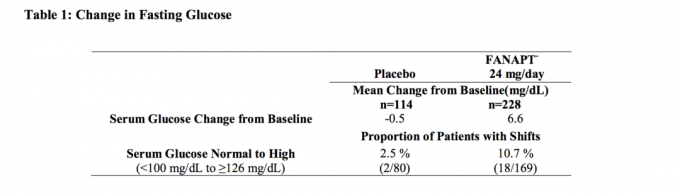
Kliiniliste uuringute, sealhulgas pikemaajaliste uuringute glükoosiandmete koondatud analüüsid on toodud tabelis 2.

Düslipideemia
Atüüpiliste antipsühhootikumidega ravitud patsientidel on täheldatud lipiidide soovimatuid muutusi.
Tabelis 3 on toodud andmed platseebokontrollitud, 4-nädalase, fikseeritud annusega uuringutest, mille käigus võeti tühja kõhuga vereproovid.

Kliiniliste uuringute, sealhulgas pikemaajaliste uuringute kolesterooli ja triglütseriidide koondatud analüüsid on toodud tabelites 4 ja 5.


Kaalutõus
Atüüpilise antipsühhootikumi kasutamisel on täheldatud kehakaalu tõusu. Soovitatav on kaalu kliiniline jälgimine.
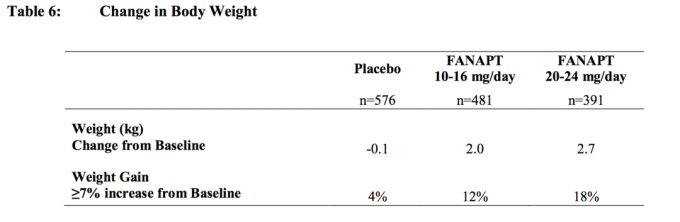
Kõigis lühi- ja pikaajalistes uuringutes oli keskmine keskmine tulemus algväärtusest 2,1 kg.
Kehakaalu (kg) muutused ja katsealuste osakaal, kelle kehakaal on ≥7%, alates 4-st platseebo-kontrollitud, 4- või 6-nädalased, fikseeritud või paindliku annusega uuringud täiskasvanutel on esitatud Tabel 6.
Krambid
Lühiajalistes platseebokontrollitud uuringutes (4–6 nädalat) esines krampe 0,1% -l (1/1344) FANAPT-iga ravitud patsientidest, võrreldes 0,3% -ga (2/587) platseebot saanud patsientidel. Nagu teiste antipsühhootikumide puhul, tuleb ka FANAPT'i kasutada ettevaatusega patsientidel, kellel on anamneesis krampe või haigusseisundid, mis võivad krambiläve madalamaks muuta. Krambiläve alandavad tingimused võivad olla 65-aastase või vanema elanikkonna hulgas enam levinud.
Ortostaatiline hüpotensioon ja minestus
FANAPT võib esile kutsuda ortostaatilist hüpotensiooni, mis on seotud pearingluse, tahhükardia ja minestusega. See peegeldab selle alfa1-adrenergilisi antagonisti omadusi. Topeltpimedates platseebokontrollitud lühiajalistes uuringutes, kus annust suurendati aeglaselt, nagu soovitatud ülaltoodud, ilmnes minestus FANAPT-iga ravitud patsientidest 0,4% -l (5/1344) patsientidest, võrreldes 0,2% -l (1/587) platseebo. Ortostaatilist hüpotensiooni täheldati 5% -l patsientidest, kellele manustati 20–24 mg päevas, 3% -l patsientidest, kellele manustati 10–16 mg / päevas, ja 1% -l patsientidest, kes said platseebot. Eeldatakse, et kiirem tiitrimine suurendab ortostaatilise hüpotensiooni ja minestuse kiirust.
FANAPT'i tuleb ettevaatusega kasutada patsientidel, kellel on teadaolevad südame-veresoonkonna haigused (nt südamepuudulikkus, anamneesis müokardiinfarkt, isheemia või juhtivus). kõrvalekalded), tserebrovaskulaarsed haigused või seisundid, mis soodustavad patsiendi hüpotensiooni (dehüdratsioon, hüpovoleemia ja antihüpertensiivsete ravimite ravi) ravimid). Hüpotensiooni suhtes tundlikel patsientidel tuleks kaaluda ortostaatiliste elutähtsate tunnuste jälgimist.
Leukopeenia, neutropeenia ja agranulotsütoos
Kliinilistes uuringutes ja turustamisjärgses kogemuses on ajutiselt teatatud antipsühhootikumidega seotud leukopeenia / neutropeenia juhtudest. Samuti on teatatud agranulotsütoosist (sh surmaga lõppenud juhtumid).
Leukopeenia / neutropeenia võimalikud riskifaktorid hõlmavad olemasolevat madalat valgevereliblede arvu (WBC) ja anamneesis ravimitest põhjustatud leukopeeniat / neutropeeniat. Patsientidel, kellel on eelnevalt olnud madal WBC või kellel on anamneesis olnud ravimite põhjustatud leukopeenia / neutropeenia, tuleb jälgida nende vere täisarvu (CBC). sageli ravi esimestel kuudel ning peaks põhjustama WANCT-i katkestamise, kui WBC languse esimestel märkidel on muu põhjuslik põhjus. tegurid.
Neutropeeniaga patsiente tuleb hoolikalt jälgida palaviku või muude infektsiooninähtude või sümptomite suhtes ning selliste sümptomite või nähtude ilmnemisel tuleb neid viivitamatult ravida. Raske neutropeeniaga patsientidel (neutrofiilide absoluutarv <1000 / mm3) tuleb FANAPT-ravi katkestada ja jälgida WBC-d kuni paranemiseni.
Hüperprolaktineemia
Nagu teistegi dopamiini D2 retseptoreid antagoniseerivate ravimite puhul, tõstab FANAPT prolaktiini taset.
Hüperprolaktineemia võib pärssida hüpotalamuse GnRH, mille tulemuseks on hüpofüüsi gonadotropiini sekretsiooni vähenemine. See omakorda võib pärssida reproduktiivfunktsiooni, kahjustades gonadalsteroidogeneesi nii naistel kui meestel. Prolaktiini tõstevate ühendite kasutamisel on teatatud galaktorröast, amenorröast, günekomastiast ja impotentsusest. Hüpogonadismiga seotud pikaajaline hüperprolaktineemia võib põhjustada luutiheduse vähenemist nii naissoost kui ka meespatsientidel.
Koekultuurikatsed näitavad, et umbes kolmandik inimese rinnavähkidest sõltub prolaktiinist in vitro, a potentsiaalse tähtsuse tegur, kui nende ravimite väljakirjutamist kavandatakse patsiendil, kellel on varem tuvastatud rinnad vähk. FANAPT-ga ravitud hiirtel ja rottidel täheldati piimanäärmete proliferatiivseid muutusi ja seerumi prolaktiini taseme tõusu. Siiani läbi viidud kliinilised ega epidemioloogilised uuringud ei ole näidanud seost selle klassi ravimite kroonilise manustamise ja inimestel esineva tuumorigeneesi vahel; olemasolevaid tõendeid peetakse liiga piiratud, et olla sel hetkel lõplik.
Lühiajalises platseebokontrollitud uuringus (4 nädalat) oli plasma prolaktiini taseme keskmine muutus algtasemest lõpp-punktini FANAPT 24 mg / päevas ravitud rühmas oli kasv 2,6 ng / ml, võrreldes 6,3 ng / ml langusega platseeborühm. Selles uuringus täheldati prolaktiini taseme tõusu plasmas 26% -l FANAPT-iga ravitud täiskasvanutest, võrreldes 12% -ga platseebogrupis. Lühiajalistes uuringutes seostati FANAPT-i tagasihoidliku prolaktiini taseme tõusuga võrreldes mõne muu antipsühhootilise ainega täheldatud suurema prolaktiini taseme tõusuga. Kliiniliste uuringute, sealhulgas pikemaajaliste uuringute koondatud analüüsis täheldati 3210 iloperidooniga ravitaval täiskasvanul günekomastiat kahel meessoost isikul (0,1%) võrreldes 0% -ga platseebot saanud patsientidel ja galaktorröat esines 8 naissoost isikul (0,2%) võrreldes 3 naissoost isikuga (0,5%) platseeboga ravitud patsientidel patsiendid.
Kehatemperatuuri reguleerimine
Antipsühhootiliste ainete põhjustajaks on keha võime vähendada keha põhitemperatuuri. FANAPTi väljakirjutamisel patsientidele, kellel on haigusseisundid, mis võivad põhjustada keha põhitõusu, on asjakohane ettevaatus. temperatuur, nt pingutades treenimine, kokkupuude äärmise kuumusega, samaaegsete antikolinergilise toimega ravimite võtmine või dehüdratsioon.
Düsfaagia
Söögitoru düsmotiilsust ja aspiratsiooni on seostatud antipsühhootiliste ravimite tarvitamisega. Aspiratsioonipneumoonia on eakate patsientide haigestumuse ja suremuse üldine põhjus. FANAPT-i ja muid antipsühhootilisi ravimeid tuleb ettevaatusega kasutada patsientidel, kellel on aspiratsioonipneumoonia oht.
Enesetapp
Enesetapukatse võimalus on omane psühhootilistele haigustele ja ravimteraapiaga peaks kaasnema kõrge riskiga patsientide hoolikas järelevalve. Üleannustamise ohu vähendamiseks tuleb FANAPTi retseptid kirjutada väikseima koguse tablettide jaoks, mis on kooskõlas patsiendi hea raviga.
Priapism
Turustamiseelse programmi FANAPT käigus teatati kolmest priapismi juhtumist. On teatatud, et alfa-adrenoblokeeriva toimega ravimid kutsuvad esile priapismi. FANAPT jagab seda farmakoloogilist aktiivsust. Tõsine priapism võib vajada kirurgilist sekkumist.
Kognitiivse ja motoorse kahjustuse potentsiaal
Nagu ka teised antipsühhootikumid, võib FANAPT kahjustada otsustusvõimet, mõtlemist või motoorseid oskusi. Lühiajalistes, platseebokontrollitud uuringutes esines unisust (sealhulgas sedatsiooni) 11,9% -l (104/874) patsientidest. täiskasvanud patsiendid, keda ravitakse FANAPT'iga annustes 10 mg või rohkem versus 5,3% (31/587) platseebo. Patsiente tuleb hoiatada ohtlike masinate, sealhulgas autode kasutamisel, kuni nad on piisavalt kindlad, et FANAPT-ravi ei kahjusta neid.
ülaosa
Kõrvaltoimed
Kliiniliste uuringute kogemus
Kuna kliinilisi uuringuid viiakse läbi väga erinevates tingimustes, täheldati ravimi kliinilises uuringus kõrvaltoimete määra ei saa otseselt võrrelda mõne teise ravimi kliiniliste uuringute sagedusega ega pruugi kajastada kliinilises uuringus täheldatud määrasid harjutama. Allpool esitatud teave on pärit FANAPTi kliiniliste uuringute andmebaasist, mis koosneb 3229 patsiendist, kes on kokku puutunud skisofreenia raviks FANAPT-iga annuses 10 mg või rohkem. Neist 999 said FANAPT-i vähemalt 6 kuud, 657-l oli FANAPT-i toime vähemalt 12 kuud. Kõik need FANAPT-i saanud patsiendid osalesid mitmeannuselistes kliinilistes uuringutes. FANAPT-ravi tingimused ja kestus varieerusid suuresti ja hõlmasid (kattuvates kategooriates), avatud ja topeltpimedad uuringute etapid, statsionaarsed ja ambulatoorsed, fikseeritud ja paindliku annusega uuringud ning lühi- ja pikaajalised uuringud kokkupuude.
Nendes lõikudes esitatud teave saadi nelja platseebokontrollitud, 4- või 6-nädalase uuringu koondatud andmete põhjal. fikseeritud või paindliku annusega uuringud patsientidega, kes said FANAPTi päevastes annustes vahemikus 10 kuni 24 mg (n = 874).
Kõrvaltoimed, mis esinevad FANAPT-ravi saanud patsientide hulgas vähemalt 2% ja sagedamini kui platseebo
Tabelis 7 on loetletud kõrvaltoimete kogumid, millest teatati spontaanselt neljal platseebokontrollitud 4 või 6 nädalal. fikseeritud või paindliku annusega uuringud, loetledes need reaktsioonid, mis esinesid 2% või enam patsientidest, keda raviti FANAPT-iga ükskõik millises annuses rühmadesse ja mille esinemissagedus FANAPT-iga ravitud patsientide seas oli ükskõik millises annuserühmas suurem kui platseebo.

Annusega seotud kõrvaltoimed kliinilistes uuringutes
4 platseebokontrollitud, 4 või 6-nädalase, fikseeritud või paindliku annusega uuringute koondatud andmete põhjal ilmnesid kõrvaltoimed, mis esinesid rohkem kui 2% esinemissagedus FANAPT-iga ravitud patsientidel ja kelle esinemissagedus patsientidel, keda raviti FANAPT-iga 20–24 mg päevas, oli kaks korda suurem kui FANAPT 10-16 mg / päevas ravitud patsientidel olid: ebamugavustunne kõhus, pearinglus, hüpotensioon, lihasluukonna jäikus, tahhükardia ja kehakaal suurenenud.
Sagedased ja ravimitega seotud kõrvaltoimed kliinilistes uuringutes
4 platseebokontrollitud, 4 või 6-nädalase, fikseeritud või paindliku annusega uuringute koondatud andmete põhjal ilmnesid järgmised kõrvaltoimed ≥ 5% esinemissagedusega ravitavatel patsientidel koos FANAPT-iga ja vähemalt kaks korda platseeborotist vähemalt 1 annuse korral: pearinglus, suukuivus, väsimus, ninakinnisus, unisus, tahhükardia, ortostaatiline hüpotensioon ja kehakaal suurenenud. Pearinglus, tahhükardia ja kehakaalu suurenemine olid annuses 20–24 mg päevas vähemalt kaks korda tavalisemad kui 10–16 mg päevas.
Ekstrapüramidaalsed sümptomid (EPS) kliinilistes uuringutes
4 platseebokontrollitud, 4 või 6-nädalase, fikseeritud või paindliku annusega uuringute koondatud andmed andsid EPS-i kohta teavet. Nendest uuringutest kogutud andmed kõrvaltoimete kohta näitasid järgmist EPS-iga seotud kõrvaltoimete esinemissagedust, nagu on näidatud tabelis 8.

Kliinilistes uuringutes ravi katkestamisega seotud kõrvaltoimed
4 platseebokontrollitud, 4 või 6 nädala, fikseeritud või paindliku annusega uuringute koondatud andmete põhjal kõrvaltoimete tõttu katkestamise esinemissageduse erinevus FANAPT-ravi saanud (5%) ja platseebot saanud (5%) patsientide vahel patsiendid. Ravi katkestamiseni viinud kõrvaltoimete tüübid olid FANAPT- ja platseebot saanud patsientide puhul sarnased.
Kõrvaltoimete demograafilised erinevused kliinilistes uuringutes
4 platseebokontrollitud, 4- või 6-nädalase, fikseeritud või grupi populatsioonide alarühmade uurimine paindliku annusega uuringud ei näidanud mingeid tõendeid ohutuse erinevuste kohta vanuse alusel, sugu või rass.
Laboratoorsete testide kõrvalekalded kliinilistes uuringutes
FANAPT ja platseebo vahel ei olnud erinevusi hematoloogia, uriinianalüüsi või seerumi keemia muutuste tõttu katkestamise esinemissageduses.
Lühiajalistes platseebokontrollitud uuringutes (4–6 nädalat) oli 1,0% (13/1342) iloperidooniga ravitud patsiente hematokrit vähemalt üks kord allpool laiendatud normi allapoole randomiseeritud ravi ajal, võrreldes 0,3% -ga (2/585) platseebo. Kõigis neis uuringutes määratleti alandatud hematokriti laiendatud normivahemik väärtusena, mis oli uuringus kasutatud tsentraliseeritud laboratooriumi normaalvahemikust 15% madalam.
Muud reaktsioonid FANAPTi turustamiseelse hindamise käigus
Järgnevas loendis on MedDRA termineid, mis kajastavad FANAPT-ravi saanud patsientide kõrvaltoimeid korduvate annustena ≥ 4 mg / päevas uuringu igas etapis 3210 FANAPT-iga ravitud andmebaasi abil patsiendid. Kaasatud on kõik teatatud reaktsioonid, välja arvatud need, mis on juba loetletud tabelis 7, või muud kõrvaltoimete osad (6), need, mida käsitletakse Hoiatused ja ettevaatusabinõud (5) - reaktsiooniterminid, mis olid nii üldised, et ei olnud informatiivsed, vähem kui 3 patsiendil teatatud reaktsioonid, mis ei olnud tõsised ega eluohtlikud, reaktsioonid, mis on muidu tavalised taustreaktsioonidena, ja reaktsioonid, mida peetakse ebatõenäolisteks ravimiteks seotud.
Reaktsioonid liigitatakse MedDRA organsüsteemi klasside kaupa ja loetletakse sageduse vähenemise järjekorras järgmiselt määratlused: sagedased kõrvaltoimed esinevad vähemalt 1/100 patsiendil (selles on esitatud ainult need, mida ei ole tabelis 7 loetletud) noteerimine); harva esinevad kõrvaltoimed on need, mis esinevad 1/100 kuni 1/1000 patsiendil; harva esinevad vähem kui 1/1000 patsiendil.
Vere- ja lümfisüsteemi häired: harv - aneemia, rauavaegusaneemia; Harv – leukopeenia
Südame häired: Sage - südamepekslemine; Harv - arütmia, esimese astme atrioventrikulaarne blokaad, südamepuudulikkus (sealhulgas kongestiivne ja äge)
Kõrva- ja labürindihäired: harv –vertigo, tinnitus
Endokriinsüsteemi häired: harv - hüpotüreoidism
Silma kahjustused: Sage - konjunktiviit (ka allergiline); Sage - silmade kuivus, blefariit, silmalaugude tursed, silmade tursed, läätsekujulised hägusused, katarakt, hüperemia (sh konjunktiiv)
Seedetrakti häired: harv - gastriit, sülje hüpersekretsioon, fekaalipidamatus, suuhaavandid; Harv - aftoosne stomatiit, kaksteistsõrmiksoole haavand, hiatus-hernia, hüperklorüdria, huulte haavandid, refluksösofagiit, stomatiit
Üldised häired ja administratiivsed kohaolud: harv - tursed (üldine, südamehaigustest tingitud pussitamine), kõndimisraskused, janu; Harv - hüpertermia
Maksa ja sapiteede häired: harv - sapikivitõbi
Uuringud: Sage: kaal langenud; Sage - hemoglobiini tase langes, neutrofiilide arv suurenes, hematokrit vähenes
Ainevahetus- ja toitumishäired: harv - suurenenud söögiisu, dehüdratsioon, hüpokaleemia, vedelikupeetus
Lihas-skeleti ja sidekoe kahjustused: sagedased - müalgia, lihasspasmid; Harv - tortikollis
Närvisüsteemi häired: harv - paresteesia, psühhomotoorne hüperaktiivsus, rahutus, amneesia, nüstagm; Harv - rahutute jalgade sündroom
Psühhiaatrilised häired: sagedased - rahutus, agressioon, pettekujutelmad; Sage - vaenulikkus, vähenenud libiido, paranoia, anorgasmia, segane seisund, maania, katatoonia, meeleolumuutused, paanika rünnak, obsessiiv-kompulsiivne häire, bulimia nervosa, deliirium, psühhogeenne polüdipsia, impulsside kontrolli häire, tõsised depressioon
Neerude ja kuseteede häired: sage - kusepidamatus; Sage - düsuuria, pollakiuuria, enurees, nefrolitiaas; Harv - kusepeetus, neerupuudulikkus äge
Reproduktiivse süsteemi ja rinnanäärme häired: sagedased - erektsioonihäired; Infrequen - munandivalu, amenorröa, rinnavalu; Harv - ebaregulaarsed menstruatsioonid, günekomastia, menorraagia, metrorraagia, menopausijärgne hemorraagia, prostatiit.
Hingamisteede, rindkere ja mediastiinumi häired: harv - ninaverejooks, astma, rinorröa, siinuse ummikud, nina kuivus; Harv - kurgu kuivus, uneapnoe sündroom, pinguldav hingeldus
Turundusjärgne kogemus
FANAPTi müügiloa saamise järgsel kasutamisel on tuvastatud järgmised kõrvaltoimed: tagasiulatuv ejakulatsioon ja ülitundlikkusreaktsioonid (sealhulgas anafülaksia; angioödeem; kurgu pingutus; orofarünksi turse; näo, huulte, suu ja keele turse; urtikaaria; lööve; ja kihelus). Kuna neid reaktsioone teatati vabatahtlikult ebakindla suurusega elanikkonnast, pole nende esinemissagedust usaldusväärselt võimalik hinnata ega põhjuslikku seost ravimiga kokkupuutumisega kindlaks teha.
ülaosa
Ravimite koostoimed
Arvestades FANAPTi peamist kesknärvisüsteemi mõju, tuleb olla ettevaatlik, kui seda võetakse koos teiste tsentraalselt toimivate ravimite ja alkoholiga. Tänu oma alfa1-adrenergilise retseptori antagonismile on FANAPT võimeline tugevdama teatud antihüpertensiivsete ravimite toimet.
Teiste ravimite potentsiaal mõjutada FANAPTi
Iloperidoon ei ole ensüümide CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ega CYP2E1 substraat. See viitab sellele, et iloperidooni koostoime nende ensüümide inhibiitorite või indutseerijatega või muud tegurid, näiteks suitsetamine, on ebatõenäoline. Iloperidooni metabolismi eest vastutavad nii CYP3A4 kui ka CYP2D6. CYP3A4 (nt ketokonasooli) või CYP2D6 (nt fluoksetiin, paroksetiin) inhibiitorid võivad pärssida iloperidooni eritumist ja põhjustada vere suurenenud sisaldust.
Ketokonasool: tugeva CYP3A4 inhibiitori ketokonasooli (200 mg kaks korda päevas 4 päeva jooksul) samaaegne manustamine koos 3 mg iloperidooni ühekordse annusega terved vabatahtlikud vanuses 18–45 aastat suurendasid iloperidooni ja selle metaboliitide P88 ja P95 kõvera alust pindala (AUC) 57%, 55% ja 35%, vastavalt. Iloperidooni annuseid tuleb vähendada umbes poole võrra, kui neid manustatakse koos ketokonasooliga või muude CYP3A4 tugevate inhibiitoritega (nt itrakonasool). Nõrgemaid inhibiitoreid (nt erütromütsiin, greibimahl) ei ole uuritud. Kui CYP3A4 inhibiitor lõpetatakse kombineeritud ravist, tuleb iloperidooni annus viia tagasi eelmisele tasemele.
Fluoksetiin: tugeva CYP2D6 inhibiitori fluoksetiini (20 mg kaks korda päevas 21 päeva jooksul) samaaegne manustamine iloperidooni ühekordse 3 mg annusega 23 tervele vabatahtlikule vanuses 29-44 aastat. kes klassifitseeriti ulatuslikeks CYP2D6 metaboliseerijateks, suurendasid iloperidooni ja selle metaboliidi P88 AUC umbes 2–3 korda ja vähendasid selle metaboliidi P95 AUC üks pool. Fluoksetiiniga manustamisel tuleb iloperidooni annuseid vähendada poole võrra. Kui fluoksetiin lõpetatakse kombineeritud ravist, tuleb iloperidooni annus viia tagasi eelmisele tasemele. Teistel tugevatel CYP2D6 inhibiitoritel on eeldatavalt sarnane toime ja nad vajavad annuse sobivat vähendamist. Kui CYP2D6 inhibiitor lõpetatakse kombinatsioonravist, võib iloperidooni annust suurendada eelmisele tasemele.
Paroksetiin: paroksetiini (20 mg päevas 5-8 päeva jooksul), mis on tugev CYP2D6 inhibiitor, samaaegne manustamine iloperidooni korduvate annustega (8 või 12 mg kaks korda päevas) 18–65-aastaste skisofreeniaga patsientide korral suurenesid püsikontsentratsiooni iloperidoon ja selle metaboliit P88 umbes 1,6 korda ning tema metaboliidi P95 keskmised püsikontsentratsiooni faasid vähenesid üks pool. Paroksetiiniga manustamisel tuleb iloperidooni annuseid vähendada poole võrra. Paroksetiini kombinatsioonravi lõpetamisel tuleks iloperidooni annus viia tagasi eelmisele tasemele. Teistel tugevatel CYP2D6 inhibiitoritel on eeldatavalt sarnane toime ja nad vajavad annuse sobivat vähendamist. Kui CYP2D6 inhibiitor lõpetatakse kombineeritud ravist, võib iloperidooni annust suurendada eelmisele tasemele.
Paroksetiin ja ketokonasool: CYP2D6 inhibiitori paroksetiini (20 mg üks kord päevas 10 päeva jooksul) ja ketokonasooli (200 mg) koosmanustamine kaks korda päevas) iloperidooni korduvate annustega (8 või 12 mg kaks korda päevas) 18–65-aastaste skisofreeniaga patsientide raviks iloperidooni ja selle metaboliidi P88 tasakaalukontsentratsiooni kontsentratsiooni korduv suurenemine ning P95 1,4-kordne langus paroksetiin. Nii ei lisanud iloperidooni andmine mõlema selle metaboolse raja inhibiitoritega kummagi inhibiitori toimet üksi. Seetõttu tuleks iloperidooni annuseid vähendada umbes poole võrra, kui neid manustatakse samaaegselt nii CYP2D6 kui ka CYP3A4 inhibiitoriga.
FANAPTi potentsiaal mõjutada teisi ravimeid
In vitro uuringud inimese maksa mikrosoomides näitasid, et iloperidoon ei inhibeeri oluliselt selle metabolismi järgmiste tsütokroom P450 isosüümide kaudu metaboliseeritavad ravimid: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 või CYP2E1. Lisaks näitasid in vitro uuringud inimese maksa mikrosoomides, et iloperidoon ei ensüüme indutseerivat omadused, eriti järgmiste tsütokroom P450 isosüümide jaoks: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 ja CYP3A5.
Dekstrometorfaan: Tervete vabatahtlikega läbi viidud uuring näitas, et dekstrometorfaani (80 mg annus) farmakokineetika muutused 3 mg iloperidooni samaaegne manustamine suurendas kogu ekspositsiooni 17% ja maksimaalse plasmakontsentratsiooni Cmax suurenemist 26%. dekstrometorfaan. Seega on iloperidooni ja teiste CYP2D6 substraatide koostoime ebatõenäoline.
Fluoksetiin: iloperidooni ühekordne 3 mg annus ei mõjutanud fluoksetiini (20 mg kaks korda päevas) farmakokineetikat.
Midasolaam (tundlik CYP 3A4 substraat): skisofreeniaga patsientidega läbiviidud uuring näitas midasolaami koguarvu suurenemist vähem kui 50% kokkupuude iloperidooni püsiseisundis (14 päeva suukaudset annustamist kuni 10 mg iloperidooni kaks korda päevas) ja toime midasolaam C-le puudub max Seega on iloperidooni ja teiste CYP3A4 substraatide koostoime ebatõenäoline.
QT-intervalli pikendavaid ravimeid FANAPT-i ei tohiks kasutada koos teiste QT-intervalli pikendavate ravimitega.
ülaosa
Kasutamine konkreetsetes populatsioonides
Raseduse kokkupuute register
On olemas raseduse kokkupuute register, mis jälgib FANAPT-iga raseduse ajal kokku puutunud naiste raseduse tulemusi. Lisateabe saamiseks pöörduge ebatüüpiliste antipsühhootikumide riikliku registri poole telefonil 1-866-961-2388 või minge aadressile http://womensmentalhealth.org/clinical-and -otsinguprogrammid / rasedusregistrid /.
Riski kokkuvõte
Vastsündinutel, kelle emad puutuvad antipsühhootiliste ravimite, sealhulgas FANAPT'iga, raseduse kolmandal trimestril on oht ekstrapüramidaalsete ja / või võõrutusnähtude tekkeks pärast sünnitust. Ravimi FANAPT kasutamise kohta rasedatel piiratud kättesaadavad andmed ei ole piisavad, et teada saada uimastitega seotud peamiste sünnidefektide ja raseduse katkemise riski. Iloperidoon ei olnud organogeneesi ajal suukaudselt tiinetele rottidele manustatuna teratogeenne annustes, mis olid kuni 26-kordsed inimesele soovitatava maksimaalse annuse 24 mg / m2 alusel. Kuid see pikendas raseduse ja sünnituse kestust, suurendas surnult sündimisi, varaseid emakasiseseid surmajuhtumeid, suurendas arengu hilinemisi ja vähendas sünnitusjärgsete poegade ellujäämist. Iloperidoon ei olnud organogeneesi ajal suukaudselt tiinetele küülikutele manustamisel teratogeenne annustes kuni 20-kordselt MRHD-ni mg / m2 kohta. Kuid see suurendas emakasisese varajase surma ja vähendas loote elujõulisust kõrgeima annuse korral, mis oli ka emale toksiline.
Suurte sünnidefektide ja raseduse katkemise taustrisk nimetatud elanikkonnal ei ole teada. USA elanikkonnas on kliiniliselt tunnustatud raseduse ajal hinnanguliselt suurte sünnidefektide ja raseduse katkemise taustrisk vastavalt 2–4% ja 15–20%.
Kliinilised kaalutlused
Loote / vastsündinu kõrvaltoimed
Ekstrapüramidaalsed ja / või võõrutusnähud, sealhulgas agitatsioon, hüpertoonia, hüpotoonia, treemor, unisus, reproduktiivne stress ja - vastsündinutel, kelle emad puutusid antipsühhootiliste ravimitega raseduse kolmandal trimestril, on teatatud toitumishäiretest Rasedus. Nende sümptomite raskusaste on erinev. Mõned vastsündinud paranesid tundide või päevade jooksul ilma spetsiaalse ravita; teised vajasid pikemat haiglaravi. Jälgige vastsündinutel ekstrapüramidaalsete ja / või võõrutusnähtude esinemist ning kontrollige sümptomeid vastavalt.
Andmed
Andmed loomade kohta
Embrüo-loote arengu uuringus manustati tiinetele rottidele 4, 16 või 64 mg / kg päevas (1,6, 6,5 ja 26 korda maksimaalne soovitatav inimesele manustatav iloperidooni annus (MRHD) 24 mg päevas (mg / m2) suu kaudu organogenees. Suurim annus põhjustas emakasisese varase surma suurenemist, loote kaalu ja pikkuse vähenemist, vähenenud loote luustiku luustumine ja väiksemate loote skeleti anomaaliate esinemissageduse suurenemine ja variatsioonid; see annus põhjustas ka emade toidutarbimise ja kehakaalu tõusu vähenemist.
Embrüo ja loote arenguuuringus manustati tiinetele küülikutele organogeneesi perioodil iloperidooni 4, 10 või 25 mg / kg päevas (3, 8 ja 20 korda MRHD-d mg / m2 alusel) iloperidooni. Suurim annus põhjustas emakasisese varase surma suurenemist ja loote elujõulisuse vähenemist tähtaja jooksul; see annus põhjustas ka emale toksilist toimet.
Täiendavates uuringutes, milles rottidele anti iloperidooni ülaltoodud sarnastes annustes, alustades kas eeltöötlusest või alates 17. raseduspäeval ja võõrutamise ajal suurenes kahjulike reproduktiivsete mõjude hulka raseduse pikenemine ja sünnitus surnult sündinud laste arv, suurenenud vistseraalsete loote variatsioonide esinemissagedus, vähenenud loote ja poegade kaal ning vähenenud sünnitusjärgsete poegade arv ellujäämine. Puudusid ravimid ellujäänud poegade neuro-käitumuslikule või reproduktiivsele arengule. Toimeta doosid olid vahemikus 4 kuni 12 mg / kg, välja arvatud surnult sündinud laste arvu suurenemine, mis ilmnes madalaima testitud annuse 4 mg / kg korral, mis on 1,6-kordne MRHD-st mg / m2 kohta. Nendes uuringutes täheldati emade toksilisust suuremate annuste kasutamisel.
Iloperidooni metaboliit P95, mis on iloperidooni peamine ringlev metaboliit inimestel, kuid mida ei esine märkimisväärses koguses rottidel, anti tiinetele rottidele organogeneesi perioodil suukaudsete annustena 20, 80 või 200 mg kg / päevas. Teratogeenset toimet ei täheldatud. Kõigi annuste korral esines luustiku hilinenud luustumine. Emasele olulist toksilisust ei ilmnenud. P95 (AUC) plasmatasemed kõrgeimas testitud annuses olid kaks korda suuremad kui inimestel, kes said iloperidooni MRHD.
Imetamine
Riski kokkuvõte
Iloperidooni või selle metaboliitide olemasolu kohta inimese rinnapiimas puudub teave iloperidooni mõju rinnapiimaga lapsele ega iloperidooni mõju inimese rinnapiimale tootmine. Iloperidooni leidub roti piimas. Kuna rinnapiimatoidul imikul võib esineda tõsiseid kõrvaltoimeid, soovitage naisel FANAPT-ravi ajal mitte last rinnaga toita.
Andmed Radioaktiivsuse ülekandumist imetavate rottide piima uuriti pärast [14C] iloperidooni ühekordset annust 5 mg / kg. Radioaktiivsuse kontsentratsioon piimas 4 tundi pärast manustamist oli peaaegu kümme korda suurem kui samal ajal vereplasmas. Kuid 24 tunni jooksul pärast annustamist oli radioaktiivsuse kontsentratsioon piimas langenud plasma tasemest pisut madalamale. Ainevahetuse profiil piimas oli kvalitatiivselt sarnane plasmaga.
Kasutamine lastel Ohutus ja efektiivsus lastel ja noorukitel pole tõestatud.
Geriaatriline kasutamine
FANAPTi kliinilised uuringud skisofreenia ravis ei hõlmanud piisavat arvu 65-aastased ja vanemad patsiendid, et teha kindlaks, kas nad reageerivad erinevalt kui nooremad täiskasvanud patsiendid. 3210-st patsiendist, keda raviti FANAPT-iga turustamiseelsetes uuringutes, oli 25 (0,5%) ≥65-aastane ja ühtegi ≥75-aastast patsienti ei olnud.
Dementsusega seotud psühhoosiga FANAPT-ravi saavatel eakatel patsientidel on platseeboga võrreldes suurem risk surra. FANAPT ei ole heaks kiidetud dementsusega seotud psühhoosiga patsientide raviks.
Neerukahjustus
Kuna FANAPT metaboliseerub tugevalt ja vähem kui 1% ravimist eritub muutumatul kujul, ei oma ainuüksi neerukahjustus tõenäoliselt märkimisväärset mõju FANAPT-i farmakokineetikale. Neerukahjustus (kreatiniini kliirens <30 ml / min) mõjutas iloperidooni (manustatuna ühekordse 3 mg annusena) ja selle metaboliitide P88 ja P95 Cmax-i minimaalselt ükskõik millises mõõdetud 3analüüsis. Neerukahjustusega isikutel suurenes AUC0– ∞ 24%, vähenes 6% ja suurenes 52% iloperidooni, P88 ja P95 korral.
Maksakahjustus
Kerge maksakahjustusega patsientidel ei ole vaja FANAPT-i annust kohandada. Mõõduka maksakahjustusega patsiendid võivad vajada annuse vähendamist. FANAPT'i ei soovitata kasutada raske maksakahjustusega patsientide jaoks.
Kerge maksakahjustusega täiskasvanud isikutel ei täheldatud iloperidooni, P88 ega P95 (kokku või seondumata) farmakokineetikas olulisi erinevusi võrreldes tervete täiskasvanute kontrollgrupiga. Mõõduka maksakahjustusega isikutel oli aktiivsete metaboliitide P88 suurem (2-kordne) ja varieeruvam vaba ekspositsioon täheldatud võrreldes tervete kontrollidega, samas kui iloperidooni ja P95 kokkupuude oli üldiselt sarnane (vähem kui 50% muutus võrreldes kontroll). Kuna uuringuid raske maksapuudulikkusega isikutega ei ole läbi viidud, ei soovitata FANAPTi raske maksakahjustusega patsientide jaoks.
Suitsetamise staatus
Inimese maksaensüüme kasutavate in vitro uuringute põhjal ei ole FANAPT CYP1A2 substraat; suitsetamine ei tohiks seetõttu mõjutada FANAPTi farmakokineetikat.
Rasedus
ülaosa
Uimastite kuritarvitamine ja sõltuvus
Kontrollitav aine
FANAPT ei ole kontrollitav aine.
Väärkohtlemine
FANAPTi kasutamist loomadel ega inimestel ei ole süstemaatiliselt uuritud selle võimaliku kuritarvitamise, taluvuse või füüsilise sõltuvuse osas. Kuigi kliinilistes uuringutes ei ilmnenud suundumust uimastite otsimise käitumisele, ei olnud need vaatlused süstemaatilised ja see pole võimalik ennustada selle kogemuse põhjal, kui suures ulatuses kesknärvisüsteemi aktiivset ravimit FANAPT kuritarvitatakse, suunatakse ümber ja / või kuritarvitatakse turustatud. Järelikult tuleb patsiente hoolikalt hinnata narkootikumide kuritarvitamise anamneesi osas ja sellised patsiendid peaksid olema jälgitakse tähelepanelikult FANAPTi väärkasutuse või kuritarvitamise nähtude osas (nt tolerantsuse teke, annuse suurendamine, ravimite otsimine) käitumine).
ülaosa
Üleannustamine
Inimkogemus
Turustamiseelsetes uuringutes, milles osales üle 3210 patsiendi, oli FANAPT juhuslik või tahtlik üleannustamine dokumenteeritud 8 patsiendil vahemikus 48 mg kuni 576 mg korraga ja 292 mg 3 päeva jooksul periood. Nendest juhtumitest surmajuhtumeid ei teatatud. Suurim kinnitatud FANAPTi ühekordne sissevõtmine oli 576 mg; sellel patsiendil ei täheldatud kahjulikke füüsilisi mõjusid. Suuruselt järgmine FANAPT'i allaneelamine oli 438 mg 4-päevase perioodi jooksul; selle südamega tagajärgedeta patsiendi kohta täheldati ekstrapüramidaalseid sümptomeid ja QTc-intervalli 507 ms. See patsient jätkas ravi FANAPT-iga veel 11 kuud.
Üldiselt olid FANAPTi teadaolevate farmakoloogiliste mõjude (nt uimasus ja sedatsioon, tahhükardia ja hüpotensioon) liialdamisel tekkinud nähud ja sümptomid.
Üleannustamise ravi
FANAPT-i jaoks puudub spetsiifiline antidoot. Seetõttu tuleks kehtestada sobivad toetusmeetmed. Ägeda üleannustamise korral peab arst looma hingamisteede ja hoidma neid ning tagama piisava hapniku ja ventilatsiooni. Kaaluda tuleks maoloputust (pärast intubatsiooni, kui patsient on teadvuseta) ja aktiivsöe manustamist koos lahtistava ravimiga. Üleannustamise järgselt võib pea ja kaela obstruktsioon, krambid või düstooniline reaktsioon tekitada tekitatud oksendamise korral aspiratsiooni riski. Kardiovaskulaarset jälgimist tuleks alustada kohe ja see peaks hõlmama pidevat EKG jälgimist võimalike rütmihäirete tuvastamiseks. Arütmiavastase ravi korral ei tohiks kasutada disopüramiidi, prokaiinamiidi ega kinidiini, kuna neil on potentsiaalne QT-intervalli pikendav toime, mis võib olla FANAPT-i omadele lisatav. Samamoodi on mõistlik eeldada, et bretüüliumi alfa-blokeerivad omadused võivad olla FANAPT-i omadustele aditiivsed, põhjustades probleemset hüpotensiooni. Hüpotensiooni ja vereringe kollaps tuleb ravida sobivate meetmetega, näiteks intravenoossete vedelike või sümpatomimeetiliste ainetega (epinefriini ja dopamiini ei tohiks kasutada, kuna beeta-stimulatsioon võib FANAPT-indutseeritud alfa-alfaaseme korral hüpotensiooni halvendada blokaad). Tõsiste ekstrapüramidaalsümptomite korral tuleb manustada antikolinergilisi ravimeid. Täpse meditsiinilise järelevalve all tuleb jätkata, kuni patsient taastub.
ülaosa
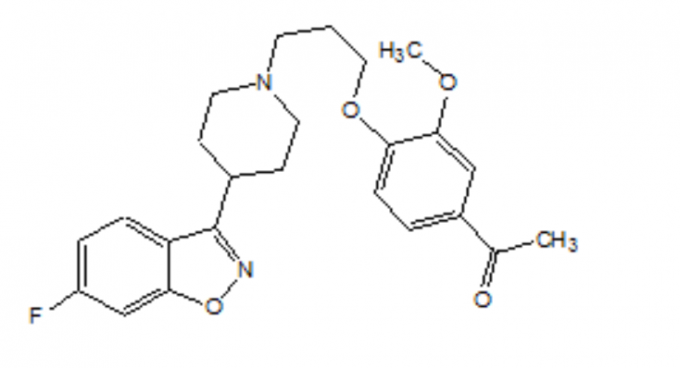
Kirjeldus
FANAPT on ebatüüpiline antipsühhootikum, mis kuulub piperidinüülbensisoksasooli derivaatide keemilisse klassi. Selle keemiline nimetus on 4 '- [3- [4- (6-fluoro-1,2-bensisoksasool-3-üül) piperidino] propoksü] -3'-metoksüatsetofenoon. Selle molekulvalem on C24H27FN2O4 ja selle molekulmass on 426,48. Struktuurivalem on järgmine:
Iloperidoon on valge kuni valkjas peen kristalliline pulber. See on vees praktiliselt lahustumatu, 0,1 N HCI-s väga vähe lahustuv ja kloroformis, etanoolis, metanoolis ja atsetonitriilis lahustuv.
FANAPT tabletid on ette nähtud ainult suukaudseks manustamiseks. Iga voor, katmata
tablett sisaldab 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg või 12 mg iloperidooni. Mitteaktiivsed koostisosad on: laktoosmonohüdraat, mikrokristalne tselluloos, hüdroksüpropüülmetüültselluloos, krospovidoon, magneesiumstearaat, kolloidne räni
dioksiid ja puhastatud vesi (eemaldatakse töötlemise ajal). Tabletid on valged, ümmargused, lamedad, kaldus servaga ja tähistatud logoga ““, mille ühele küljele on pressitud tableti tugevus „1“, „2“, „4“, „6“, „8“, „10“, või “12” on teisele küljele trükitud.
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Iloperidooni toimemehhanism skisofreenia korral pole teada. Iloperidooni efektiivsust võib siiski vahendada II tüüpi dopamiini (D2) ja 2. tüüpi serotoniini (5-HT2) antagonismi kombinatsiooni kaudu.
Iloperidoon moodustab aktiivse metaboliidi P88, millel on in vitro retseptori sidumisprofiil sarnane lähteravimiga.
Farmakodünaamika
Iloperidoon toimib kõrge (nM) afiinsusega antagonistina, seondudes serotoniini 5-HT2A dopamiini D2 ja D3-retseptorid ja norepinefriini NEα1 retseptorid (Ki väärtused 5,6, 6,3, 7,1 ja 0,36 nM, vastavalt). Iloperidoonil on mõõdukas afiinsus dopamiini D4 ja serotoniini 5-HT6 ja 5 -HT7 retseptorite suhtes (Ki väärtused 25, 43 ja 22, nM) vastavalt) ja madal afiinsus serotoniini 5-HT1A, dopamiini D1 ja histamiini H1 retseptorite suhtes (Ki väärtused 168, 216 ja 437 nM, vastavalt). Iloperidoonil puudub märgatav afiinsus (Ki> 1000 nM) kolinergiliste muskariiniretseptorite suhtes. Iloperidooni metaboliidi P88 afiinsus on üldiselt võrdne lähteühendi afiinsusega või väiksem, samas kui ainult metaboliidi P95 afiinsus näitab afiinsust 5-HT2A (Ki väärtus 3,91) ning NEα1A, NEα1B, NEα1D ja NEα2C retseptorite suhtes (Ki väärtused 4,7, 2,7, 8,8 ja 4,7 nM vastavalt).
Farmakokineetika
Iloperidooni, P88 ja P95 vaadeldud keskmine eliminatsiooni poolväärtusaeg CYP2D6 ulatuslikes metaboliseerijates (EM) on vastavalt 18, 26 ja 23 tundi ning halvades metaboliseerijates (PM) on vastavalt 33, 37 ja 31 tundi. Tasakaalukontsentratsioon saavutatakse 3–4 päeva jooksul pärast manustamist. Iloperidooni kuhjumine on ühekordse annuse farmakokineetika põhjal ennustatav. Iloperidooni farmakokineetika on proportsionaalne annusega. Iloperidoon elimineeritakse peamiselt maksa metabolismi kaudu, hõlmates 2 P450 isosüümi, CYP2D6 ja CYP3A4.
Imendumine: pärast tableti manustamist imendub iloperidoon hästi, maksimaalne plasmakontsentratsioon saabub 2... 4 tunni jooksul; samas kui tableti koostise suhteline biosaadavus võrreldes suukaudse lahusega on 96%. Iloperidooni manustamine koos tavalise kõrge rasvasisaldusega toiduga ei mõjutanud oluliselt Cmax ega AUC väärtusi iloperidooni, P88 või P95, kuid Tmax lükkas iloperidooni 1 tunni võrra, P88 2 tunni ja 6 tunni P95. FANAPTi võib manustada söögikordadest sõltumata.
Jaotumine: Iloperidooni kliirens (kliirens / biosaadavus) on 47 kuni 102 l / h, näiv jaotusruumala on 1340-2800 L. Terapeutiliste kontsentratsioonide korral on iloperidooni seondumata fraktsioon plasmas ~ 3% ja iga metaboliidi (P88 ja P95) korral ~ 8%.
Metabolism ja eliminatsioon: Iloperidoon metaboliseeritakse peamiselt kolme biotransformatsiooni raja kaudu: karbonüüli redutseerimine, hüdroksüülimine (vahendab CYP2D6) ja O-demetüleerimine (vahendab CYP3A4). Seal on 2 domineerivat iloperidooni metaboliiti, P95 ja P88. Iloperidooni metaboliit P95 moodustab ulatuslike metaboliseerijate (EM) tasakaalukontsentratsiooni korral 47,9% iloperidooni ja selle metaboliitide AUC-st ning 25% halbade metaboliseerijate (PM) AUC-st. Aktiivne metaboliit P88 moodustab vastavalt 19,5% ja 34,0% plasma koguekspositsioonist vastavalt EM-s ja PM-s.
Ligikaudu 7–10% kaukaaslastest ja 3–8% mustanahalistest / aafrika ameeriklastest puudub CYP2D6 metabolismi võime. substraadid ja neid klassifitseeritakse halbade metaboliseerijatena (PM), ülejäänud on keskmise pikkusega, ulatuslikud või ülikerged metaboliseerijad. FANAPT'i samaaegne manustamine koos teadaolevate tugevate CYP2D6 inhibiitoritega nagu fluoksetiin annab tulemuseks 2,3-kordsuse iloperidooni plasmakontsentratsiooni suurenemine ja seetõttu peaks FANAPTi annusest olema pool manustatud.
Sarnaselt on CYP2D6 PM-de kokkupuude iloperidooniga suurem võrreldes EM-idega ja PM-de annust tuleks vähendada poole võrra. CYP2D6 PM-de tuvastamiseks on olemas laboratoorsed testid.
Suurem osa radioaktiivsetest materjalidest saadi uriinist (vastavalt 58,2% ja 45,1% EM-is ja PM-s), väljaheited moodustasid manustatud radioaktiivsusest 19,9% (EM) kuni 22,1% (PM).
Transpordi koostoime: Iloperidoon ja P88 ei ole P-gp substraadid ja iloperidoon on nõrk P-gp inhibiitor.
ülaosa
Mittekliiniline toksikoloogia
Kantserogenees, mutagenees, viljakuse langus
Kartsinogenees: Elukestva kantserogeensuse uuringud viidi läbi CD-1 hiirte ja Sprague Dawley rottidega. Iloperidooni manustati suu kaudu annustes 2,5, 5,0 ja 10 mg / kg päevas CD-1 hiirtele ja 4, 8 ja 16 mg / kg päevas. Sprague Dawley rotid (vastavalt 0,5, 1,0 ja 2,0 korda ning 1,6, 3,2 ja 6,5 korda), MRHD 24 mg päevas mg / m2 kohta alus). Ainult väikseima annusega (2,5 mg / kg päevas) ravitud emastel hiirtel esines pahaloomuliste piimanäärmete kasvajate esinemissagedust. Rottidel ei olnud raviga seotud neoplaasia suurenemist.
Iloperidooni metaboliidi P95 kantserogeenne potentsiaal, mis on inimestel iloperidooni peamine ringlev metaboliit, kuid mida ei esine hiirtel ega rotte, hinnati eluaegse kartsinogeensuse uuringus Wistari rottidega suukaudsetes annustes 25, 75 ja 200 mg / kg päevas isastel ja 50, 150 ja 250 (vähendatud 400-st) mg / kg päevas. emased. Ravimitega seotud neoplastilised muutused ilmnesid meestel, hüpofüüsis (pars distalis adenoom) kõigi annuste korral ja kõhunäärmes (saarekeste adenoom) suure annuse kasutamisel. P95 (AUC) plasmakontsentratsioon meestel testitud annuste (25, 75 ja 200 mg / kg päevas) korral oli vastavalt 0,4, 3 ja 23 korda suurem kui inimese kokkupuude P95-ga iloperidooni MRHD-l.
Mutagenees: Iloperidoon oli Ames'i testis ning hiire luuüdi ja roti maksa mikrotuuma testides in vivo negatiivne. Iloperidoon kutsus in vitro hiina hamstri munasarja (CHO) rakkudes esile kromosomaalseid aberratsioone kontsentratsioonides, mis samuti põhjustasid teatavat tsütotoksilisust.
Iloperidooni metaboliit P95 oli Ames'i testis, V79 kromosoomaberratsiooni testis ja hiire in vivo luuüdi mikrotuuma testis negatiivne.
Viljakuse langus: Uuringus, milles raviti nii isaseid kui ka emaseid rotte, vähendas iloperidoon viljakust annuses 12 ja 36 mg / kg. Toimeta doos oli 4 mg / kg, mis on 1,6-kordne MRHD-st 24 mg päevas mg / m2 alusel.
ülaosa
Kliinilised uuringud
FANAPTi efektiivsust skisofreenia ravis toetasid 2 platseebot ja aktiivselt kontrollitud lühiajalised (4 ja 6 nädalat) uuringud ja üks pikaajaline platseebokontrollitud randomiseeritud uuring taganemisprotsess. Kõikides uuringutes osalesid patsiendid, kes vastasid skisofreenia DSM-III / IV kriteeriumidele.
Nendes uuringutes kasutati psühhiaatriliste tunnuste ja sümptomite hindamiseks kolme instrumenti. Positiivse ja negatiivse sündroomi skaala (PANSS) ja lühike psühhiaatrilise hinnangu skaala (BPRS) on mõlemad mitmekaupa hõlmatud varud.
üldist psühhopatoloogiat, mida tavaliselt kasutatakse skisofreenia korral uimastiravi mõju hindamiseks. Kliinilise globaalse jäljendi (CGI) hinnang kajastab skisofreenia ilmingutega põhjalikult kursis oleva vaatleja muljet patsiendi üldise kliinilise seisundi kohta.
6-nädalane, platseebokontrollitud uuring (n = 706) hõlmas 2 paindlikku FANAPT-i annusevahemikku (12-16 mg / päevas või 20-24 mg / päevas), võrreldes platseebo ja aktiivse kontrolliga (risperidoon). 12-16 mg / päevas rühmas oli FANAPT tiitrimiskava 1 mg kaks korda päevas 1. ja 2. päeval, 2 mg kaks korda päevas 3. ja 4. päeval, 4 mg kaks korda päevas 5. ja 6. päeval ning 6 mg kaks korda päevas. iga päev 7. päeval. 20–24 mg / päevas rühmas oli FANAPT tiitrimiskava 1 mg kaks korda päevas 1. päeval, 2 mg kaks korda päevas 2. päeval, 3. päeval 4 mg kaks korda päevas, 4. ja 5. päeval 6 mg kaks korda päevas, 6. päeval 8 mg kaks korda päevas ja 7. päeval 10 mg kaks korda päevas. Esmane tulemusnäitaja oli BPRSi üldskoori muutus ravi alguses (42. päev) võrreldes algtasemega. Nii FANAPTi annused vahemikus 12–16 mg päevas ja 20–24 mg päevas olid BPRS-i üldskoori osas platseebost paremad. Aktiivse kontrolli psühhoosivastane ravim näis selles uuringus esimese 2 jooksul olevat FANAPT-ist parem nädalaid, mida võib osaliselt selgitada kiirema tiitrimisega, mis selleks oli võimalik ravim. Selles uuringus osalenud patsientidel, kes jätkasid ravi vähemalt 2 nädalat, näis iloperidooni efektiivsus aktiivse kontrolliga võrreldav.
4-nädalases platseebokontrollitud uuringus (n = 604) osales üks fANAPT-i fikseeritud annus (24 mg / päevas), võrreldes platseebo ja aktiivse kontrolliga (ziprasidoon). Selle uuringu tiitrimiskava oli sarnane 6-nädalase uuringu tiitrimiskavaga. See uuring hõlmas FANAPT tiitrimist, alustades 1 mg kaks korda päevas 1. päeval ja suurendades 2, 4, 6, 8, 10 ja 12 mg-ni kaks korda päevas 2., 3., 4., 5., 6. ja 7. päeval. Esmane tulemusnäitaja oli PANSS-i üldskoori muutus ravi alguses (28. päev) võrreldes algtasemega. FANAPTi annus 24 mg päevas oli PANSS-i üldskoori osas platseebost parem. FANAPT näis olevat sama efektiivne kui aktiivne kontrollravim, mis vajas ka aeglast tiitrimist sihtannuseni.
Pikemaajalises uuringus osalesid kliiniliselt stabiilsed täiskasvanud ambulatoorsed patsiendid (n = 303), kes vastavad skisofreenia DSM-IV kriteeriumidele ja kes püsisid stabiilsena pärast 12-nädalast ravi avatud ravi FANAPT paindlike annustega (8 mg päevas - 24 mg päevas, manustatuna kaks korda päevas) randomiseeriti platseeboks või jätkati nende praegune FANAPT'i annus (8 mg päevas - 24 mg päevas, manustatuna kaks korda päevas), võimaliku retsidiivi jälgimiseks topeltpimeda retsidiivi ajal ennetamise etapp. Stabiliseerumine avatud faasis määratleti FANAPTi kindla annuse kasutamisel, mis ei muutunud efektiivsuse tõttu 4 nädala jooksul enne randomiseerimist. mille CGI raskusaste on ≤4 ja PANSSi üldskoor ≤70, skoor ≤4 kõigil järgnevatel PANSS-i üksustel (P1-pettekujutised, P2-kontseptuaalne lagunemine, P3-hallutsinatiivne käitumine, P6-kahtlus / tagakiusamine, P7-vaenulikkus või G8-koostööetus) ning haiglaravi ega ravitava hoolduse taseme tõus ägenemised. Topeltpimeda retsidiivi ennetamise etapis defineeriti retsidiiv või eelseisv retsidiiv ükskõik millise nähtusena järgmine: haiglaravi skisofreenia süvenemise tõttu, PANSSi üldskoori suurendamine (süvenemine) ≥30%, CGI-
Paranemise skoor ≥6, patsiendil oli enesetapu-, tapmis- või agressiivset käitumist või vajadus mõne muu antipsühhootilise ravimi järele.

Vaheanalüüsi põhjal otsustas sõltumatu andmete seirekomisjon uuringu efektiivsuse tõendite tõttu varakult katkestada. Vaheanalüüsi tulemuste põhjal, mida kinnitasid lõplik analüüsi andmekogu, said patsiendid, keda raviti FANAPT koges statistiliselt olulist pikemat aega ägenemiseni või eelseisva ägenemiseni kui patsiendid, kes said platseebo. Joonisel 1 on esitatud retsidiivide või eelseisva relapsiga patsientide hinnanguline kumulatiivne osakaal lõplike andmete põhjal.
ülaosa
Kuidas komplekteeritud / ladustamine ja käitlemine
FANAPT tahvelarvutid on valged, ümmargused ja tähistatud logoga, mille ühele küljele on pressitud tableti tugevus „1”, „2”, „4”, „6”, „8“, „10“ või „12“, teisele küljele on pressitud. külg. Tahvelarvutid on saadaval järgmiste tugevuste ja konfiguratsioonidega:

Ladustamine
Hoidke FANAPT tablette kontrollitud toatemperatuuril 25 ° C (77 ° F); ekskursioonid on lubatud temperatuurini 15 ° C kuni 30 ° C (59 ° kuni 86 ° F). [Vaadake USP kontrollitud ruumi temperatuuri]. Kaitske FANAPT tablette valguse ja niiskuse eest.
PATSIENDI NÕUSTAMISE TEAVE
Arstidel soovitatakse arutada järgmisi küsimusi patsientidega, kellele nad määravad FANAPTi:
QT intervalli pikendamine
Patsientidel tuleb soovitada pöörduda viivitamatult arsti poole, kui nad tunnevad nõrkust, teadvuse kaotust või südamepekslemist. Patsientidele tuleb soovitada, et nad ei kasutaks FANAPT'i koos teiste ravimitega, mis põhjustavad QT-intervalli pikenemist. Patsientidel tuleb öelda arstidele, et nad võtaksid FANAPTi enne uue ravimi kasutamist.
Pahaloomuline neuroleptiline sündroom
Patsiente ja hooldajaid tuleks nõustada, et mõnikord viidatakse potentsiaalselt surmaga lõppevale sümptomite kompleksile kui NMS-i on teatatud seoses antipsühhootiliste ravimite, sealhulgas FANAPT-i manustamisega. NMS-i sümptomite hulka kuuluvad hüperpüreksia, lihasjäikus, muutunud vaimne seisund ja autonoomse seisundi tunnused.
ebastabiilsus (ebaregulaarne pulss või vererõhk, tahhükardia, diaforees ja südame rütmihäired).
Ainevahetuse muutused
Patsiendid peaksid olema teadlikud hüperglükeemia (kõrge veresuhkur) ja suhkruhaiguse sümptomitest. Patsiendid, kellel on diagnoositud diabeet, need, kellel on diabeedi riskifaktorid, või need, kellel see välja areneb Ravi ajal esinevate sümptomite korral tuleb veresuhkru taset jälgida nii ravi alguses kui ka perioodiliselt ravi. Patsientidele tuleb öelda, et FANAPT-ravi ajal on kehakaal tõusnud. Soovitatav on kaalu kliiniline jälgimine.
Ortostaatiline hüpotensioon
Patsiente tuleb teavitada ortostaatilise hüpotensiooni tekkeriskist, eriti ravi alustamise, ravi taasalustamise või annuse suurendamise ajal.
Häired kognitiivses ja motoorses töös
Kuna FANAPT võib kahjustada otsustusvõimet, mõtlemist või motoorseid oskusi, tuleb patsiente hoiatada käitada ohtlikke masinaid, sealhulgas autosid, kuni nad on piisavalt kindlad, et FANAPT-ravi neid ei mõjuta ebasoodsalt.
Rasedus
Teatage patsientidele, et Fanapt'i kasutamine kolmandal trimestril võib vastsündinutel põhjustada ekstrapüramidaalseid ja / või ärajätunähtusid. Soovitage patsientidel teatada oma tervishoiuteenuse osutajale teadaolevast või arvatavast rasedusest.
Raseduse register
Teatage patsientidele, et raseduse ajal on olemas raseduse kokkupuute register, mis jälgib FANAPT-iga kokkupuutuvate naiste raseduse tulemusi
Imetamine
Soovitage FANAPT-ravi ajal naistel mitte imetada.
Samaaegsed ravimid
Patsientidel tuleb soovitada oma arsti informeerida, kui nad võtavad või kavatsevad võtta retsepti- või käsimüügiravimeid, kuna nende koostoime on tõenäoline.
Alkohol
Patsientidele tuleb soovitada FANAPTi kasutamise ajal alkoholist hoiduda.
Kuumus ja dehüdratsioon
Patsiente tuleb ülekuumenemise ja dehüdratsiooni vältimiseks nõustada asjakohase ravi osas.
Jaotatud:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 USA
Vanda ja Fanapt® on Vanda Pharmaceuticals Inc. registreeritud kaubamärgid. Ameerika Ühendriikides ja teistes riikides.
tagasi üles
Fanapt (Iloperidoon) väljakirjutamisjuhend (PDF)
Selles monograafias sisalduv teave ei hõlma kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet ega kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
viimati uuendatud 07/13
tagasi: Psühhiaatriliste ravimite farmakoloogia koduleht


