Avandia diabeedi raviks
Kaubamärk: AVANDIA
Tavaline nimi: rosiglitasoonmaleaat
Sisu:
Näidustused ja kasutamine
Annustamine ja manustamine
Annustamisvormid ja tugevused
Vastunäidustused
Hoiatused ja ettevaatusabinõud
Kõrvaltoimed
Ravimite koostoimed
Kasutamine konkreetsetes populatsioonides
Üleannustamine
Kirjeldus
Kliiniline farmakoloogia
Mittekliiniline toksikoloogia
Kliinilised uuringud
Kuidas komplektis
Avandia, rosiglitasoonmaleaat, teave patsientide kohta (lihtsas inglise keeles)
HOIATUS
CONGESTIVNE SÜDAMISE RIKKUMINE JA MÜSOKARDIAINE ISEEMIA
- Tiasolidiindioonid, sealhulgas rosiglitasoon, põhjustavad või süvendavad mõnedel patsientidel südame paispuudulikkust [vt HOIATUSED JA HOIATUSED]. Pärast AVANDIA alustamist ja pärast annuse suurendamist jälgige patsiente hoolikalt südamepuudulikkuse nähtude ja sümptomite suhtes (sealhulgas liigne, kiire kaalutõus, hingeldus ja / või tursed). Nende sümptomite ilmnemisel tuleb südamepuudulikkust ravida vastavalt kehtivatele hooldusstandarditele. Lisaks tuleb kaaluda AVANDIA kasutamise lõpetamist või annuse vähendamist.
- AVANDIAt ei soovitata kasutada sümptomaatilise südamepuudulikkusega patsientidel. AVANDIA ravi alustamine NYHA III või IV klassi südamepuudulikkusega patsientidel on vastunäidustatud. [Vaata VASTUNÄIDUSTUSED ja HOIATUSED JA HOIATUSED.]
- 42 kliinilise uuringu metaanalüüs (keskmine kestus 6 kuud; Kokku 14 237 patsienti), kellest enamus võrdles AVANDIAt platseeboga, näitas AVANDIA seostatav müokardi isheemiliste sündmuste nagu stenokardia või müokardiinfarkti suurenenud riskiga. Kolm muud uuringut (keskmine kestus 41 kuud; 14 067 patsienti kokku), võrreldes AVANDIA mõne muu heakskiidetud suukaudse diabeedivastase aine või platseeboga, ei ole seda riski kinnitanud ega välistatud. Kättesaadavad andmed müokardi isheemia riski kohta on tervikuna ebaselged. [Vaata HOIATUSED JA HOIATUSED.]
ülaosa
Näidustused ja kasutamine
Monoteraapia ja kombineeritud teraapia
AVANDIA on näidustatud dieedi ja füüsilise koormuse lisandina, et parandada II tüüpi suhkurtõvega täiskasvanute glükeemilist kontrolli.
Olulised kasutamispiirangud
- Toimemehhanismi tõttu on AVANDIA aktiivne ainult endogeense insuliini juuresolekul. Seetõttu ei tohiks AVANDIAt kasutada I tüüpi suhkurtõvega patsientidel ega diabeetilise ketoatsidoosi raviks.
- AVANDIA ja insuliini samaaegne manustamine ei ole soovitatav.
- AVANDIAt ei soovitata kasutada koos nitraatidega.
ülaosa
Annustamine ja manustamine
Diabeedivastase ravi juhtimine peaks olema individuaalne. Kõik patsiendid peavad alustama AVANDIA kasutamist väikseimas soovitatud annuses. AVANDIA annuse edasise suurendamisega peab kaasnema vedelikupeetusega seotud kõrvaltoimete hoolikas jälgimine [vt Karbis hoiatus ja HOIATUSED JA ETTEVAATUSABINÕUD].
AVANDIAt võib manustada algannusega 4 mg kas ühekordse ööpäevase annusena või kaheks jagatud annuseks. Patsiendid, kelle ravivastus pärast 8–12 ravinädalat on ebapiisav, vastavalt plasma tühja kõhu glükoosisisalduse vähenemisele (FPG), võib annust suurendada 8 mg-ni ööpäevas monoteraapiana või kombinatsioonis metformiini, sulfonüüluurea või sulfonüüluureaga pluss metformiin. Glükeemiliste parameetrite vähenemist annuse ja raviskeemi järgi kirjeldatakse kliinilistes uuringutes. AVANDIAt võib võtta koos toiduga või ilma.
AVANDIA ööpäevane koguannus ei tohi ületada 8 mg.
Monoteraapia
Tavaline AVANDIA algannus on 4 mg, manustatuna kas ühekordse annusena üks kord päevas või jagatud annusena kaks korda päevas. Kliinilistes uuringutes vähendas 4 mg kaks korda päevas manustatav raviskeem kõige rohkem FPG ja hemoglobiini A1c (HbA1c) taset.
Kombineerimine sulfonüüluurea või metformiiniga
Kui AVANDIA lisatakse olemasolevale ravile, võib toimeaine (te) praegust annust jätkata AVANDIA-ravi alustamisel.
Sulfonüüluurea: Kombineerituna sulfonüüluureaga on AVANDIA tavaline algannus 4 mg, manustatuna kas ühekordse annusena üks kord päevas või jagatud annusena kaks korda päevas. Kui patsiendid teatavad hüpoglükeemiast, tuleb sulfonüüluurea annust vähendada.
Metformiin: Tavaline AVANDIA algannus koos metformiiniga on 4 mg, manustatuna kas ühekordse annusena üks kord päevas või jagatud annusena kaks korda päevas. On ebatõenäoline, et metformiini annust tuleb hüpoglükeemia tõttu korrigeerida AVANDIA-ravi ajal.
Kombinatsioon sulfonüüluurea pluss metformiiniga
Tavaline AVANDIA algannus koos sulfonüüluurea ja metformiiniga on 4 mg, manustatuna kas ühekordse annusena üks kord päevas või jagatud annusena kaks korda päevas. Kui patsiendid teatavad hüpoglükeemiast, tuleb sulfonüüluurea annust vähendada.
Patsientide eripopulatsioonid
Neerukahjustus: Annuse kohandamine ei ole vajalik, kui AVANDIAt kasutatakse neerukahjustusega patsientide monoteraapiana. Kuna metformiin on sellistel patsientidel vastunäidustatud, on metformiini ja AVANDIA samaaegne manustamine vastunäidustatud ka neerukahjustusega patsientidele.
Maksakahjustus: Enne AVANDIA-ravi alustamist tuleb mõõta maksaensüüme. AVANDIA-ravi ei tohiks alustada, kui patsiendil on kliinilisi tõendeid aktiivsuse kohta maksahaigus või suurenenud seerumi transaminaaside sisaldus (ALAT> 2,5x normi ülempiir aasta alguses teraapia). Pärast AVANDIA ravi alustamist tuleb maksaensüüme perioodiliselt jälgida vastavalt tervishoiutöötaja kliinilisele hinnangule. [Vaata HOIATUSED JA ETTEVAATUSABINÕUD ja KLIINILINE FARMAKOLOOGIA.]
Pediaatriline: Andmed ei ole AVANDIA pediaatriliseks kasutamiseks soovitatavad [vt KASUTAMINE ERINÕUDES].
ülaosa
Ravimvormid ja tugevused
Viiekohaline õhukese polümeerikattega TILTAB tablett sisaldab rosüglitasooni maleaadina järgmiselt:
- 2 mg - roosa, ühele küljele pressitud SB ja teisele küljele
- 4 mg - oranž, ühele küljele pressitud SB ja teisele 4
- 8 mg - punakaspruun, ühele küljele on pressitud SB ja teisele 8
ülaosa
Vastunäidustused
AVANDIA ravi alustamine patsientidel, kellel on väljakujunenud New York Heart Association (NYHA) III või IV klassi südamepuudulikkus, on vastunäidustatud. BOXED HOIATUS].
ülaosa
Hoiatused ja ettevaatusabinõud
Südamepuudulikkus
Nagu teisedki tiasolidiindioonid, võib AVANDIA põhjustada üksi või koos teiste diabeedivastaste ravimitega vedelikupeetust, mis võib süvendada või põhjustada südamepuudulikkust. Patsiente tuleb jälgida südamepuudulikkuse nähtude ja sümptomite osas. Nende sümptomite ilmnemisel tuleb südamepuudulikkust ravida vastavalt kehtivatele hooldusstandarditele. Lisaks tuleb kaaluda rosiglitasooni kasutamise lõpetamist või annuse vähendamist [vt BOXED HOIATUS].
AVANDIA-ravi saanud kongestiivse südamepuudulikkusega (CHF) NYHA I ja II klassi patsientidel on suurenenud kardiovaskulaarsete sündmuste risk. Viidi läbi 52-nädalane topeltpime platseebokontrolliga ehhokardiograafiline uuring 224 II tüüpi patsiendiga suhkurtõbi ja NYHA I või II klassi CHF (väljutusfraktsioon â) ¤ 45%) taustal antidiabeetiline ja CHF teraapia. Sõltumatu komisjon viis vedelikuga seotud sündmuste (sh kongestiivne südamepuudulikkus) ja kardiovaskulaarsed haiglaravi vastavalt eelnevalt määratletud kriteeriumidele (kohtuotsus). Eraldi otsusest teatasid uurijad muudest kardiovaskulaarsetest kõrvaltoimetest. Ehkki väljutusfraktsioonide muutuse erinevusi ravi osas erinevusi ei täheldatud, on seda rohkem pärast AVANDIA-raviga võrreldes platseeboga täheldati kardiovaskulaarseid kõrvaltoimeid 52-nädalane uuring. (Vaata tabelit 1.)
Tabel 1. Südame paisunud südamepuudulikkusega (I ja II klassi NYHA klass) patsiendid, kellel on ravitud AVANDIA või platseeboga (lisaks diabeediravi taustal kasutatavale diabeediravile ja südamehaiguste ravile).
| Üritused | AVANDIA N = 110 n (%) |
Platseebo N = 114 n (%) |
| Otsustatud | ||
| Kardiovaskulaarsed surmajuhtumid | 5 (5%) | 4 (4%) |
| CHF süvenemine | 7 (6%) | 4 (4%) |
| - üleöö haiglaravil | 5 (5%) | 4 (4%) |
| - ilma üleöö haiglaravita | 2 (2%) | 0 (0%) |
| Uus või süvenev turse | 28 (25%) | 10 (9%) |
| Uus või halvenev hingeldus | 29 (26%) | 19 (17%) |
| CHF-ravi suurenemine | 36 (33%) | 20 (18%) |
| Kardiovaskulaarne haiglaravi * | 21 (19%) | 15 (13%) |
| Uurija teatatud, kohtuotsuseta | ||
| Isheemilised kõrvaltoimed | 10 (9%) | 5 (4%) |
| - müokardiinfarkt | 5 (5%) | 2 (2%) |
| - Stenokardia | 6 (5%) | 3 (3%) |
| * Hõlmab haiglaravi mis tahes kardiovaskulaarsetel põhjustel. |
AVANDIA ravi alustamine NYHA III või IV klassi südamepuudulikkusega patsientidel on vastunäidustatud. AVANDIAt ei soovitata kasutada sümptomaatilise südamepuudulikkusega patsientidel. [Vaata BOXED HOIATUS.]
Akuutse koronaarsündroomi all kannatavaid patsiente ei ole kontrollitud kliinilistes uuringutes uuritud. Pidades silmas südamepuudulikkuse tekkimise potentsiaali ägeda koronaarhaigusega patsientidel, ei alusta AVANDIA ravi alustamist soovitatav patsientidele, kellel on äge koronaarsündmus, ja AVANDIA tuleb katkestada selle ägeda faasi ajal peetakse.
NYHA III ja IV klassi südameseisundiga (CHF-iga või ilma) patsiente ei ole kontrollitud kliinilistes uuringutes uuritud. AVANDIAt ei soovitata kasutada NYHA III ja IV klassi südameseisundiga patsientidel.
Müokardi isheemia
Müokardi isheemia meta-analüüs 42 kliinilise uuringu rühmas
Metaanalüüs viidi läbi tagasiulatuvalt, et hinnata kardiovaskulaarseid kõrvalnähte 42 topeltpimedas randomiseeritud kontrollitud kliinilises uuringus (keskmine kestus 6 kuud).1
Need uuringud viidi läbi eesmärgiga hinnata glükoosisisaldust langetavat efektiivsust II tüüpi diabeedi korral ning uuringutes ei olnud kardiovaskulaarsete sündmuste perspektiivselt kavandatud lahendamist. Mõned uuringud olid platseebo-kontrollitud ja mõnes kasutati kontrollina aktiivseid suukaudseid diabeedivastaseid ravimeid. Platseebokontrollitud uuringud hõlmasid monoteraapia uuringuid (monoteraapia AVANDIAga võrreldes platseebo monoteraapiaga) ja lisauuringuid (AVANDIA või platseebo, lisatud sulfonüüluurea, metformiin või insuliin). Aktiivse kontrolli uuringud hõlmasid monoteraapia uuringuid (monoteraapia AVANDIAga, võrreldes sulfonüüluurea või metformiiniga) monoteraapia) ja täiendavad uuringud (AVANDIA pluss sulfonüüluurea või AVANDIA pluss metformiin, versus sulfonüüluurea pluss metformiin). Kokku kaasati 14 237 patsienti (8 604 AVANDIAt sisaldavatesse ravigruppidesse, 5633 in) võrdlusrühmad), AVANDIA-ga kokkupuutel 4 143 patsiendiaastat ja 2 675 patsiendiaastal kokkupuudet AVANDIA-ga komparaator. Müokardi isheemiliste sündmuste hulka kuulusid stenokardia, stenokardia süvenemine, ebastabiilne stenokardia, südameseiskus, valu rinnus, pärgarter arterite oklusioon, hingeldus, müokardiinfarkt, pärgarteri tromboos, müokardi isheemia, pärgarteritõbi ja pärgarter häire. Selles analüüsis suurenes müokardi isheemia risk AVANDIA-ga võrreldes võrdlusravimitega täheldati (2% AVANDIA versus 1,5% võrdlejaid, koefitsiendisuhe 1,4, 95% usaldusvahemik [CI] 1,1, 1.8). Platseebokontrolliga uuringutes täheldati müokardi isheemiliste sündmuste suurenenud riski, kuid mitte aktiivse kontrolliga uuringutes. (Vt joonis 1.)
Müokardi isheemiliste sündmuste suurenenud riski täheldati uuringutes, kuhu lisati AVANDIA insuliinile (2,8% AVANDIA korral pluss insuliin versus 1,4% platseebo pluss insuliin, [VÕI 2,1, 95% CI 0,9, 5.1]). See suurenenud risk peegeldab ravigruppide erinevust 3 juhtu 100 patsiendiaasta kohta (95% CI -0,1, 6,3). [Vaata HOIATUSED JA HOIATUSED.]
Joonis 1. Müokardi isheemiliste sündmuste koefitsient koefitsientide vahel (95% usaldusvahemik) 42 kliinilise uuringu metaanalüüsis
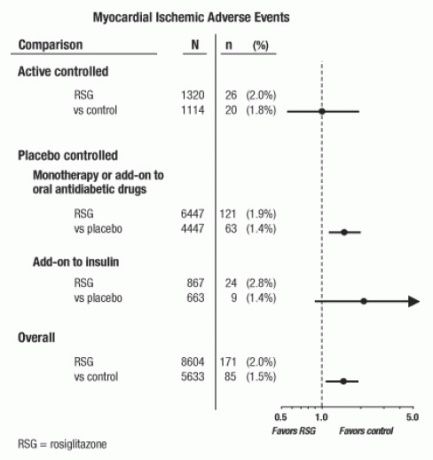
Müokardi isheemia suurenenud riski täheldati ka AVANDIA-ravi ja taustnitraadiga ravi saanud patsientidel. AVANDIA (N = 361) versus kontroll (N = 244) nitraatide kasutajatel oli koefitsientide suhe 2,9 (95% CI 1,4, 5.9), samas kui nitraatideta kasutajate (kokku umbes 14 000 patsienti) korral oli koefitsientide suhe 1,3 (95% CI 0,9, 1.7). See suurenenud risk kujutab 12 müokardi isheemilise sündmuse erinevust 100 patsiendiaasta kohta (95% CI 3,3, 21,4). Enamikul nitraatide kasutajatel oli südamehaigus. Teadaoleva südame isheemiatõvega patsientide seas, kes ei saanud ravi nitraadiga, AVANDIAga võrreldes müokardi isheemiliste sündmuste suurenenud riski võrreldes võrdlusravimiga ei tõestatud.
Müokardi isheemilised sündmused AVANDIA pikaajalistes perspektiivsetes randomiseeritud kontrollitud uuringutes
Kolme suurema AVANDIA pikaajalise, prospektiivse, randomiseeritud ja kontrollitud kliinilise uuringu andmeid hinnati meta-analüüsist eraldi. Need 3 uuringut hõlmavad kokku 14 067 patsienti (ravirühmad, mis sisaldavad AVANDIA N = 6 311, võrdlusravim) rühmad N = 7756), AVANDIA puhul patsiendi aasta kokkupuude 21 803 patsiendiaastat ja 25998 patsiendiaastat AVANDIA korral komparaator. Jälgimise kestus ületas igas uuringus 3 aastat. ADOPT (Diabeedi tulemuste progresseerumise uuring) oli 4- kuni 6-aastane randomiseeritud aktiivse kontrolliga uuring hiljuti diagnoositud II tüüpi diabeediga patsientidel, kes ei olnud varem ravimiravi teinud.
See oli tõhususe ja üldise ohutuse uuring, mille eesmärk oli uurida ravimi vastupidavust
AVANDIA monoteraapiana (N = 1,456) glükeemilise tõrje korral II tüüpi diabeedi korral koos sulfonüüluurea monoteraapia (N = 1 441) ja metformiiniga monoteraapia (N = 1,454) võrdlusravimitega. DREAM (diabeedi vähendamise hindamine koos Rosiglitasooni ja Ramipril Ravimitega, avaldatud aruanne2) oli 3.-3. 5-aastane randomiseeritud, platseebokontrolliga uuring kahjustatud glükoositaluvuse ja / või tühja kõhuga patsientidel glükoos. Sellel oli 2x2 faktoriaalkujundus, mille eesmärk oli hinnata AVANDIA ja eraldi ramipriili (angiotensiini konverteeriva ensüümi inhibiitori [ACEI]) toimet diabeedi ilmsikstulekul. DREAM-is osales 2635 patsienti AVANDIAt sisaldavates ravigruppides ja 2634 patsiente ravigruppides, mis ei sisaldanud AVANDIA.Vahetulemused on avaldatud 3 RECORDi (Rosiglitasoon, hinnatakse südamehaiguste ja glükeemia regulatsiooni osas Diabeet), käimasolev avatud 6-aastane kardiovaskulaarsete tulemuste uuring II tüüpi diabeediga patsientidega, kelle keskmine ravi kestus 3,75 aastat. RECORD hõlmab patsiente, kellel metformiini või sulfonüüluurea monoteraapia on ebaõnnestunud; need, kellel metformiin ebaõnnestus, randomiseeritakse juhuslikult saama täiendavat AVANDIA või täiendavat sulfonüüluurea, ja need, kellel sulfonüüluurea ebaõnnestus, randomiseeritakse saama kas lisandmooduli AVANDIA või lisandmooduli metformiin. RECORD-i abil saab AVANDIA-d täiendavalt 2220 patsienti ja 2227 patsienti osaleb ühes lisaprogrammis, mis ei sisalda AVANDIA-d.
Nende 3 uuringu jaoks viidi analüüs läbi peamiste kardiovaskulaarsete kahjulike sündmuste (müokardiinfarkt, kardiovaskulaarne surm või insult) segu, mida edaspidi nimetatakse MACE-ks. See tulemusnäitaja erines müokardi isheemiliste sündmuste metaanalüüsi laiast tulemusnäitajast, millest enam kui pooled olid stenokardia. Müokardiinfarkt hõlmas otsustatud surmaga lõppenud ja mittefataalset müokardiinfarkti ning äkksurma. Nagu on näidatud joonisel 2, ei olnud kolme näitaja (MACE, MI ja kogu suremus) tulemused AVANDIA ja võrdlusandmete vahel statistiliselt olulisel määral erinevad.
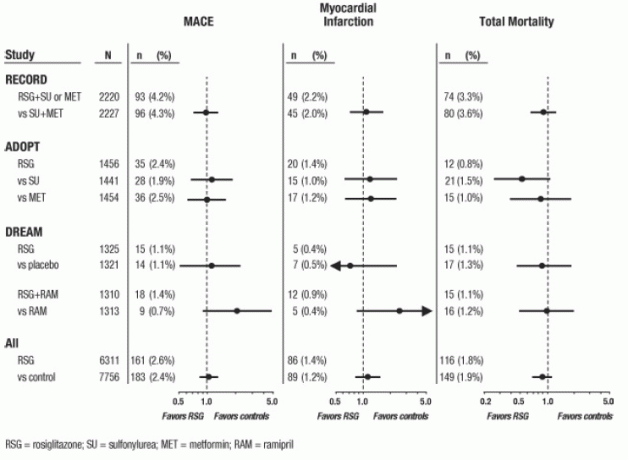
DREAM-uuringu esialgsetes analüüsides oli kardiovaskulaarsete sündmuste esinemissagedus suurem nende isikute seas, kes said AVANDIAt koos ramipriiliga kui ainult ramipriili saanud patsientide hulgas, nagu on näidatud lõigus Joonis 2. Seda järeldust ei kinnitatud ADOPT ja RECORD (aktiivse kontrolliga uuringutes diabeediga patsientidega), kus vastavalt 30% ja 40% patsientidest teatasid AKE inhibiitorite kasutamisest uuringu alguses.
Kättesaadavad andmed müokardi isheemia riski kohta on tervikuna ebaselged. Lõplikud järeldused selle riski kohta ootavad enne korralikult läbi mõeldud kardiovaskulaarsete tulemuste uuringu lõpuleviimist.
AVANDIA või mõne muu suukaudse diabeedivastase ravimiga ei ole kliinilisi uuringuid, mis tõestaksid veenvaid tõendeid makrovaskulaarse riski vähenemise kohta.
Südame paispuudulikkus ja müokardi isheemia AVANDIA samaaegsel kasutamisel insuliiniga
Uuringutes, milles AVANDIAt lisati insuliinile, suurendas AVANDIA südame paispuudulikkuse ja müokardi isheemia riski. (Vt tabel 2.)
AVANDIA ja insuliini samaaegne manustamine ei ole soovitatav. [Vaata Näidustused ja kasutamine ja HOIATUSED JA HOIATUSED.]
Viies, 26-nädalases, kontrollitud, randomiseeritud, topeltpimedas uuringus, mis kaasati meta-analüüsi [vt HOIATUSED JA HOIATUSED], II tüüpi suhkurtõvega patsiendid randomiseeriti AVANDIA ja insuliini (N = 867) või insuliini (N = 663) samaaegseks manustamiseks. Nendes viies uuringus lisati AVANDIA insuliinile. Need uuringud hõlmasid pikaajalise suhkurtõvega patsiente (mediaankestus 12 aastat) ja olemasolevate patsientide suurt levikut meditsiinilised seisundid, sealhulgas perifeerne neuropaatia, retinopaatia, südame isheemiatõbi, veresoonkonna haigused ja südame paisumine läbikukkumine. Tekkiva kongestiivse südamepuudulikkusega patsientide koguarv oli AVANDIA pluss 21 (2,4%) ja 7 (1,1%) vastavalt insuliini ja insuliini rühmas. Tekkiva müokardi isheemiaga patsientide koguarv oli AVANDIA ja insuliini rühmas vastavalt 24 (2,8%) ja 9 (1,4%) (VÕI 2,1 [95% CI 0,9, 5,1]). Kuigi südame paispuudulikkuse ja müokardi isheemia esinemissagedus oli uuritud madal elanikkonna hulgas, oli AVANDIA ja insuliin. Neid kardiovaskulaarseid häireid täheldati AVANDIA nii 4 mg kui ka 8 mg ööpäevaste annuste kasutamisel. (Vt tabel 2.)
Tabel 2. Kardiovaskulaarsete sündmuste esinemine viies kontrollitud uuringus AVANDIA lisamisele kinnitatud insuliinravile
| Üritus * | AVANDIA + insuliin (n = 867) n (%) |
Insuliin (n = 663) n (%) |
| Südamepuudulikkuse | 21 (2.4%) | 7 (1.1%) |
| Müokardi isheemia | 24 (2.8%) | 9 (1.4%) |
| Kombineeritud südame-veresoonkonna surm, müokardiinfarkt või insult | 10 (1.2%) | 5 (0.8%) |
| Stroke | 5 (0.6%) | 4 (0.6%) |
| Müokardi infarkt | 4 (0.5%) | 1 (0.2%) |
| Kardiovaskulaarne surm | 4 (0.5%) | 1 (0.2%) |
| Kõik surmad | 6 (0.7%) | 1 (0.2%) |
| * Üritused pole eksklusiivsed; see tähendab, et patsient, kellel on müokardiinfarkti tõttu südame-veresoonkonna surm, arvatakse nelja kategooriasse (müokardi isheemia; kardiovaskulaarne surm, müokardiinfarkt või insult; müokardi infarkt; südame-veresoonkonna surm). |
Kuuendas, 24-nädalases kontrollitud, randomiseeritud, topeltpimedas AVANDIA ja insuliini samaaegse manustamise katses lisati AVANDAMET®-i insuliini. (rosiglitasoonmaleaat ja metformiin HCl) (n = 161) ja võrreldes insuliini ja platseeboga (n = 158), pärast ühekordset pimedat 8-nädalast sisse AVANDAMET. Farmakoloogilist ravi vajavad tursed ja kongestiivse südamepuudulikkusega patsiendid jäeti uuringu alguses ja eelperioodil välja.
AVANDAMET'i ja insuliini saanud rühmas esines üks müokardi isheemiline sündmus ja üks äkksurm. Insuliinigrupis ei täheldatud müokardi isheemiat ega kummaski ravirühmas kongestiivset südamepuudulikkust.
Tursed
AVANDIAt tuleb ödeemiga patsientidel kasutada ettevaatusega. Kliinilises uuringus tervete vabatahtlikega, kes said 8 nädala jooksul 8 mg AVANDIAt üks kord päevas 8 nädala jooksul, ilmnes keskmise plasmamahu statistiliselt oluline suurenemine võrreldes platseeboga.
Kuna tiasolidiindioonid, sealhulgas rosiglitasoon, võivad põhjustada vedelikupeetust, mis võib põhjustades kongestiivset südamepuudulikkust, tuleb AVANDIAt kasutada südamega seotud riskide korral ettevaatusega läbikukkumine. Patsiente tuleb jälgida südamepuudulikkuse nähtude ja sümptomite osas [vt BOXED HOIATUS, HOIATUSED JA HOIATUSED ].
II tüüpi diabeediga patsientide kontrollitud kliinilistes uuringutes esines AVANDIAga ravitud patsientidel kerget kuni mõõdukat turset, mis võib olla sõltuv annusest. Pideva ödeemiga patsientidel võib tõenäolisemalt esineda tursega seotud kõrvaltoimeid, kui alustada kombineeritud raviga insuliini ja AVANDIAga [vt KÕRVALTOIMED].
Kaalutõus
Annusega seotud kaalutõusu täheldati ainult AVANDIA ja teiste hüpoglükeemiliste ainete korral (tabel 3). Kaalutõusu mehhanism on ebaselge, kuid tõenäoliselt hõlmab see vedelikupeetuse ja rasva kogunemise kombinatsiooni.
Turustamisjärgses kogemuses on teatatud ebaharilikult kiirest kehakaalu tõusust, mis ületab kliinilistes uuringutes üldiselt täheldatud. Patsiente, kellel selline tõus suureneb, tuleb hinnata vedeliku kogunemise ja mahuga seotud sündmuste, näiteks liigse turse ja südame paispuudulikkuse suhtes [vt BOXED HOIATUS].
Tabel 3. Kehakaalu muutused (kg) võrreldes algtasemega lõpp-punktis kliiniliste uuringute ajal
| Monoteraapia | Kestus | Kontrollrühm | AVANDIA 4 mg Mediaan (25., 75 protsentiil) |
AVANDIA 8 mg Mediaan (25., 75 protsentiil) |
|
| Mediaan (25., 75 protsentiil) | |||||
| 26 nädalat | platseebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 nädalat | sulfonüüluurea | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Kombineeritud ravi | |||||
| Sulfonüüluurea | 24–26 nädalat | sulfonüüluurea | 0 (-1.0, 1.3) n = 1,155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformiin | 26 nädalat | metformiin | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insuliin | 26 nädalat | insuliin | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonüüluurea + metformiin | 26 nädalat | sulfonüüluurea + metformiin | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
4- kuni 6-aastase monoteraapia võrdlusuuringus (ADOPT) patsientidega, kellel diagnoositi hiljuti II tüüpi diabeet ja keda ei olnud varem ravitud diabeedivastaste ravimitega [vt Kliiniline uurings], keskmise kaalumuutuse (25%)th, 75th protsentiilid) algtasemest 4-aastaselt oli AVANDIA puhul 3,5 kg (0,0, 8,1), glüburiidi puhul 2,0 kg (-1,0, 4,8) ja metformiini korral -2,4 kg (-5,4, 0,5).
24-nädalases uuringus 10–17-aastaste lastega, keda raviti AVANDIA 4–8 mg ööpäevas, keskmine kehakaalu tõus 2,8 kg (25th, 75th protsentiilid: 0,0, 5,8).
Mõjud maksale
Enne AVANDIA-ravi alustamist tuleb kõigil patsientidel mõõta maksaensüüme ja seejärel perioodiliselt pärast tervishoiutöötaja kliinilist hinnangut. AVANDIA-ravi ei tohiks alustada patsientidel, kellel on maksaensüümide taseme tõus (ALAT> normi ülempiir 2,5x). Patsiendid, kellel oli algul kergelt kõrgenenud maksaensüümide sisaldus (ALAT tase ≥ 2,5 korda normi ülempiir) või AVANDIA-ravi ajal tuleb hinnata maksaensüümi põhjustajat kõrgendus. AVANDIA-ravi alustamisel või jätkamisel kerge maksaensüümide aktiivsuse tõusuga patsientidel tuleb toimida ettevaatusega ja hõlmama hoolikat kliinilist järelkontrolli, sealhulgas maksaensüümide jälgimist, et teha kindlaks, kas maksaensüümide aktiivsuse suurenemine laheneb või halvendada. Kui ALAND-i tase tõuseb AVANDIA-ravi saavatel patsientidel normi normi ülempiirist üle 3 korra, tuleb maksaensüümide taset kontrollida nii kiiresti kui võimalik. Kui ALAT tase püsib normi ülemisest piirist kolmekordne, tuleb AVANDIA-ravi katkestada.
Kui mõnel patsiendil tekivad maksafunktsiooni häirele viitavad sümptomid, mille hulka võivad kuuluda seletamatu iiveldus, oksendamine, kõhuvalu, väsimus, isutus ja / või tume uriin, tuleb kontrollida maksaensüüme. Patsiendi AVANDIA-ravi jätkamise üle otsustamiseks tuleks laborianalüüside tegemiseni lähtuda kliinilisest hinnangust. Kui ilmneb kollatõbi, tuleb ravimiravi katkestada. [Vaata KÕRVALTOIMED.]
Makulaarne tursed
Turustamise järgselt on mõnedes diabeediga patsientidel, kes võtsid AVANDIAt või mõnda muud tiasolidiindiooni, täheldatud kollatähni turset. Mõnedel patsientidel on nägemine hägustunud või nägemisteravus vähenenud, kuid mõnedel patsientidel on diagnoositud rutiinne oftalmoloogiline uuring. Enamikul patsientidest oli maakula turse diagnoosimise ajal perifeerne turse. Mõnel patsiendil paranes maakula turse pärast tiasolidiindiooni kasutamise katkestamist. Diabeedihaigetel peaks olema silmaarsti regulaarsed silmauuringud vastavalt Ameerika Diabeedi Assotsiatsiooni standarditele. Lisaks sellele tuleks diabeetik, kes teatab igasugusest visuaalsest sümptomist, viivitamatult silmaarsti vastuvõtule, sõltumata patsiendi kaasnevatest ravimitest või muudest füüsilistest avastustest. [Vaata KÕRVALTOIMED.]
Luumurrud
Hiljuti 4–6-aastases võrdlevas uuringus (ADOPT) glükeemilise kontrolli monoteraapiaga varem ravimata patsientidel kellel diagnoositi II tüüpi suhkurtõbi, täheldati luumurdude sagedasemat esinemist naissoost patsientidel AVANDIA. 4-6-aastase perioodi jooksul oli naistel luumurdude esinemissagedus AVANDIA puhul 9,3% (60/645), glüburiidi puhul 3,5% (21/605) ja metformiini korral 5,1% (30/590). Seda suurenenud esinemissagedust täheldati pärast esimest ravi aastat ja see püsis kogu uuringu vältel. Enamik AVANDIAt saanud naistel tekkisid luumurrud õlavarre, käe ja jala piirkonnas. Need luumurdude kohad erinevad neist, mida tavaliselt seostatakse menopausijärgse osteoporoosiga (nt puusa või lülisambaga). AVANDIAga ravitud meestel luumurdude suurenemist ei täheldatud. Ravi saavate patsientide, eriti naispatsientide hooldamisel tuleb arvestada luumurdude riskiga AVANDIA ning tähelepanu luude tervise hindamisele ja säilitamisele vastavalt kehtivatele standarditele hooldus.
Hematoloogilised mõjud
AVANDIAga ravitud täiskasvanud patsientidel esines keskmise hemoglobiini ja hematokriti langus annusest sõltuvalt [vt KÕRVALTOIMED]. Täheldatud muutused võivad olla seotud suurenenud plasmamahu suurenemisega AVANDIA-ravi ajal.
Diabeet ja veresuhkru kontroll
Patsientidel, kes saavad AVANDIAt koos teiste hüpoglükeemiliste ravimitega, võib olla oht hüpoglükeemia tekkeks ja võib olla vajalik samaaegse ravimi annuse vähendamine.
Terapeutilise ravivastuse jälgimiseks tuleks perioodiliselt mõõta tühja kõhu veresuhkru ja HbA1c sisaldust.
Ovulatsioon
Nagu ka teiste tiasolidiindioonide ravi AVANDIA-ga võib mõnedel menopausieelses eas anovulatoorsetel naistel põhjustada ovulatsiooni. Seetõttu võib neil patsientidel AVANDIA võtmise ajal olla suurem rasedusrisk [vt Kasutamine konkreetsetes populatsioonides]. Seetõttu tuleks menopausieelses eas naistel soovitada piisavat rasestumisvastast vahendit. Seda võimalikku mõju pole kliinilistes uuringutes spetsiaalselt uuritud; seetõttu ei ole selle esinemise sagedus teada.
Kuigi prekliinilistes uuringutes on täheldatud hormonaalset tasakaalustamatust [vt Mittekliiniline toksikoloogia], selle leiu kliiniline tähtsus pole teada. Menstruaaltsükli ootamatute häirete ilmnemisel tuleks üle vaadata AVANDIA-ravi jätkamise eelised.
ülaosa
Kõrvaltoimed
Kliiniliste uuringute kogemus
Täiskasvanud
Kliinilistes uuringutes on AVANDIAga ravitud umbes 9 900 II tüüpi diabeediga patsienti.
AVANDIA lühiajalised uuringud monoteraapiana ja kombinatsioonis teiste hüpoglükeemiliste ainetega
AVANDIA monoteraapiana lühiajalistes kliinilistes uuringutes teatatud kõrvaltoimete esinemissagedus ja tüübid on toodud tabelis 4.
Tabel 4. Kõrvaltoimed (~ 5% kõigis ravirühmades), mille on teatanud lühiajaliste * topeltpimedate kliiniliste uuringute patsiendid AVANDIA monoteraapiana
| Eelistatud tähtaeg | AVANDIA Monoteraapia N = 2,526 % |
Platseebo N = 601 % |
Metformiin N = 225 % |
Sulfonüüluuread N = 626 % |
| Ülemiste hingamisteede infektsioon | 9.9 | 8.7 | 8.9 | 7.3 |
| Vigastus | 7.6 | 4.3 | 7.6 | 6.1 |
| Peavalu | 5.9 | 5.0 | 8.9 | 5.4 |
| Seljavalu | 4.0 | 3.8 | 4.0 | 5.0 |
| Hüperglükeemia | 3.9 | 5.7 | 4.4 | 8.1 |
| Väsimus | 3.6 | 5.0 | 4.0 | 1.9 |
| Sinusiit | 3.2 | 4.5 | 5.3 | 3.0 |
| Kõhulahtisus | 2.3 | 3.3 | 15.6 | 3.0 |
| Hüpoglükeemia | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Lühiajalised uuringud jäid vahemikku 8 nädalat kuni 1 aasta. †Hõlmab patsiente, kes saavad glüburiidi (N = 514), gliklasiidi (N = 91) või glipisiidi (N = 21). |
Üldiselt on AVANDIA kasutamisel teatatud kõrvaltoimete tüübid, võtmata arvesse põhjuslikku seost kombinatsioonis sulfonüüluurea või metformiiniga olid sarnased monoteraapiaga AVANDIA.
Aneemia ja ödeemi juhtudest kiputi sagedamini teatama suuremate annuste kasutamisel ning need olid tavaliselt kerged kuni mõõdukad ja ei vajanud tavaliselt AVANDIA-ravi katkestamist.
Topeltpimedates uuringutes täheldati aneemiat 1,9% AVANDIA monoteraapiana saanud patsientidest, võrreldes 0,7% platseeboga, 0,6% sulfonüüluureate ja 2,2% metformiiniga. Aneemia esinemissagedus oli suurem patsientide puhul, keda raviti AVANDIA ja metformiiniga (7,1%) ja AVANDIA ja sulfonüüluurea pluss metformiin (6,7%) võrreldes monoteraapiaga AVANDIA või kombinatsioonis sulfonüüluureaga (2.3%). Metformiini kombineeritud kliinilistes uuringutes osalenud patsientide ravieelne madalam hemoglobiini / hematokriti sisaldus võis aidata kaasa nende uuringute aneemia kõrgemale esinemissagedusele [vt KÕRVALTOIMED].
Kliinilistes uuringutes esines turset 4,8% -l AVANDIA monoteraapiat saanud patsientidest, võrreldes 1,3% -ga platseebo, 1,0% -ga sulfonüüluureate ja 2,2% -ga metformiiniga. AVANDIA 8 mg sulfonüüluurea kombinatsioonides oli tursete esinemissagedus kõrgem (12,4%) kui teiste kombinatsioonide puhul, välja arvatud insuliin. Turse tekkis 14,7% -l AVANDIAt saanud patsientidest insuliinikombinatsiooni uuringutes, 5,4% -l ainult insuliini kasutamisest. Teatatud kongestiivse südamepuudulikkuse ilmnemisest või ägenemisest esines ainult 1% insuliini korral ja 2% (4 mg) ja 3% (8 mg) insuliini kasutamisel kombinatsioonis AVANDIAga [vt BOXED HOIATUS ja HOIATUSED JA HOIATUSED].
Kontrollitud kombineeritud ravi uuringutes sulfonüüluurea ravimitega teatati kergetest kuni mõõdukatest hüpoglükeemilistest sümptomitest, mis näivad olevat annusest sõltuvad. Vähesed patsiendid katkestati hüpoglükeemia tõttu (<1%) ja väheseid hüpoglükeemia episoode peeti rasketeks (<1%). Hüpoglükeemia oli fikseeritud annusega insuliinikombinatsiooni uuringutes kõige sagedamini teatatud kõrvaltoime. kuigi vähesed patsiendid loobusid hüpoglükeemia tõttu (4 patsiendil 408-st AVANDIA ja insuliin ning 1 patsiendil 203-st insuliini) üksi). Hüpoglükeemia esinemissagedus, mida kinnitas kapillaaride veresuhkru kontsentratsioon 50 μl / dl, oli 6% ainult insuliini korral ja 12% (4 mg) ja 14% (8 mg) insuliini puhul kombinatsioonis AVANDIAga. [Vaata HOIATUSED JA HOIATUSED.]
AVANDIA pikaajaline uuring monoteraapiana
4- kuni 6-aastases uuringus (ADOPT) võrreldi AVANDIA (n = 1 456), glüburiidi (n = 1 441) ja metformiini (n = 1 454) kasutamist järgmiselt: monoteraapia patsientidel, kellel diagnoositi hiljuti II tüüpi diabeet ja keda ei olnud varem ravitud diabeediraviga ravimid. Tabelis 5 on toodud kõrvaltoimed, arvestamata põhjuslikkust; määrasid väljendatakse 100 patsiendiaasta (PY) kokkupuute kohta, võttes arvesse uuringuravimitega kokkupuute erinevusi kolmes ravigrupis.
ADOPTi kasutamisel teati luumurdudest suuremal arvul AVANDIA-ravi saanud naistel (9,3%, 2,7 / 100 patsiendiaastad) võrreldes glüburiidi (3,5%, 1,3 / 100 patsiendiaastat) või metformiiniga (5,1%, 1,5 / 100) patsiendiaastad).
Enamik rosiglitasooni saanud naiste luumurdudest esines õlavarre, käe ja jala piirkonnas. [Vaata HOIATUSED JA HOIATUSED.] Meeste patsientide luumurdude täheldatud esinemissagedus oli kolmes ravirühmas sarnane.
Tabel 5. Teraapias esinevad kõrvaltoimed (â Events Events 5 sündmust 100 patsiendiaasta kohta [PY]) ükskõik millises ravirühmas, millest on AVANDIA 4–6-aastases kliinilises uuringus teatatud monoteraapiana (ADOPT)
| AVANDIA N = 1,456 PY = 4,954 |
Glüburiid N = 1 441 PY = 4 244 |
Metformiin N = 1,454 PY = 4 906 |
|
| Nasofarüngiit | 6.3 | 6.9 | 6.6 |
| Seljavalu | 5.1 | 4.9 | 5.3 |
| Liigesevalu | 5.0 | 4.8 | 4.2 |
| Hüpertensioon | 4.4 | 6.0 | 6.1 |
| Ülemiste hingamisteede infektsioon | 4.3 | 5.0 | 4.7 |
| Hüpoglükeemia | 2.9 | 13.0 | 3.4 |
| Kõhulahtisus | 2.5 | 3.2 | 6.8 |
Pediaatriline
Avandia ohutust on hinnatud II tüüpi diabeediga laste ühe aktiivse kontrollitud uuringu käigus, milles 99 patsienti raviti Avandiaga ja 101 metformiiniga. Avandia või metformiini põhjuslikku seost arvestamata olid kõige levinumad kõrvaltoimed (> 10%) peavalu (17% versus 14%), iiveldus (4% versus 11%), nasofarüngiit (3% versus 12%) ja kõhulahtisus (1% versus 13%). Selles uuringus teatati metformiini rühmas ühest diabeetilise ketoatsidoosi juhtumist. Lisaks oli rosiglitasooni rühmas 3 patsienti, kelle FPG oli> 300 mg / dl, 2+ ketoonuria ja kõrgenenud anioonide vahe.
Laboratoorsed kõrvalekalded
Hematoloogiline
Ravitud täiskasvanud patsientidel esines keskmise hemoglobiini ja hematokriti langus annusest sõltuvalt Avandiaga (üksikute uuringute keskmine langus hemoglobiinisisalduseni 1,0 g / dl ja 3,3%) hematokrit). Muutused ilmnesid peamiselt esimese 3 kuu jooksul pärast Avandia-ravi alustamist või pärast Avandia annuse suurendamist. Vähenemise aeg ja ulatus olid sarnased patsientidel, keda raviti Avandia ja teiste hüpoglükeemiliste ravimitega või monoteraapiana Avandiaga. Ravieelsed hemoglobiini ja hematokriti tasemed olid metformiiniga kombineeritud uuringutes patsientidel madalamad ja see võis aidata kaasa aneemia kõrgemale esinemissagedusele. Ühes lastega läbiviidud uuringus täheldati hemoglobiini ja hematokriti langust (keskmine langus vastavalt 0,29 g / dl ja 0,95%). Avandiaga ravitud lastel on täheldatud ka väikest hemoglobiini ja hematokriti langust. Samuti vähenes valgete vereliblede arv Avandiaga ravitud täiskasvanud patsientidel. Hematoloogiliste parameetrite langus võib olla seotud Avandia-raviga täheldatud plasmamahu suurenemisega.
Lipiidid
Pärast täiskasvanute ravi Avandiaga on täheldatud muutusi seerumi lipiidides [vt Kliiniline farmakoloogia ]. Lastel, keda raviti Avandiaga 24 nädala jooksul, teatati väikestest muutustest seerumi lipiidide parameetrites.
Seerumi transaminaaside tase
Heakskiidu eelsetes kliinilistes uuringutes 4598 Avandiaga ravitud patsiendil (3600 patsiendiaastat kokkupuutumisel) ja pikaajaliselt Kuueaastases uuringus 1 456 Avandiaga ravitud patsiendiga (kokkupuude 4 954 patsiendiaastaga) ei olnud mingeid tõendeid ravimite indutseerimise kohta hepatotoksilisus.
Heakskiidu eelsetes kontrollitud uuringutes oli 0,2% -l Avandiaga ravitud patsientidest ALAT tõus> 3x normi ülemisest piirist, võrreldes 0,2% -ga platseebo ja 0,5% -ga aktiivsete võrdlusravimite korral. Avandiaga ravitud patsientide ALAT tõus oli pöörduv. Hüperbilirubineemia leiti 0,3% -l Avandiaga ravitud patsientidest, 0,9% -l platseeboga ravitud patsientidest ja 1% -l aktiivsete võrdlusravimitega ravitud patsientidest. Heakskiidu eelsetes kliinilistes uuringutes ei esinenud maksapuudulikkusele viinud idiosünkraatiliste ravimireaktsioonide juhtumeid. [Vaata Hoiatused ja ettevaatusabinõud]
4–6-aastases ADOPT-uuringus osalesid patsiendid, keda raviti Avandiaga (kokkupuude 4 954 patsiendiaastaga), glüburiidiga (4 244 patsiendiaasta kokkupuudet) või metformiiniga (kokkupuude 4 906 patsiendiaastaga) monoteraapiana oli ALAT aktiivsuse suurenemise kiirus sama, mis ületas normi 3X normi ülempiiri (0,3 100 patsiendiaasta kohta) kokkupuude).
Turundusjärgne kogemus
Lisaks kliinilistest uuringutest teatatud kõrvaltoimetele on Avandia müügiloa saamise järgselt tuvastatud ka allpool kirjeldatud sündmused. Kuna neist juhtudest teatatakse teadmata suurusega elanikkonnast vabatahtlikult, pole nende esinemissagedust võimalik usaldusväärselt hinnata ega alati põhjuslikku seost uimasti kokkupuutega kindlaks teha.
Tiasolidiindioonravi saavatel patsientidel võivad tekkida tõsised kõrvaltoimed surmaga või ilma nendeta seoses mahu suurenemisega (nt südame paispuudulikkus, kopsuturse ja pleura efusioon) [vaata Karbis hoiatus ja Hoiatused ja ettevaatusabinõud].
Turustamisjärgselt on teatatud Avandia hepatiidi tekkest, maksaensüümide aktiivsuse taseme tõusust 3 või enam korda normaalne ülemine piir ja maksapuudulikkus surmaga lõppeva ja ilma selleta, ehkki põhjuslikku seost ei ole olnud asutatud.
Lööve, kihelus, urtikaaria, angioödeem, anafülaktilised reaktsioonid ja Stevens-Johnsoni sündroom on esinenud harva.
Samuti on saadud teateid diabeetilise makulaarse ödeemi ilmnemise või süvenemise kohta koos vähenenud nägemisteravusega [vt Hoiatused ja ettevaatusabinõud].
ülaosa
Ravimite koostoimed
CYP2C8 inhibiitorid ja indutseerijad
CYP2C8 inhibiitor (nt gemfibrosiil) võib suurendada rosiglitasooni AUC ja CYP2C8 indutseerija (nt rifampiin) võib vähendada rosiglitasooni AUC. Seetõttu, kui rosiglitasoonravi ajal alustatakse või lõpetatakse CYP2C8 inhibiitor või indutseerija, võib kliinilise ravivastuse põhjal olla vajalik suhkurtõve ravi muutmine. [Vaata KLIINILINE FARMAKOLOOGIA.]
ülaosa
Kasutamine konkreetsetes populatsioonides
Rasedus
C-kategooria rasedus
Kõigil rasedustel on sõltumata uimastiga kokkupuutest taustal sünnidefektide, kadumise või muude kahjulike tagajärgede oht. See taustarisk suureneb hüperglükeemiaga komplitseeritud raseduse korral ja hea metaboolse kontrolli korral võib see väheneda. Suhkurtõve või rasedusdiabeedi anamneesiga patsientide jaoks on oluline säilitada hea metaboolne kontroll enne rasestumist ja kogu raseduse ajal. Sellistel patsientidel on oluline hoolikalt jälgida glükoosisisaldust. Enamik eksperte soovitab raseduse ajal kasutada monoteraapiat insuliiniga, et säilitada vere glükoositase võimalikult normaalsel tasemel.
Andmed inimeste kohta: On teada, et rosiglitasoon läbib inimese platsenta ja on lootekoes kindlaksmääratav. Nende leidude kliiniline tähtsus pole teada. Rasedatel ei ole piisavalt ja hästi kontrollitud uuringuid. AVANDIAt ei tohi raseduse ajal kasutada.
Loomkatsed: Rottide varase raseduse ajal ei avaldanud rosiglitasoonravi implantatsioonile ega embrüole mõju, kuid ravi hilis raseduse ajal seostati loote surma ja kasvupeetusega nii rottidel kui küülikutel. Teratogeensust ei täheldatud annustes kuni 3 mg / kg rottidel ja 100 mg / kg küülikutel (vastavalt inimese maksimaalses soovitatavas ööpäevases annuses vastavalt 20 ja 75 korda inimese AUC). Rosiglitasoon põhjustas rottidel platsenta patoloogiat (3 mg / kg päevas). Rottide ravi imetamise ajal tiinuse ajal vähendas pesakonna suurust, vastsündinute elujõulisust ja sünnitusjärgset kasvu, kasvu aeglustumine oli pärast puberteeti pöörduv. Platsenta, embrüo / loote ja järglaste mõju osas oli toimeta annus rottidel 0,2 mg / kg / päevas ja küülikutel 15 mg / kg / päevas. Need toimeta toime tasemed on inimese maksimaalses soovitatavas ööpäevases annuses umbes 4 korda suuremad kui inimese AUC. Rosiglitasoon vähendas emaka implanteerimise ja elusate järglaste arvu, kui noorloomaseid emaseid rotte raviti 40-aastaselt mg / kg päevas alates 27. elupäevast kuni suguküpsuseni (maksimaalselt soovitatav ööpäevane inimese AUC on 68 korda suurem) annus). Toimeta efekt oli 2 mg / kg päevas (maksimaalse soovitatava ööpäevase annuse korral inimese AUC umbes 4-kordne). See ei mõjutanud sünnieelset ega sünnijärgset ellujäämist ega kasvu.
Tööjõud ja sünnitus
Rosiglitasooni mõju sünnitusele ja sünnitusele inimestel ei ole teada.
Imetavad emad
Imetavate rottide piimas tuvastati ravimitega seotud materjal. Ei ole teada, kas AVANDIA eritub inimese rinnapiima. Kuna paljud ravimid erituvad inimese rinnapiima, ei tohiks AVANDIAt imetavale naisele manustada.
Kasutamine lastel
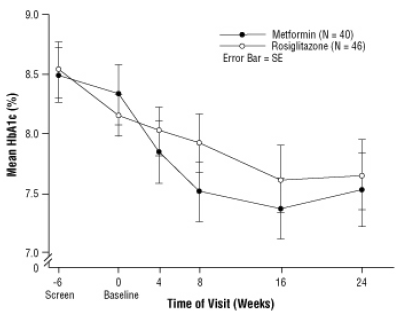
Pärast platseeboga sisenemist, sealhulgas dieedinõustamist, II tüüpi suhkurtõvega lapsed vanuses 10–17 aastat ja algse keskmise kehamassiindeksiga (KMI) 33 kg / m, randomiseeriti 24-nädalases topeltpimedas kliinilises ravis 2 mg kaks korda päevas AVANDIA-ga (n = 99) või 500 mg kaks korda päevas metformiiniga (n = 101). kohtuprotsess. Nagu eeldatud oli, vähenes FPG patsientidel, kes ei olnud diabeediravimit saanud (n = 104), ja suurenes patsientidel, kes olid eelneva ravi katkestanud (tavaliselt metformiin) (n = 90) sissejuhatava perioodi jooksul. Pärast vähemalt 8-nädalast ravi oli 49% AVANDIA-ga ravitud patsientidest ja 55% metformiiniga ravitud patsientidest annus kahekordistunud, kui FPG oli> 126 mg / dL. Ravikavatsuse üldpopulatsiooni korral oli 24. nädalal HbA1c keskmine muutus algväärtusest -0,14% AVANDIA ja -0,49% metformiiniga. Selles uuringus ei olnud patsientide arvu piisavalt, et statistiliselt kindlaks teha, kas neid on
täheldatud keskmine raviefekt oli sarnane või erinev. Ravitoime oli erinev diabeediravimiteta ravitud patsientide ja varem diabeediraviga ravitud patsientide osas (tabel 6).
Tabel 6. 24. nädal muutuvad lastel FPG ja HbA1c, võrreldes HbA1c algväärtusega> 6,5%.
| Naised patsiendid | Varem ravitud patsiendid | |||
|
Metformiin N = 40 |
Rosiglitasoon N = 45 |
Metformiin N = 43 |
Rosiglitasoon N = 32 |
|
| FPG (mg / dL) | ||||
| Baasjoon (keskmine) | 170 | 165 | 221 | 205 |
| Muutus algtasemest (keskmine) | -21 | -11 | -33 | -5 |
| Korrigeeritud ravierinevus * (rosiglitasoon-metformiin) - 95% CI | 8 (-15, 30) |
21 (-9, 51) |
||
| % patsientidest, kelle ≥ mg 30 mg / dL väheneb algtasemest | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Baasjoon (keskmine) | 8.3 | 8.2 | 8.8 | 8.5 |
| Muutus algtasemest (keskmine) | -0.7 | -0.5 | -0.4 | 0.1 |
| Korrigeeritud ravierinevus * (rosiglitasoon-metformiin) - 95% CI | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % patsientidest, kelle näitaja on 0,7% vähem kui algtasemel | 63% | 52% | 54% | 31% |
|
* Muutus algtaseme keskpunktist on väikseim ruut, keskmiselt HbA1c, soo ja piirkonna järgi kohandamine. †Erinevuse positiivsed väärtused eelistavad metformiini. |
Ravi erinevused sõltusid algtaseme KMI-st või kehakaalust selliselt, et AVANDIA ja metformiini toime tundus raskemate patsientide vahel paremini võrreldav. Keskmine kaalutõus oli 2,8 kg rosiglitasooni ja 0,2 kg metformiini kasutamisel [vt HOIATUSED JA HOIATUSED]. Viiskümmend neli protsenti rosiglitasooniga ravitud patsientidest ja 32% metformiiniga ravitud patsientidest saavutasid 2 kg ja 33% rosiglitasooniga ravitud patsientidest ja 7% metformiiniga ravitud patsientidest tõusis 5 kg Uuring.
Selles uuringus täheldatud kõrvaltoimeid kirjeldatakse jaotises Kõrvaltoimed).
Joonis 3. Keskmine HbA1c aja jooksul AVANDIA ja metformiini 24-nädalases uuringus lastel - Narkootikumide alarühm
Geriaatriline kasutamine
Populatsiooni farmakokineetilise analüüsi tulemused näitasid, et vanus ei mõjuta rosiglitasooni farmakokineetikat märkimisväärselt [vt KLIINILINE FARMAKOLOOGIA]. Seetõttu ei ole eakatel vaja annust kohandada. Kontrollitud kliinilistes uuringutes ei täheldatud vanemate (¥ ¥ ¥ 65-aastaste) ja nooremate (<65-aastaste) patsientide üldisi ohutuse ja efektiivsuse erinevusi.
ülaosa
Üleannustamine
Inimeste üleannustamise kohta on piiratud andmed. Kliinilistes uuringutes vabatahtlikega manustati AVANDIAt ühekordsete suukaudsete annustena kuni 20 mg ja see oli hästi talutav. Üleannustamise korral tuleb alustada patsiendi kliinilise seisundi järgi sobivat toetavat ravi.
ülaosa
Kirjeldus
AVANDIA (rosiglitasoonmaleaat) on suukaudne diabeedivastane aine, mis toimib peamiselt insuliinitundlikkuse suurendamise kaudu. AVANDIA parandab glükeemilist kontrolli, vähendades samal ajal ringleva insuliini taset.
Rosiglitasoonmaleaat ei ole keemiliselt ega funktsionaalselt seotud sulfonüüluurea, biguaniidide ega alfa-glükosidaasi inhibiitoritega.
Keemiliselt on rosiglitasoonmaleaat (±) -5 - [[4- [2- (metüül-2-püridinüülamino) etoksü] fenüül] metüül] -2,4-tiasolidiindioon, (Z) -2-butüleendioaat (1: 1) molekulmassiga 473,52 (vaba alus 357,44). Molekulil on üks kiraalne tsenter ja see on ratsemaat. Kiire vastastikuse muundamise tõttu on enantiomeerid funktsionaalselt eristamatud. Rosiglitasoonmaleaadi struktuurvalem on:
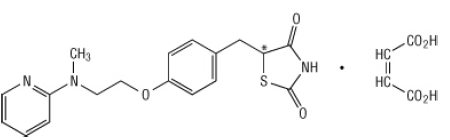
Molekulvalem on C18H19N3O3S-C4H4O4. Rosiglitasoonmaleaat on valge kuni tuhmvalge tahke aine sulamistemperatuuriga vahemikus 122–123 ° C. Rosiglitasoonmaleaadi pKa väärtused on 6,8 ja 6,1. See lahustub kergesti etanoolis ja a puhverdatud vesilahus, mille pH on 2,3; lahustuvus väheneb, kui füsioloogilises pH tase tõuseb vahemik.
Iga viisnurkne õhukese polümeerikattega TILTAB tablett sisaldab rosiglitasoonmaleaati, mis vastab suu kaudu manustatavale 2 mg, 4 mg või 8 mg rosiglitasoonile. Mitteaktiivsed koostisosad on: hüpromelloos 2910, laktoosmonohüdraat, magneesiumstearaat, mikrokristalne tselluloos, polüetüleenglükool 3000, naatriumtärklisglükolaat, titaandioksiid, triatsetiin ja vähemalt üks järgmistest: sünteetilised punased ja kollased raudoksiidid ja talk.
ülaosa
Kliiniline farmakoloogia
Toimemehhanism
Diabeedivastaste ravimite tiasolidiindioonide klassi kuuluv rosiglitasoon parandab glükeemilist kontrolli, parandades insuliinitundlikkust. Rosiglitasoon on peroksisoomi proliferaatori poolt aktiveeritava gamma-retseptori (PPARØ) väga selektiivne ja tugev agonist. Inimestel leidub PPAR-retseptoreid insuliini toime peamistes sihtkudedes, näiteks rasvkoes, skeletilihastes ja maksas. PPARγ tuumaretseptorite aktiveerimine reguleerib insuliini suhtes reageerivate geenide transkriptsiooni, mis on seotud glükoosi tootmise, transpordi ja kasutamise kontrollimisega. Lisaks osalevad PPAR acid³-reageerivad geenid ka rasvhapete metabolismi reguleerimises.
Insuliiniresistentsus on II tüübi diabeedi patogeneesi iseloomustav ühine tunnus. Rosiglitasooni diabeedivastast toimet on II tüüpi diabeedi loommudelites demonstreeritud milline hüperglükeemia ja / või halvenenud glükoositaluvus on sihtmärgi insuliiniresistentsuse tagajärg koed. Rosiglitasoon vähendab vere glükoosikontsentratsiooni ja vähendab rasvunud / rasvunud hiire, db / db diabeediga hiirte ja rasvhapete Zuckeri roti hüperinsulinemiat.
Loommudelites näitas rosiglitasooni antidiabeetilist toimet vahendatud suurenenud tundlikkus insuliini toime suhtes maksas, lihastes ja rasvkoes. Farmakoloogilised uuringud loommudelitel näitavad, et rosiglitasoon pärsib maksa glükoneogeneesi. Insuliini reguleeritud glükoositransporteri GLUT-4 ekspressioon oli rasvkoes suurenenud. Rosiglitasoon ei kutsunud esile II tüüpi diabeedi loommudelites hüpoglükeemiat ja / või halvenenud glükoositaluvust.
Farmakodünaamika
Lipiidide normist kõrvalekaldumisega patsiente ei olnud AVANDIA kliinilistest uuringutest välja jäetud.
Kõigis 26-nädalases kontrollitud uuringus seostati AVANDIA monoteraapiana soovitatava annuse vahemikus üldkolesterooli, LDL ja HDL tõusu ning vabade rasvhapete taseme langust. Need muutused erinesid statistiliselt olulisel määral platseebo või glüburiidi kontrollist (tabel 7).
LDL tõusis peamiselt AVANDIA-ravi esimese 1 kuni 2 kuu jooksul ja LDL tase püsis kogu uuringu vältel algtasemest kõrgemal. Seevastu HDL tõusis aja jooksul veelgi. Selle tulemusel saavutas LDL / HDL suhe haripunkti pärast 2-kuulist ravi ja näis seejärel aja jooksul langevat. Lipiidimuutuste ajalise iseloomu tõttu on lipiididele pikaajalise mõju hindamiseks kõige olulisem 52-nädalane glüburiidi kontrollitud uuring. Algväärtuse, 26. ja 52. nädala, keskmised LDL / HDL suhted olid AVANDIA 4 mg kaks korda ööpäevas vastavalt 3,1, 3,2 ja 3,0. Glüburiidi vastavad väärtused olid 3,2, 3,1 ja 2,9. Erinevused algtaseme muutustest AVANDIA ja glüburiidi vahel 52. nädalal olid statistiliselt olulised.
Pärast AVANDIA-raviga koos teiste hüpoglükeemiliste ainetega toimunud LDL- ja HDL-muutuste muutused olid üldiselt sarnased AVANDIA monoteraapia korral täheldatuga.
Triglütseriidide muutused AVANDIA-ravi ajal olid varieeruvad ja ei erinenud statistiliselt üldiselt platseebo või glüburiidi kontrollist.
Tabel 7. Kokkuvõte keskmistest lipiidide muutustest 26-nädalases platseebokontrollitud ja 52-nädalases glüburiidi kontrolliga monoteraapia uuringus
| Platseebo-kontrollitud uuringute nädal 26 | Glüburiidi kontrollitud õppenädal 26 ja 52. nädal | ||||||
| Platseebo | AVANDIA | Glüburiidi tiitrimine | AVANDIA 8 mg | ||||
| 4 mg päevas * | 8 mg päevas * | Wk 26 | Wk 52 | Wk 26 | Wk 52 | ||
| Vabad rasvhapped | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Baasjoon (keskmine)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Muutus algtasemest (keskmine) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Baasjoon (keskmine)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Muutus algtasemest (keskmine) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Baasjoon (keskmine)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Muutus algtasemest (keskmine) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Annustamisrühmad ühendati üks kord päevas ja kaks korda päevas. |
Farmakokineetika
Rosiglitasooni maksimaalne plasmakontsentratsioon (Cmax) ja kõvera alune pindala (AUC) suurenevad annusega proportsionaalselt terapeutiliste annuste vahemikus (tabel 8). Eliminatsiooni poolväärtusaeg on 3 kuni 4 tundi ja see ei sõltu annusest.
Tabel 8. Rosiglitasooni keskmised (SD) farmakokineetilised parameetrid pärast ühekordse suukaudse annuse manustamist (N = 32)
| Parameeter | 1 mg paastumist | 2 mg paastumist | 8 mg paastumist | 8 mg toitu |
| AUC0-inf [ng-tund / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Pool elu [h] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / tund] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = suukaudne kliirens. |
Imendumine
Rosiglitasooni absoluutne biosaadavus on 99%. Maksimaalne plasmakontsentratsioon täheldatakse umbes tund pärast manustamist. Rosiglitasooni manustamine koos toiduga ei muutnud üldist ekspositsiooni (AUC), kuid Cmax vähenes umbes 28% ja Tmax hilines (1,75 tundi). Need muutused ei ole tõenäoliselt kliiniliselt olulised; seetõttu võib AVANDIAt manustada koos toiduga või ilma.
Levitamine
Populatsiooni farmakokineetilise analüüsi põhjal on rosiglitasooni keskmine (CV%) suukaudne jaotusruumala (Vss / F) umbes 17,6 (30%) liitrit. Rosiglitasoon seondub umbes 99,8% plasmavalkudega, peamiselt albumiiniga.
Ainevahetus
Rosiglitasoon metaboliseerub ulatuslikult, muutumatul kujul ravimit ei eritu uriiniga. Metabolismi peamised viisid olid N-demetüülimine ja hüdroksüülimine, millele järgnes konjugeerimine sulfaadi ja glükuroonhappega. Kõik ringlevad metaboliidid on märkimisväärselt vähem tugevad kui lähteained ja seetõttu ei tohiks need eeldada rosiglitasooni insuliini sensibiliseerivat toimet.
In vitro andmed näitavad, et rosiglitasoon metaboliseeritakse valdavalt tsütokroom P450 (CYP) isoensüümi 2C8 kaudu, kusjuures CYP2C9 annab väikse osa sellest.
Eritumine
Pärast [14C] rosiglitasoonmaleaadi suukaudset või intravenoosset manustamist eritus umbes 64% ja 23% annusest uriiniga ja roojaga. [14C] -ga seotud materjali plasma poolväärtusaeg oli vahemikus 103 kuni 158 tundi.
Ravimi farmakokineetika II tüüpi diabeediga patsientidel
3 suure kliinilise uuringu populatsiooni farmakokineetilised analüüsid, milles osales 642 meest ja 405 II tüüpi diabeediga naist (vanuses 35 eluaastat) kuni 80 aastat) näitas, et rosiglitasooni farmakokineetikat ei mõjuta vanus, rass, suitsetamine ega alkohol tarbimine. Nii suuõõne kliirens (CL / F) kui ka suukaudne püsikontsentratsiooni jaotusruumala (Vss / F) suurenesid kehakaalu suurenemisega. Nendes analüüsides täheldatud kaaluvahemikus (50 kuni 150 kg) varieerusid ennustatud CL / F ja Vss / F väärtuste vahemikud vastavalt <1,7-kordselt ja <2,3-kordselt.
Lisaks näidati, et rosiglitasooni CL / F mõjutavad nii kehakaal kui ka sugu, olles naispatsientidel madalam (umbes 15%).
Eripopulatsioonid
Geriaatriline
Populatsiooni farmakokineetilise analüüsi tulemused (n = 716 <65 aastat; n = 331 - 65 aastat) näitas, et vanus ei mõjuta oluliselt rosiglitasooni farmakokineetikat.
Sugu
Populatsiooni farmakokineetika analüüsi tulemused näitasid, et rosiglitasooni keskmine suukaudne kliirens protsentides naispatsiendid (n = 405) olid umbes 6% madalamad kui sama kehakaaluga meespatsiendid (n = 642).
Monoteraapiana ja koos metformiiniga parandas AVANDIA glükeemilist kontrolli nii meestel kui naistel. Metformiini kombinatsiooniuuringutes tõestati efektiivsust sooliste erinevuste puudumisel glükeemilises vastuses.
Monoteraapia uuringutes täheldati naistel suuremat ravivastust; rasvunud patsientidel olid soolised erinevused siiski vähem ilmnevad. Teatud kehamassiindeksi (KMI) korral on naistel rasvamass suurem kui meestel. Kuna molekulaarne sihtmärk PPARγ ekspresseerub rasvkoes, võib see diferentseeruv omadus vähemalt osaliselt anda suurema vastuse AVANDIA-le naistel. Kuna ravi peaks olema individuaalne, ei ole annuse kohandamine ainuüksi soo tõttu vajalik.
Maksakahjustus
Rosiglitasooni seondumata suukaudne kliirens oli mõõduka kuni raske maksahaigusega (Child-Pugh klass B / C) patsientidel oluliselt madalam kui tervetel isikutel. Selle tulemusel suurenes seondumata Cmax ja AUC0-inf vastavalt 2 ja 3 korda. Rosiglitasooni eliminatsiooni poolväärtusaeg oli maksahaigusega patsientidel umbes 2 tundi pikem kui tervetel isikutel.
AVANDIA-ravi ei tohiks alustada, kui patsiendil on kliinilisi tõendeid aktiivsuse kohta maksahaigus või suurenenud seerumi transaminaaside sisaldus (ALAT> normi ülempiir 2,5X) algväärtusest [vaata HOIATUSED JA HOIATUSED].
Pediaatriline
Rosiglitasooni farmakokineetilised parameetrid määrati pediaatrilistel patsientidel populatsiooni farmakokineetilise analüüsi põhjal, hõredate andmetega 96-st pediaatrilised patsiendid ühes pediaatrilises kliinilises uuringus, hõlmates 33 meest ja 63 naist vanuses 10–17 aastat (kehakaal vahemikus 35–35 178,3 kg). Rosiglitasooni populatsiooni keskmine CL / F ja V / F oli vastavalt 3,15 L / h ja 13,5 L. Need CL / F ja V / F hinnangud olid kooskõlas täiskasvanute eelneva populatsiooni analüüsi tüüpiliste parameetrite hinnangutega.
Neerukahjustus
Kergekujuliste patsientidega rosiglitasooni farmakokineetikas kliiniliselt olulisi erinevusi ei ole raske neerukahjustuse korral või hemodialüüsist sõltuvatel patsientidel, võrreldes normaalse neerukahjustusega patsientidega funktsiooni. Seetõttu ei ole AVANDIAt saavatel patsientidel vaja annust kohandada. Kuna metformiin on neerukahjustusega patsientidel vastunäidustatud, on neil patsientidel metformiini samaaegne manustamine koos AVANDIA-ga.
Rass
Kaukaasia, mustanahaliste ja muude etniliste päritolude populatsiooni farmakokineetilise analüüsi tulemused näitavad, et rass ei mõjuta rosiglitasooni farmakokineetikat.
Ravimite ja ravimite koostoimed
Ravimid, mis pärsivad, indutseerivad või metaboliseeruvad tsütokroom P450 poolt
Ravimi metabolismi uuringud in vitro näitavad, et rosiglitasoon ei inhibeeri kliiniliselt olulistes kontsentratsioonides ühtegi peamist P450 ensüümi. In vitro andmed näitavad, et rosiglitasooni metaboliseerib peamiselt CYP2C8 ja vähemal määral 2C9. AVANDIA (4 mg kaks korda päevas) ei mõjutanud kliiniliselt olulist toimet nifedipiin ja suukaudsed kontratseptiivid (etinüülöstradiool ja noretindroon), mis metaboliseeritakse peamiselt autor CYP3A4.
Gemfibrosiil
CYP2C8 inhibiitori gemfibrosiili (600 mg kaks korda päevas) ja rosiglitasooni (4 mg üks kord) samaaegne manustamine päevas) 7 päeva jooksul suurenenud rosiglitasooni AUC 127%, võrreldes rosiglitasooni manustamisega (4 mg üks kord päevas) üksi. Arvestades rosiglitasooni annusest sõltuvate kõrvaltoimete võimalikkust, võib gemfibrosiili kasutuselevõtmisel olla vajalik rosiglitasooni annuse vähendamine [vt Narkomaaniavaheline tegevus].
Rifampin
Rifampini manustamine (600 mg üks kord päevas), mis on CYP2C8 indutseerija, vähendas 6 päeva jooksul rosiglitasooni AUC-d 66%, võrreldes ainult rosiglitasooni (8 mg) manustamisega [vt Narkomaaniavaheline tegevus].4
Glüburiid
AVANDIA (2 mg kaks korda päevas) koos glüburiidiga (3,75–10 mg / päevas) 7 päeva jooksul ei muutunud keskmine püsikontsentratsiooni 24-tunnine plasma glükoosikontsentratsioon suhkruhaigetel stabiliseerus glüburiidil teraapia. AVANDIA (8 mg üks kord päevas) korduvad annused 8 päeva jooksul tervetel täiskasvanud Kaukaasia katsealustel vähendasid glüburiidi AUC ja Cmax umbes 30%. Jaapani isikutel tõusid glüburiidi AUC ja Cmax pärast AVANDIA koosmanustamist pisut.
Glimepiriid
Glimepiriidi ühekordsed suukaudsed annused 14 tervel täiskasvanud isikul ei avaldanud kliiniliselt olulist mõju AVANDIA püsiseisundi farmakokineetikale. Glimepiriidi AUC ja C kliiniliselt olulist vähenemist ei esinemax täheldati tervetel täiskasvanutel 8 päeva jooksul pärast AVANDIA korduvate annuste (8 mg üks kord päevas) manustamist.
Metformiin
AVANDIA (2 mg kaks korda päevas) ja metformiini (500 mg kaks korda päevas) samaaegne manustamine tervislikena 4-päevastel vabatahtlikel ei olnud mingit mõju metformiini ega metformiini tasakaalukontsentratsiooni faasis rosiglitasoon.
Akarboos
Asartoosi (100 mg kolm korda päevas) 7 päeva vältel koosmanustamisel tervetel vabatahtlikel ei olnud kliiniliselt olulist mõju AVANDIA ühekordse suukaudse annuse farmakokineetikale.
Digoksiin
AVANDIA (8 mg üks kord päevas) korduv suukaudne manustamine 14 päeva jooksul ei muutnud tervetel vabatahtlikel digoksiini (0,375 mg üks kord ööpäevas) farmakokineetikat tasakaalukontsentratsiooni faasis.
Varfariin
AVANDIA korduval manustamisel ei olnud kliiniliselt olulist mõju varfariini enantiomeeride püsikontsentratsiooni faasi farmakokineetikale.
Etanool
Mõõduka koguse alkoholi ühekordne manustamine ei suurendanud AVANDIA-ga ravitavate II tüüpi suhkurtõvega patsientide ägeda hüpoglükeemia riski.
Ranitidiin
Eeltöötlemine ranitidiiniga (150 mg kaks korda päevas 4 päeva jooksul) ei muutnud tervetel vabatahtlikel rosiglitasooni ühekordsete suukaudsete ega intravenoossete annuste farmakokineetikat.
Need tulemused viitavad sellele, et suukaudse rosiglitasooni imendumine ei muutu tingimustes, millega kaasneb seedetrakti pH tõus.
ülaosa
Mittekliiniline toksikoloogia
Kantserogenees, mutagenees, viljakuse langus
Kantserogenees:
Charles Riveri CD-1 hiirtel viidi läbi 2-aastane kantserogeensuse uuring annustega 0,4, 1,5 ja 6 mg / kg päevas toitumine (suurim annus, mis on ekvivalentne inimese AUC-ga umbes 12-kordse maksimaalse soovitatava päevase annusega annus). Sprague-Dawley rottidele manustati suukaudse manustamisega 2 aastat annuseid 0,05, 0,3 ja 2 mg / kg päevas (suurim annuse ekvivalent) kuni umbes 10 ja 20-kordne inimese AUC inimese maksimaalse soovitatava ööpäevase annuse korral isastel ja emastel rottidel, vastavalt).
Rosiglitasoon ei olnud hiire kantserogeenne. Hiirtel suurenes rasvhapete hüperplaasia esinemissagedus annustes 1,5 mg / kg päevas (umbes 2-kordne inimese AUC inimese maksimaalses soovitatavas päevases annuses). Rottidel esines healoomuliste rasvkoe kasvajate (lipoomide) esinemissageduse märkimisväärset suurenemist annustes 0,3 mg / kg päevas (umbes 2-kordne inimese AUC inimese maksimaalses soovitatavas ööpäevases annuses). Neid proliferatiivseid muutusi mõlemas liigis peetakse rasvkoe püsiva farmakoloogilise ülestimulatsiooni tõttu.
Mutagenees:
Rosiglitasoon ei olnud mutageenne ega klastogeenne geenimutatsiooni in vitro bakteri kromosoomaberratsiooni test inimese lümfotsüütides, hiire in vivo mikrotuuma test ja roti in vivo / in vitro UDS test. In vitro hiire lümfoomi testis oli metaboolse aktiveerimise juuresolekul mutatsioonide arv väike (umbes 2-kordne) suurenemine.
Viljakuse langus:
Rosiglitasoon ei mõjutanud isaste rottide paaritumist ega viljakust, kui ravimit manustati kuni 40 mg / kg päevas (umbes 116-kordne inimese AUC inimese maksimaalses soovitatavas päevases annuses). Rosiglitasoon muutis emaste rottide estroosset tsüklilisust (2 mg / kg päevas) ja vähendas viljakust (40 mg / kg päevas) koos madalamate progesterooni ja östradiooli plasmakontsentratsioon (inimese maksimaalses soovitatavas ööpäevases annuses AUC umbes 20 ja 200 korda), vastavalt). Annusel 0,2 mg / kg päevas (umbes 3-kordne inimese AUC inimese maksimaalses soovitatavas ööpäevases annuses) selliseid toimeid ei täheldatud. Noortel rottidel, kellele manustati annust alates 27. päevast kuni suguküpsuseni (annuses kuni 40 mg / kg päevas), ei olnud mingit mõju isasloomade reproduktiivsusele ega naistel estrilise tsüklilisuse, paaritumisvõime või raseduse esinemissageduse osas (umbes 68-kordne inimese AUC inimese maksimaalses päevases päevas annus). Ahvidel rosiglitasoon (0,6 ja 4,6 mg / kg päevas; vastavalt inimese maksimaalse soovitatava ööpäevase annuse korral umbes 3 ja 15-kordne inimese AUC) vähendas folliikulite faasi tõusu seerumi östradioolis koos luteiniseeriva hormooni lisandumise vähenemisega, madalama luteaalfaasi progesterooni tasemega ja amenorröa. Nende toimemehhanism näib olevat munasarjade steroidogeneesi otsene pärssimine.
Loomade toksikoloogia
Rosiglitasooniga suurendati südamekaalu hiirtel (3 mg / kg / päevas), rottidel (5 mg / kg / päevas) ja koertel (2 mg / kg / päevas). ravi (vastavalt umbes 5, 22 ja 2-kordne inimese AUC inimese maksimaalses soovitatavas ööpäevases annuses). Toime noorloomadel oli sama, mis täiskasvanutel. Morfomeetriline mõõtmine näitas, et südame vatsakeste kudedes esines hüpertroofiat, mis võib olla tingitud südame ruumala laienemise tagajärjel suurenenud südame tööst.
ülaosa
Kliinilised uuringud
Monoteraapia
Kliinilistes uuringutes parandas AVANDIA-ravi glükeemilist kontrolli, mida mõõdeti FPG ja HbA1c-ga, vähendades samaaegselt insuliini ja C-peptiidi. Samuti vähenes söögijärgne glükoos ja insuliin. See on kooskõlas AVANDIA kui insuliini sensibilisaatori toimemehhanismiga.
Maksimaalne soovitatav ööpäevane annus on 8 mg. Annustes tehtavad uuringud näitasid, et kogu päevane annus 12 mg ei andnud täiendavat kasu.
Lühiajalised kliinilised uuringud: AVANDIA-ga monoteraapiana raviti 6 topeltpimedas kokku 2 315 II tüüpi diabeediga patsienti, keda varem raviti ainult dieediga või antidiabeetiliste ravimitega. uuringud, mis hõlmasid kahte 26-nädalast platseebokontrollitud uuringut, ühte 52-nädalast glüburiidi kontrollitud uuringut ja 3 platseebokontrollitud annusevahemiku uuringut, mille kestus oli 8 kuni 12 nädalat. Varasemad diabeedivastased ravimid katkestati ja patsiendid lülitasid enne randomiseerimist 2 kuni 4-nädalase platseeboga tutvumisperioodi.
Kaks 26-nädalast topeltpimedat, platseebokontrolliga uuringut II tüüpi diabeediga (n = 1401) patsientidel, kellel glükeemia oli ebapiisav kontroll (keskmine FPG algtase umbes 228 mg / dL [101 kuni 425 mg / dL] ja keskmine HbA1c algväärtus 8,9% [5,2% kuni 16,2%]) olid läbi viidud. AVANDIA-ravi andis statistiliselt olulist paranemist FPG ja HbA1c väärtuses võrreldes algtasemega ja platseeboga võrreldes. Nende uuringute andmed on kokku võetud tabelis 9.
Tabel 9: glükeemilised parameetrid 26-nädalases platseebokontrolliga uuringus
| Platseebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg üks kord päevas N = 180 |
2 mg kaks korda päevas N = 186 |
8 mg üks kord päevas N = 181 |
4 mg kaks korda päevas N = 187 |
||
| FPG (mg / dL) | |||||
| Baasjoon (keskmine) | 225 | 229 | 225 | 228 | 228 |
| Muutus algtasemest (keskmine) | 8 | -25 | -35 | -42 | -55 |
| Erinevus platseebost (korrigeeritud keskmine) | - | -31* | -43* | -49* | -62* |
| % patsientidest, kelle ≥ mg 30 mg / dL väheneb algtasemest | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Baasjoon (keskmine) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Muutus algtasemest (keskmine) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Erinevus platseebost (korrigeeritud keskmine) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % patsientidest, kelle näitaja on 0,7% vähem kui algtasemel | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 võrreldes platseeboga. |
Kui seda manustati samas päevases koguannuses, oli AVANDIA üldiselt efektiivsem FPG ja HbA1c vähendamisel, kui seda manustati jagatud annustena kaks korda päevas, võrreldes ühekordsete ööpäevaste annustega. HbA1c korral ei olnud erinevus 4 mg üks kord ööpäevas ja 2 mg kaks korda päevas annuste vahel statistiliselt oluline.
Pikaajalised kliinilised uuringud
Toime pikaajalist säilimist hinnati 52-nädalases topeltpimedas glüburiidi kontrollitud uuringus II tüüpi diabeediga patsientidel. Patsiendid randomiseeriti 52 nädala jooksul raviga AVANDIA 2 mg kaks korda päevas (N = 195) või AVANDIA 4 mg kaks korda päevas (N = 189) või glüburiidiga (N = 202). Glüburiidi saanud patsientidele anti algannus kas 2,5 mg / päevas või 5,0 mg / päevas. Seejärel tiitriti annust järgmise 12 nädala jooksul 2,5 mg / päevas sammuga kuni maksimaalse annuseni 15,0 mg päevas, et optimeerida glükeemilist kontrolli. Seejärel hoiti glüburiidi annust konstantsena.
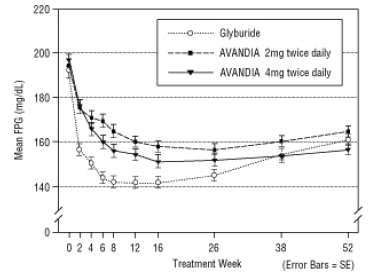
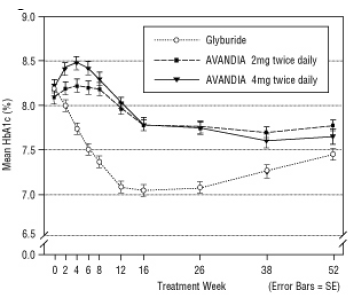
Glüburiidi tiitritud keskmine annus oli 7,5 mg. Kõik ravimeetodid parandasid statistiliselt olulist glükeemilise kontrolli paranemist võrreldes algtasemega (joonis 4 ja joonis 5). 52. nädala lõpus oli FPG ja HbA1c langus algtasemest -40,8 mg / dl ja -0,53% AVANDIA 4 mg kaks korda päevas manustamisel; -25,4 mg / dL ja -0,27% AVANDIA 2 mg kaks korda päevas manustamisel; ja -30,0 mg / dL ja -0,72% glüburiidiga. HbA1c puhul ei olnud erinevus AVANDIA 4 mg kaks korda päevas ja glüburiidi vahel 52. nädalal statistiliselt oluline. Algne FPG langus glüburiidiga oli suurem kui AVANDIA korral; see mõju oli aja jooksul siiski vähem vastupidav.
Glükeemilise kontrolli paranemine, mida täheldati AVANDIA 4 mg kaks korda päevas 26. nädalal, püsis uuringu 52. nädalal.
Joonis 4. Keskmine FPG aja jooksul 52-nädalases glüburiidi kontrollitud uuringus
Joonis 5. Keskmine HbA1c aja jooksul 52-nädalases glüburiidi kontrollitud uuringus
Hüpoglükeemiat esines 12,1% -l glüburiidiga ravitud patsientidest, võrreldes 0,5% -ga (2 mg kaks korda päevas) ja 1,6% -l (4 mg kaks korda päevas) AVANDIA-ga ravitud patsientidest. Glükeemilise kontrolli paranemist seostati keskmise kaalutõusuga 1,75 kg ja 2,95 kg patsiendid, kellele manustati vastavalt 2 mg ja 4 mg AVANDIAt kaks korda päevas, võrreldes 1,9 kg glüburiidiga ravitud patsientidega patsiendid. AVANDIA-ga ravitud patsientidel olid C-peptiidi, insuliini, proinsuliini ja proinsuliini poolitusproduktid märkimisväärselt vähenenud annuse järgi järjestatud viisil, võrreldes glüburiidiga töödeldud koguse suurenemisega patsiendid.
Diabeedi tulemuse progresseerumise uuring (ADOPT) oli 4–6 aasta jooksul läbi viidud mitmekeskne, topeltpime, kontrollitud uuring (N = 4 351), et võrrelda ohutust ja efektiivsust AVANDIA, metformiini ja glüburiidi monoteraapia patsientidel, kellel hiljuti diagnoositi II tüüpi suhkurtõbi (¤ 3 aastat), kellel dieedi ja harjutus. Selles uuringus oli patsientide keskmine vanus 57 aastat ja enamikul patsientidest (83%) ei olnud südame-veresoonkonna haigusi varem teada. Keskmine FPG ja HbA1c algtase oli vastavalt 152 mg / dL ja 7,4%. Patsiendid randomiseeriti saama kas AVANDIA 4 mg üks kord päevas, glüburiidi 2,5 mg üks kord päevas või metformiini 500 mg üks kord päevas ja annused tiitritud optimaalse glükeemilise kontrolli saavutamiseks, maksimaalselt 4 mg kaks korda päevas AVANDIA, 7,5 mg kaks korda päevas glüburiidi ja 1000 mg kaks korda päevas metformiin. Esmane efektiivsuse tulemus oli aeg järjestikuse FPG tasemeni> 180 mg / dL pärast vähemalt 6-nädalast ravi maksimaalselt uuringuravimi talutav annus või aeg ebapiisava glükeemilise kontrolli saavutamiseks, mis on määratud sõltumatu kohtuotsusega Komisjon.
Esmase efektiivsuse tulemuse kumulatiivne esinemissagedus 5 aasta pärast oli AVANDIA puhul 15%, metformiini kasutamisel 21% ja 34% glüburiidiga (riskisuhe 0,68 [95% CI 0,55, 0,85] versus metformiin, HR 0,37 [95% CI 0,30, 0,45] versus glüburiid).
Andmeid ADANDT AVANDIA, metformiini ja glüburiidi kohta südame-veresoonkonna ja kõrvaltoimete kohta (sealhulgas mõju kehakaalule ja luumurdudele) on kirjeldatud HOIATUSED JA HOIATUSED ja KÕRVALTOIMEDvastavalt. Nagu kõigi ravimite puhul, tuleb efektiivsuse tulemusi koos ohutusteabega arvestada, et hinnata konkreetse patsiendi potentsiaalset kasu ja riski.
Kombinatsioon metformiini või sulfonüüluureaga
AVANDIA lisamine metformiinile või sulfonüüluureale põhjustas hüperglükeemia olulist vähenemist võrreldes kummagi toimeainega üksi. Need tulemused on kooskõlas aditiivse toimega glükeemilisele kontrollile, kui AVANDIAt kasutatakse kombinatsioonravina.
Kombinatsioon metformiiniga
Kokku osales kahes 26-nädalases, 26-nädalases randomiseeritud topeltpimedas platseebo / aktiivselt kontrollitud uuringud AVANDIA efektiivsuse hindamiseks koos metformiin. AVANDIA, mida manustati kas üks kord päevas või kaks korda päevas, lisati nende patsientide ravile, kelle metformiini maksimaalne annus (2,5 grammi päevas) oli ebapiisavalt kontrollitud.
Ühes uuringus ei kontrollinud patsiendid metformiini annust 2,5 grammi päevas (keskmine FPG algväärtus 216 mg / dL ja keskmine algtase) HbA1c 8,8%) randomiseeriti saama 4 mg AVANDIAt üks kord päevas, 8 mg AVANDIAt üks kord päevas või platseebot lisaks metformiin. FPG ja HbA1c statistiliselt olulist paranemist täheldati patsientidel, keda raviti järgmiste ravimitega: metformiini ja 4 mg AVANDIAt üks kord päevas ja 8 mg AVANDIAt üks kord päevas, võrreldes patsientidega, kes said ainult metformiini (Tabel 10).
Tabel 10. Glükeemilised parameetrid AVANDIA Plus Metformiini 26-nädalases kombineeritud uuringus
| Metformiin N = 113 |
AVANDIA 4 mg üks kord päevas + metformiin N = 116 |
AVANDIA 8 mg üks kord päevas + metformiin N = 110 |
|
| FPG (mg / dL) | |||
| Baasjoon (keskmine) | 214 | 215 | 220 |
| Muutus algtasemest (keskmine) | 6 | -33 | -48 |
| Erinevus ainult metformiinist (korrigeeritud keskmine) | - | -40* | -53* |
| % patsientidest, kelle ≥ mg 30 mg / dL väheneb algtasemest | 20% | 45% | 61% |
| HbA1c (%) | |||
| Baasjoon (keskmine) | 8.6 | 8.9 | 8.9 |
| Muutus algtasemest (keskmine) | 0.5 | -0.6 | -0.8 |
| Erinevus ainult metformiinist (korrigeeritud keskmine) | - | -1.0* | -1.2* |
| % patsientidest, kelle näitaja on 0,7% vähem kui algtasemel | 11% | 45% | 52% |
| * p <0,0001 võrreldes metformiiniga. |
Teises 26-nädalases uuringus osalesid II tüüpi diabeediga patsiendid, kelle metformiini annus 2,5 grammi päevas ei olnud piisav ja kes randomiseeriti saama AVANDIA 4 mg kaks korda päevas ja metformiin (N = 105) näitas statistiliselt olulist glükeemilise kontrolli paranemist, FPG keskmine raviefekt oli -56 mg / dL ja HbA1c keskmine raviefekt -0,8% metformiin üksi. Metformiini ja AVANDIA kombinatsioon põhjustas FPG ja HbA1c madalama taseme kui kumbki agent üksi.
Patsiendid, kelle metformiini maksimaalne annus (2,5 grammi päevas) oli ebapiisavalt kontrollitud ja kes olid monoteraapiale üleminek AVANDIA-ga näitas glükeemilise kontrolli kaotust, mida tõendab FPG suurenemine ja HbA1c. Selles rühmas täheldati ka LDL ja VLDL tõusu.
Kombinatsioon sulfonüüluureaga
Kümne 24- kuni 26-nädalases randomiseeritud, topeltpimedas, platseebo / aktiivselt kontrollitud uuringus osales kokku 3457 II tüüpi diabeediga patsienti. 2-aastane topeltpime, aktiivselt kontrollitud uuring eakatel patsientidel, mille eesmärk oli hinnata AVANDIA efektiivsust ja ohutust koos sulfonüüluurea. AVANDIA 2 mg, 4 mg või 8 mg päevas manustati kas üks kord päevas (3 uuringut) või jagatud annustena kaks korda päevas (7 uuringut) patsientidele, kelle submaksimaalne või maksimaalne annus on ebapiisavalt kontrollitud sulfonüüluurea.
Nendes uuringutes oli AVANDIA 4 mg või 8 mg ööpäevas (manustatuna ühekordse või kaks korda päevas jagatud annusena) ja a kombinatsioon sulfonüüluurea vähendas märkimisväärselt FPG ja HbA1c, võrreldes platseebo ja sulfonüüluureaga või täiendava tiitrimisega sulfonüüluurea. Tabelis 11 on esitatud 8 uuringu koondatud andmed, milles AVANDIAt lisati sulfonüüluureale platseebo ja sulfonüüluureaga.
Tabel 11. Glükeemilised parameetrid AVANDIA Plus sulfonüüluurea 24- kuni 26-nädalasetes kombinatsiooniuuringutes
| Kaks korda päevas jagatud annustamine (5 uuringut) | Sulfonüüluurea N = 397 |
AVANDIA 2 mg kaks korda päevas + sulfonüüluurea N = 497 |
Sulfonüüluurea N = 248 |
AVANDIA 4 mg kaks korda päevas + sulfonüüluurea N = 346 |
| FPG (mg / dL) | ||||
| Baasjoon (keskmine) | 204 | 198 | 188 | 187 |
| Muutus algtasemest (keskmine) | 11 | -29 | 8 | -43 |
| Erinevus ainult sulfonüüluurea hulgast (korrigeeritud keskmine) | - | -42* | - | -53* |
| % patsientidest, kelle ≥ mg 30 mg / dL väheneb algtasemest | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Baasjoon (keskmine) | 9.4 | 9.5 | 9.3 | 9.6 |
| Muutus algtasemest (keskmine) | 0.2 | -1.0 | 0.0 | -1.6 |
| Erinevus ainult sulfonüüluurea hulgast (korrigeeritud keskmine) | - | -1.1* | - | -1.4* |
| % patsientidest, kelle näitaja on 0,7% vähem kui algtasemel | 21% | 60% | 23% | 75% |
| Üks kord päevas manustamine (3 uuringut) | Sulfonüüluurea N = 172 |
AVANDIA 4 mg üks kord päevas + sulfonüüluurea N = 172 |
Sulfonüüluurea N = 173 |
AVANDIA 8 mg üks kord päevas + sulfonüüluurea N = 176 |
| FPG (mg / dL) | ||||
| Baasjoon (keskmine) | 198 | 206 | 188 | 192 |
| Muutus algtasemest (keskmine) | 17 | -25 | 17 | -43 |
| Erinevus ainult sulfonüüluurea hulgast (korrigeeritud keskmine) | - | -47* | - | -66* |
| % patsientidest, kelle ≥ mg 30 mg / dL väheneb algtasemest | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Baasjoon (keskmine) | 8.6 | 8.8 | 8.9 | 8.9 |
| Muutus algtasemest (keskmine) | 0.4 | -0.5 | 0.1 | -1.2 |
| Erinevus ainult sulfonüüluurea hulgast (korrigeeritud keskmine) | - | -0.9* | - | -1.4* |
| % patsientidest, kelle näitaja on 0,7% vähem kui algtasemel | 11% | 36% | 20% | 68% |
| * p <0,0001, võrreldes ainult sulfonüüluureaga. |
Ühes 24- kuni 26-nädalases uuringus osalesid patsiendid, kelle glüburiidi maksimaalsete annuste kontroll oli ebapiisav ja kes vahetasid monoteraapiana 4 mg AVANDIAt päevas; selles rühmas demonstreeriti glükeemilise kontrolli kaotust, mida tõendab FPG ja HbA1c suurenemine.
2-aastases topeltpimedas uuringus randomiseeriti eakatel patsientidel (vanuses 59 kuni 89 aastat) poolmaksimaalsest sulfonüüluurea preparaadist (glipisiid 10 mg kaks korda päevas) AVANDIA (n = 115, 4 mg üks kord päevas kuni 8 mg) lisamine või glipisiidi jätkuv tiitrimine (n = 110) maksimaalselt 20 mg-ni kaks korda iga päev. Keskmine algtaseme FPG ja HbA1c olid vastavalt AVANDIA pluss glipisiidi rühmas vastavalt 157 mg / dL ja 7,72% ning glipisiidi üles tiitrimise rühmas vastavalt 159 mg / dL ja 7,65%. Glükeemilise kontrolli kaotus (FPG â ‰ mg mg 180 mg / dL) esines AVANDIA ja glipisiidi saanud patsientidest märkimisväärselt väiksemal osal (2%) kui glipisiidi suurendava tiitrimisrühma patsientidel (28,7%). Ligikaudu 78% patsientidest, kes said kombineeritud ravi, lõpetasid 2-aastase ravi, ainult 51% lõpetasid glipisiidi monoteraapia. Kombineeritud ravi mõju FPG-le ja HbA1c-le oli patsientide seas 2-aastase uuringuperioodi jooksul püsiv saavutades FPG jaoks keskmiselt 132 mg / dL ja HbA1c korral keskmiselt 6,98%, võrreldes glipisiidi muutustega arm.
Kombinatsioon sulfonüüluurea pluss metformiiniga
Kahes 24–26-nädalases topeltpimedas, platseebokontrollitud uuringus AVANDIA efektiivsuse ja ohutuse hindamiseks kombinatsioonis sulfonüüluurea ja metformiiniga, AVANDIA 4 mg või 8 mg päevas, manustati jagatud annustena kaks korda päevas patsientidele, kelle glüburiidi submaksimaalse (10 mg) ja maksimaalse (20 mg) annuse ning metformiini maksimaalse annuse (2 g / päevas). Sulfonüüluurea kombinatsioonidega ravitud patsientidel täheldati FPG ja HbA1c statistiliselt olulist paranemist pluss metformiin ja 4 mg AVANDIA ning 8 mg AVANDIA, võrreldes patsientidega jätkati sulfonüüluurea ja metformiini kasutamist, nagu on näidatud tabelis 12.
Tabel 12. Glükeemilised parameetrid AVANDIA Plus sulfonüüluurea ja metformiini 26-nädalases kombineeritud uuringus
| Sulfonüüluurea + metformiin N = 273 |
AVANDIA 2 mg kaks korda päevas + sulfonüüluurea + metformiin N = 276 |
AVANDIA 4 mg kaks korda päevas + sulfonüüluurea + metformiin N = 277 |
|
| FPG (mg / dL) | |||
| Baasjoon (keskmine) | 189 | 190 | 192 |
| Muutus algtasemest (keskmine) | 14 | -19 | -40 |
| Erinevus sulfonüüluurea ja metformiiniga võrreldes (korrigeeritud keskmine) | - | -30* | -52* |
| % patsientidest, kelle ≥ mg 30 mg / dL väheneb algtasemest | 16% | 46% | 62% |
| HbA1c (%) | |||
| Baasjoon (keskmine) | 8.7 | 8.6 | 8.7 |
| Muutus algtasemest (keskmine) | 0.2 | -0.4 | -0.9 |
| Erinevus sulfonüüluurea ja metformiiniga võrreldes (korrigeeritud keskmine) | - | -0.6* | -1.1* |
| % patsientidest, kelle näitaja on 0,7% vähem kui algtasemel | 16% | 39% | 63% |
| * p <0,0001 võrreldes platseeboga. |
ülaosa
Viited
- Toidu- ja ravimiameti infodokument. Endokriinsete metaboolsete ravimite ning ravimiohutuse ja riskijuhtimise nõuandekomiteede ühine koosolek. Juuli 2007.
- DREAM kohtuprotsessi uurijad. Rosiglitasooni mõju suhkruhaiguse sagedusele halvenenud glükoositaluvuse või tühja kõhuga glükoositaseme korral: juhuslik kontroll Lancet 2006;368:1096-1105.
- Kodu PD, Pocock SJ, Beck-Nielsen H, et al. Rosiglitasooni hinnati kardiovaskulaarsete tulemuste osas - vaheanalüüs. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH jt. Rifampini mõju rosiglitasooni farmakokineetikale tervetel isikutel. Clin Pharmacol Ther 2004; 75: 157-162.
ülaosa
Kuidas komplekteeritud / ladustamine ja käitlemine
Iga viisnurkne õhukese polümeerikattega TILTAB tablett sisaldab rosüglitasooni maleaadina järgmiselt: 2 mg roosa, ühele küljele pressitud SB ja teisele 2; 4 mg oranži, ühele küljele pressitud SB ja teisele 4; 8 mg-punakaspruun, ühele küljele on pressitud SB ja teisele 8.
- 2 mg pudelid 60-ga: NDC 0029-3158-18
- 4 mg pudelid 30: NDC 0029-3159-13
- 4 mg pudelid 90-ga: NDC 0029-3159-00
- 8 mg pudelid 30: NDC 0029-3160-13
- 8 mg pudelid 90-ga: NDC 0029-3160-59
Hoida temperatuuril 25 ° C (77 ° F); ekskursioonid 15–30 ° C (59–86 F). Väljastage tihedas, valgusekindlas pakendis.
viimati uuendatud 02/2008
Avandia, rosiglitasoonmaleaat, teave patsientide kohta (lihtsas inglise keeles)
Üksikasjalik teave diabeedi märkide, sümptomite, põhjuste, ravi kohta
Selles monograafias sisalduv teave ei ole mõeldud hõlmama kõiki võimalikke kasutusviise, juhiseid, ettevaatusabinõusid, ravimite koostoimet või kahjulikke mõjusid. See teave on üldistatud ja ei ole mõeldud spetsiaalse meditsiinilise nõuandena. Kui teil on küsimusi kasutatavate ravimite kohta või soovite lisateavet, pidage nõu arsti, apteekri või meditsiiniõega.
tagasi:Sirvige kõiki diabeediravimeid



